纳米Au/核酸适配体/硅量子点荧光传感体系用于黄曲霉毒素B1分析检测
2020-03-20易守军唐春然曾云龙
易守军 黎 燕 张 敏 何 盼 赵 敏 唐春然 曾云龙*
(1.湖南科技大学化学化工学院,理论有机和功能分子教育部重点实验室,精细聚合物可控制备与功能应用湖南省重点实验室湖南湘潭 411201;2.湖南科技大学材料科学与工程学院湖南湘潭 411201)
量子点(QDs)具有优异的光学、电学特性和优良的生物相容性,在化学、医学、材料科学、生命科学、环境科学、成像技术和化学生物传感领域中得到广泛应用[1,2]。早期研究的QDs主要由Ⅱ-Ⅵ族或Ⅲ-Ⅴ族元素组成的纳米晶[2],但在制备与应用过程中存在环境生物毒性风险。为了解决这些不足,科技工作者研发了许多新型QDs[3,4],SiQDs就是其中的一类[5]。SiQDs具有优异的光电特性,且制备方法简单,环境友好,非常适于构建化学生物传感检测平台[6,7]。然而,SiQDs在化学生物传感中的应用研究还不够,尤其是在生物毒素检测方面的研究更少。
黄曲霉毒素B1(Aflatoxin B1,AF B1)具有强毒性,是已知的最强致癌物之一[8,9]。产生黄曲霉毒素的黄曲霉和寄生曲霉广泛存在于土壤、灰尘、植物及其果实中,受其污染的植物与果实会留下其代谢物黄曲霉毒素,这也是AF B1引发食品安全的原因之一。因此,对食品与药品中AF B1的监测非常必要。目前检测AF B1的方法主要有色谱/质谱法、高效液相色谱法、免疫法等[10-12]。但这些方法通常存在需要昂贵的仪器设备,技术要求高,所用试剂非常容易失活,分析成本高等不足。核酸适配体(Aptamer)具有高特异性识别与结合功能,使待测试样的处理大为简化,与抗原/抗体等试剂相比,核酸适配体稳定性高、成本低廉,因此,被广泛地用于食品药品分析、环境检测、药物筛选等领域[13-15]。本工作拟以咪唑基水溶性SiQDs为荧光探针,发展新型高灵敏度、高选择性AF B1生物传感检测方法。
1 实验部分
1.1 仪器与试剂
RF-5301型荧光分光光度计(日本,岛津);DHG-9146A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);KQ-50DB型数控超声波清洗器(昆山市超声仪器有限公司);FHS-2A型可调高速匀质机(策途精密机械上海有限公司)。
黄曲霉毒素B1(AF B1)、黄曲霉毒素B2(AF B2)、黄曲霉毒素G1(AF G1)、赭曲霉毒素A(OTA)、伏马毒素B1(F B1)、脱氧雪腐镰刀菌烯醇(DON)和玉米赤霉烯酮(ZEN)(北京华安麦科生物技术有限公司)。对AF B1具有特异性响应的巯基修饰的寡核苷酸序列(OLN):HS-AAA AAA GTT GGG CAC GTG TTG TCT CTC TGT GTC TCG TGC CCT TCG CTA GGC CCA CA[13]由生工生物工程(上海)股份有限公司提供。三甲基硅咪唑、柠檬酸三钠、HAuCl4、NaH2PO4、K2HPO4、三(2-羧基乙基)膦盐酸盐(TCEP)等均为分析纯(上海阿拉丁生化科技股份有限公司),其它试剂均为分析纯。2.7 nmol/L Au纳米粒子(AuNPs)按文献方法[16]制备,其浓度按文献方法[17]测得。实验用水为二次蒸馏水。
1.2 实验方法
1.2.1 水溶性SiQDs的制备水溶性SiQDs按文献方法[7]合成。将1.0 g柠檬酸三钠溶于27 mL水,快速搅拌下滴加6.7 mL三甲基硅咪唑,于室温下避光继续搅拌30 min,然后转入高压反应釜,在220 ℃下反应2 h,让其在空气中自然冷却至室温,将水热反应制备的溶液置于1 kDa透析袋中透析除去大颗粒杂质,即得到SiQDs分散液,置于4 ℃储存备用。临用时,取此储备液用水稀释20倍。
1.2.2 AuNPs/寡核苷酸/SiQDs复合物制备按文献方法[18],将巯基修饰的OLN经TCEP活化,然后加入AuNPs,摇匀,再用pH=3.0 的0.5 mol/L酒石酸-HCl缓冲溶液稀释,孵化30 min后,离心,弃去离心液,再用pH=5.5的10 mmol/L磷酸盐缓冲溶液(PBS)冲洗沉淀,离心分离,如此三次后,将沉淀分散至水中,得到AuNPs/OLN分散液。向AuNPs/OLN分散液中加入SiQDs溶液,再加入pH=5.5的PBS(10 mmol/L),摇匀,静置反应10 min,即得AuNPs/OLN/SiQDs复合物,离心沉降,弃去离心液,沉淀用pH=5.5 PBS洗涤3次,离心,除去离心液,制得AuNPs/OLN/SiQDs复合物。将所制备的AuNPs/OLN/SiQDs超声分散于pH=7.5 PBS中,即得AuNPs/OLN/SiQDs分散液,备用。
1.2.3 AF B1分析取AuNPs/OLN/SiQDs复合物分散液,向该分散溶液中加入不同浓度AF B1标准系列溶液,混匀反应5 min,离心分离(12 000 r/min,15 min),取上层离心液,分别测定它们的荧光强度。按同样的方法,向AuNPs/OLN/SiQDs复合物中加入其它真菌毒素(AF B2、AF G1、F B1、DON、OTB和ZEN),进行AF B1复合物传感体系的选择性试验,控制AF B1 的浓度为0.5 ng/mL,其它真菌毒素的浓度均为10 ng/mL。以上实验均以360 nm为激发波长,测定荧光发射光谱(最大发射波长为442 nm)。光谱测定都在室温下于10 mmol/L PBS(pH=7.5)中进行。所得数据均为三次测定平均值。
2 结果与讨论
2.1 方法原理
在本工作中,先将巯基修饰的OLN与AuNPs通过自组装,形成AuNPs/OLN,由于AuNPs和OLN都带负电荷,形成的AuNPs/OLN也带负电荷;表面带咪唑基团的SiQDs带正电荷,将该SiQDs加进AuNPs/OLN体系后,AuNPs/OLN与SiQDs通过静电自组装形成AuNPs/OLN/SiQDs复合物,复合物中SiQDs表面的正电荷被中和,AuNPs具有强烈猝灭QDs荧光特性[19]。因此,处于复合物中的SiQDs受AuNPs和外部电荷变化的共同作用,其荧光猝灭。向AuNPs/OLN/SiQDs复合物溶液体系中加入AF B1时,AF B1与复合物中的OLN发生特异性反应,生成AuNPs/OLN/AF B1并释放出SiQDs,释放出来的SiQDs的环境得以恢复,同时也摆脱了AuNPs的影响,其荧光得到恢复。SiQDs荧光光谱图和AuNPs/OLN/SiQDs复合物荧光猝灭与恢复的荧光光谱见图1。在AuNPs/OLN/SiQDs复合物溶液体系中加入不同浓度AF B1,测定其所对应的荧光强度,建立AF B1浓度与体系的荧光强度之间的关系,进而实现样品中AF B1的分析检测。

图1 (A)SiQDs荧光激发光谱(a)与发射光谱曲线(b);(B)SiQDs荧光光谱(a)、SiQDs在AuNPs/OLN/SiQDs复合物中荧光猝灭(b)和AF B1存在时荧光恢复(c)曲线Fig.1 (A)Fluorescence excitation(a) and emission(b) spectra of SiQDs;(B) Fluorescence spectrum of SiQDs(a),fluorescence quenched in AuNPs/OLN/SiQDs complex(b) and fluorescence recovered in the presence of AF B1 in the complex systems (c) of SiQDs
2.2 寡核苷酸用量的影响
研究了AuNPs/OLN复合物中OLN与AuNPs的摩尔比(OLN∶AuNPs在150~250范围)对SiQDs荧光猝灭和恢复的影响。实验显示,OLN为AuNPs的150至220倍时,SiQDs的荧光猝灭随OLN的比例增大而增强,220倍时达到最大,再增大OLN用量,荧光猝灭程度下降。向发生荧光猝灭了的体系中加入AF B1,体系的荧光恢复程度随OLN的增大,在150~200倍范围呈线性增强,且220倍时达到最大。产生这种现象可能是随着AuNPs的表面OLN增大,在AuNPs/OLN/SiQDs复合物中,SiQDs受到更多的OLN(负电荷)的影响,引起更强的表面电性变化,使体系荧光猝灭程度更为强烈。同时,随复合物中OLN量的增大,处于自由状态下的SiQDs与在复合物中的SiQDs的表面电荷变化也增大、因此向复合物体系中加入AF B1后,释放出的SiQDs的荧光恢复程度也增强。当达到220倍时,体系的荧光猝灭和恢复都达到最大。由于AuNPs表面有限,AuNPs表面上OLN的量越大,OLN彼此间的距离越小,这不仅会阻碍SiQDs与AuNPs/OLN的结合,还会阻碍SiQDs从AuNPs/OLN/SiQDs表面脱离进入溶液,使荧光的猝灭与恢复程度下降。故在后续实验中选择OLN的用量为AuNPs的220倍。
2.3 pH及盐浓度的影响
在pH=4.0~10.0范围,研究了pH对体系荧光恢复的影响,结果见图2。从图中可见,在pH=4.0~7.0时,体系荧光强度随pH升高而显线性增强,在pH=7.0~10.0范围,荧光强度稳定,改变pH,荧光强度不变。这种现象可能是SiQDs对H+敏感。在酸性条件下,SiQDs表面咪唑基接受质子发生电荷传递,同时诱导SiQDs发生团聚,引起荧光猝灭。综合考虑,在后续实验中,控制溶液为pH=7.5。
实验还考察了NaCl对体系荧光的影响。结果表明NaCl浓度在50 mmol/L以下时,对体系荧光无明显影响。
2.4 孵化时间的影响
在室温下,考察了孵化时间对荧光恢复的影响。结果如图3所示。从图3可见,孵化时间5 min,体系荧光迅速恢复;继续延迟孵化时间,体系荧光强度不再变化。说明AF B1迅速与复合物中OLN结合并释放出SiQDs。因此,可以实现样品中AF B1的快速测定。

图2 pH对体系荧光强度的影响Fig.2 Influence of pH on fluorescence intensity of the system
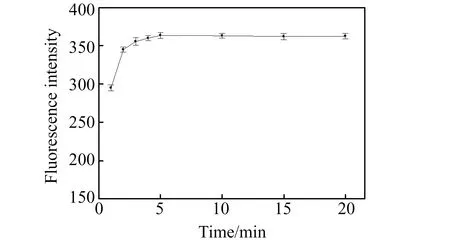
图3 孵化时间对体系荧光的影响Fig.3 Influence of incubation time on fluorescence intensity of the system
2.5 其它真菌毒素的影响
控制AF B1浓度为0.5 ng/mL,其它真菌毒素浓度为10.0 ng/mL,试验了(AF B2)、(AF G1)、DON、F B1、OTA和ZEN等真菌毒素的影响,结果见图4。结果显示,AuNPs/OLN/SiQDs复合物传感对AF B1呈现高特异性,其它真菌毒素的存在对AF B1测定无明显干扰。
2.6 工作曲线
在pH=7.5的PBS中,依次在AuNPs/OLN/SiQDs体系中加入AF B1标准溶液,用PBS稀释至2 mL,室温下孵化5 min,测定体系荧光强度,结果见图5。从图5可见,随着AF B1浓度增大,荧光强度迅速增强。将AuNPs/OLN/SiQDs分散体系溶液的荧光强度记为F0,将加进不同浓度的AF B1标准溶液的体系荧光强度记为F,则体系荧光恢复程度为F-F0,从图5的插图中可以观察到,体系的荧光恢复程度与AF B1浓度在0.01~1.0 ng/mL范围内呈现出良好的线性关系,其线性回归方程为:F-F0=7.689+147.227c(c:ng/mL),相关系数r为0.9971,方法检出限(3σ)为8 pg/mL。

图4 AuNPs/OLN/SiQDs复合物传感分析的选择性Fig.4 Selectivity of AuNPs/OLN/SiQDs sensor assayConcentration of AF B1:0.5 ng/mL,others:10.0 ng/mL.
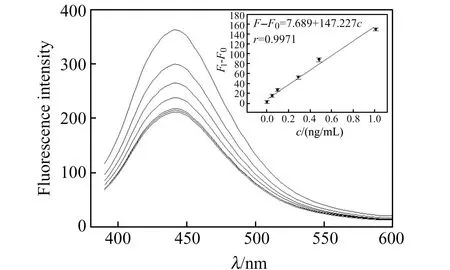
图5 体系荧光强度随AF B1浓度的变化情况Fig.5 The dependence of fluorescence intensity on the concentration of AF B1Inset shows the linear relationship between the F-F0 and AF B1 concentration within the range of 0.01-1.0 ng/mL.
2.7 分析应用
实验所用巧克力样品购自本地超市。称取25.0 g巧克力和5.0 g NaCl,置于高速均质机搅拌缸中,加入100.0 mL甲醇,1.25 mL二甲基甲酰胺,加盖,高速均质1 min。将均质的样品倒入折叠好的滤纸筒中过滤,收集滤液。取10.0 mL滤液,加10.0 mL水稀释,用11 cm玻璃纤维滤纸过滤至滤液澄清,即得巧克力试液,按发展方法测定。从表1中可知,该方法测定实际样品的回收率和相对标准差(RSD)分别为94%~106%和2.1%~3.5%。表明该传感体系适用于巧克力中痕量AF B1的检测。
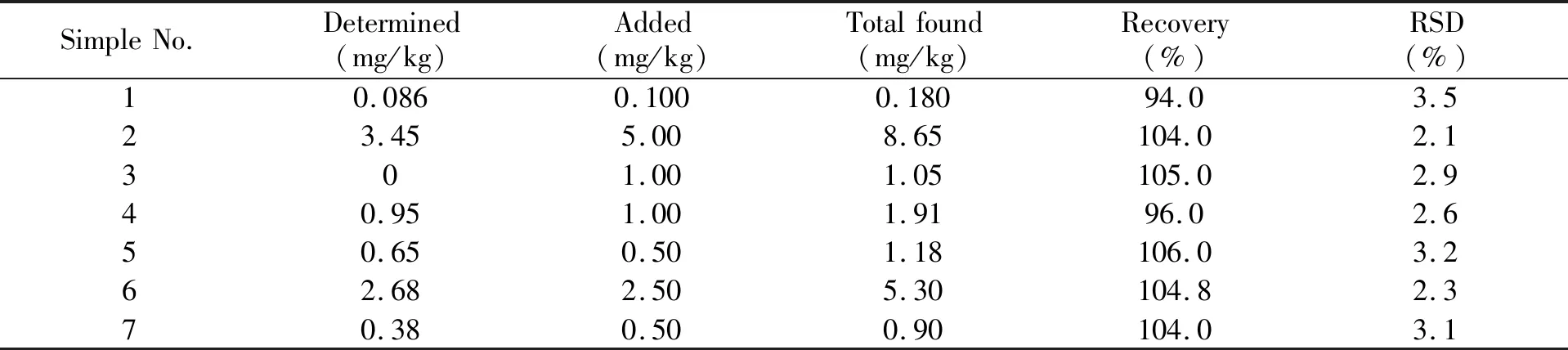
表1 巧克力中AF B1的检测(n=3)Table 1 Detection of AF B1 in chocolates(n=3)
3 结论
构建了新型纳米生物复合物传感器,该传感器对AF B1呈现出高灵敏和高选择性。同时,通过变换硅量子点纳米复合物中的核寡苷酸,可望检测不同的真菌毒素,拓展了硅量子点的应用范围,也为检测复杂食品体系中痕量真菌毒素提供了一种新的灵敏、准确、简易、快速的方法。
