基于胆汁酸稳态调控的维生素D对结直肠癌的抑制作用及机制研究
2020-03-20钟雅男陈春霞郝志翔徐吟雪印晓星周雪妍
钟雅男,陈春霞,赵 峰,郝志翔,徐吟雪,印晓星,周雪妍
(徐州医科大学药学院,江苏省新药研究与临床药学重点实验室,江苏 徐州 221004)
结直肠癌(colorectal cancer,CRC)是世界第三大恶性肿瘤,其全球发病率、转移率高且治愈率低[1]。预计至2030年,CRC的全球负担将增加60%[2]。CRC发病隐匿,早期症状多不明显,缺乏早期诊断的有效标准,因此需对CRC病因学深入研究并探讨影响其发生、发展的高危因素。
胆汁酸(bile acids,BAs)是胆汁的主要成分,由肝细胞内胆固醇转化而来。各类型胆汁酸可分为三类:单体胆汁酸:胆酸(cholic acid,CA),石胆酸(lithocholic acid,LCA),脱氧胆酸(deoxycholic acid,DCA),熊脱氧胆酸(ursodeoxycholic acid,UDCA),鹅脱氧胆酸(chenodeoxycholic acid,CDCA),猪脱氧胆酸(hyodeoxycholic acid,HDCA),α-鼠胆酸(α-muricholic acid,α-MCA),β-鼠胆酸(β-muricholic acid,β-MCA);胆汁酸的甘氨酸结合产物:甘胆酸(glycocholicacid,G-CA),甘氨石胆酸(glycinocholic acid,G-LCA),甘氨脱氧胆酸(glycodeoxycholic acid,G-DCA),甘氨鹅脱氧胆酸(glycochenodeoxycholic acid,G-CDCA),甘氨熊脱氧胆酸(glycoursodeoxycholic acid,G-UDCA);胆汁酸的牛磺酸结合产物:牛磺胆酸(taurocholic acid,T-CA),牛磺脱氧胆酸(taurodeoxycholic acid,T-DCA),牛磺熊脱氧胆酸(tauroursodeoxycholic acid,T-UDCA),牛磺石胆酸(taurocholic acid,T-LCA),牛磺鹅脱氧胆酸(tauro-chenodeoxycholic acid,T-CDCA),牛磺猪脱氧胆酸(tauro-hyodeoxycholic acid,T-HDCA),牛磺β-鼠胆酸(tauro-β-muricholic acid,T-β-MCA)。各类型胆汁酸总和为总胆酸(total bile acid,TBA)。肠炎状态下BAs选择性的在结肠组织中蓄积[3]。其中以疏水性胆汁酸包括CDCA、LCA和DCA最为明显。LCA刺激结肠黏膜上皮细胞增殖导致CRC的发生发展[4]。而DCA进一步破坏肠道黏膜屏障促进肠道肿瘤的发生[5]。因此,疏水性胆汁酸在结肠组织中的蓄积是CRC发生发展的重要环节。
胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)是影响BAs生成的限速酶。法呢醇受体(farnesoid X receptor,FXR)广泛分布于与BAs代谢密切相关的器官[6]。FXR参与BAs的负反馈调节,调控体内BAs的合成,从而维持BAs的稳态[7]。因此,FXR和CYP7A1的异常表达介导的BAs稳态变化进一步促进CRC的发生发展。
维生素D(vitamin D,VD)是多功能的类固醇激素,活化的VD通过结合激活VD受体在体内起到调节钙磷和脂质代谢、发挥抗癌活性等多种生理作用[8]。VD的活性代谢产物25羟维生素D3(25-hydroxyvitamin D3,25(OH)D3)浓度与CRC之间存在强烈的反向相关性。25(OH)D3水平的最低四分位数比最高四分位数的癌症死亡风险显著升高。具有较高25(OH)D3水平的患者癌症特异性和总死亡率明显降低[9]。因此,VD的缺乏是CRC的危险因素,VD的补充可以抑制CRC的发生发展,但相关的机制仍不明确。
VD在BAs代谢中发挥重要作用,可通过抑制限速酶CYP7A1的表达来抑制BAs合成[10],而BAs的稳态与CRC的发生发展密切相关。由此,我们推测,VD是否可能作用于BAs稳态进而调控CRC的发生发展。本实验的研究对象为C57BL/6 ♂小鼠,利用腹腔注射氧化偶氮甲烷(azoxymethane,AOM)并给予硫酸葡聚糖钠盐(Dextran Sulfate Sodium Salt, DSS)诱导建立小鼠CRC模型,通过饲料喂养VD进行治疗,考察VD对BAs内稳态的调控与CRC发生发展的联系,为CRC临床药物治疗方案提供依据。
1 材料与方法
1.1 实验动物SPF级C57BL/6小鼠,♂,体质量15 g(4~5周龄),购自上海西普尔-必凯实验动物有限公司,饲养于徐州医科大学新药与临床药学重点实验室,许可证号:SCXK(沪)2013-0016,环境温度(25±2)℃,湿度(55±5)%。实验期间,各组小鼠均可自由饮水。
1.2 试剂氧化偶氮甲烷(货号A5486)、去氢胆酸(货号30830)购自Sigma公司;HE染色试剂盒(货号C0105),购自碧云天生物技术有限公司;硫酸葡聚糖钠盐(货号0216011010),购自美国MP公司;TRNAiso Plus(货号9108)、PrimeScript RT reagent Kit(货号RR037A)、SYBR Premix Ex TaqTMⅡ(货号RR820A),购自宝生物工程(大连)有限公司;AIN-93G标准纯化饲料(货号D10012G),购自福贝世亨生物医药(上海)有限公司。
1.3 仪器Agilent 6420A三重四级杆质谱仪、Agilent 1260高效液相色谱仪、MassHunter Qualitative定性分析软件、MassHunter Quantitative定量分析软件和MassHunter Acquisition数据采集软件(美国Agilent公司);NanoDrop 1 000核酸浓度测定仪(美国Thermo Scientific公司);Light Cycle 480实时荧光定量PCR仪(瑞士Roche公司);Tecnai G2透射电子显微镜(美国FEI公司)。
1.4 CRC小鼠模型的建立♂C57BL/6小鼠,适应1周后,将小鼠随机分为3组,每组6只:正常对照组(Control组)、结直肠癌组(CRC组)、结直肠癌+VD补充组(CRC+VD组)。其中,CRC组和CRC+VD组于第1天腹膜内注射AOM(10 mg·kg-1)。第8天起,给予小鼠2.5% DSS水溶液1周作为饮用水,第15天起使小鼠正常饮水2周。第29天起重复第8天到第28天的循环两次,第70天,造模结束。CRC+VD组在AOM+DSS诱导的CRC模型基础上,给予含VD33 000 IU·kg-1的AIN-93G标准纯化饲料自由饮食。通过眼眶采血收集血液,颈脱位法处死各组小鼠并收集肝脏组织,同时完整地取出结直肠,使用直尺测量结直肠长度,随后收集结肠组织,样本均保存于-80 ℃冰箱中。
1.5 HE染色取结肠组织经4%多聚甲醛固定后,按步骤经包埋,切片,再依次脱蜡,染色,脱水,封片,最后晾干。显微镜观察结肠组织的形态结构并拍照记录。
1.6 qPCR检测TRIzol提取肝脏组织总RNA,并根据PrimeScript RT说明书步骤逆转录成cDNA。利用Roche LightCycle 480软件计算样本中各目的基因的Ct值进行定量PCR分析。以GADPH的mRNA水平作为参比对照,采用ΔΔCt法得到各目的基因mRNA的相对表达水平,反应引物由上海生工生物工程股份有限公司设计合成。序列见Tab 1。

Tab 1 Primers and amplification length of qPCR reaction
1.7 胆汁酸及其代谢产物的含量测定
1.7.1小鼠血清的胆汁酸提取 精密量取50 mL血清,加入150 μL冰乙腈溶液(I.S.100 ng·mL-1)混匀。4 ℃、13 000 r·min-1离心10 min,吸取大于170 μL上清液。40 ℃旋转干燥后,浓缩物复溶于100 μL质量分数为50%甲醇溶液(含质量分数为0.1%甲酸),并在4 ℃、13 000 r·min-1离心10 min。取上清置于进样瓶中,最终以20 μL进样。采用已建立并完成验证的20种胆汁酸活性物质组分(CDCA、CA、DCA、LCA、G-CA、G-CDCA、T-CDCA、T-DCA、UDCA、HDCA、G-LCA、G-UDCA、G-DCA、T-UDCA、T-HDCA、T-LCA、α-MCA、β-MCA、T-CA和T-β-MCA)的LC-MS/MS定量分析方法[3]。
1.7.2小鼠结肠的胆汁酸提取 精密称取300 mg结肠组织,用1.2 mL质量分数为70%的乙醇匀浆后,55 ℃超声提取30 min。4 ℃、13 000 r·min-1离心10 min,取上清。吸取100 μL提取物,加入500 μL冰乙腈溶液混匀。其余步骤同小鼠血清胆汁酸测定。
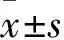
2 结果
2.1 VD对结直肠癌发生发展的调控作用与Control组相比,CRC组小鼠体质量于5~13周体质量低于Control组(P<0.01);而CRC+VD组体质量与CRC组相比相对较高,但至造模结束,三组小鼠体质量并无明显差异,见Fig 1A。结直肠长度结果显示,CRC组小鼠结直肠长度明显较Control组短(P<0.01);而与CRC组相比,CRC+VD组结直肠长度已变长(P<0.01),见Fig 1B。Fig 1C染色结果显示,Control组结肠组织基底膜完整,腺体排列规则,结构良好;CRC组结肠组织炎性细胞浸润,癌组织呈浸润性生长,细胞排列紊乱,失去正常的结构和层次;CRC+VD组结肠各层结构相对清晰,细胞仅呈现轻度水肿状态,炎症情况有所缓解。
2.2 VD对胆汁酸内稳态的调控作用Fig 2结果显示,血清中20种BAs活性物质的含量分布情况。与Control组比较,CRC组小鼠血清样本的总胆汁酸水平降低(P<0.01),见Fig 2D;同时Fig 2A,Fig 2B显示,CRC组G-UDCA,DCA,HDCA,T-HDCA,UDCA,T-LCA,T-CA,LCA,T-CDCA,CDCA和T-DCA的含量显著降低(P<0.05),而α-MCA、β-MCA的含量明显增加(P<0.05),表明CRC造模小鼠体内BAs稳态出现紊乱。与CRC组相比,CRC+VD组小鼠血清样本中T-LCA,LCA,T-CA,T-DCA,T-HDCA水平升高(P<0.05),α-MCA、β-MCA的含量显著降低(P<0.05),见Fig 2B,Fig 2C,提示给予CRC造模小鼠VD后,小鼠血清BAs水平逐渐好转。
检测各组小鼠结肠组织中BAs活性物质的含量,与Control组比较,CRC组小鼠结肠组织样本的总胆汁酸水平升高,见Fig 3D,其中,T-β-MCA、G-DCA、G-LCA、DCA和α-MCA的含量显著升高(P<0.05),而T-HDCA、HDCA的含量明显降低(P<0.05),见Fig 3A,Fig 3B,同时在小鼠血清样本中大部分BAs含量降低,而结肠部位却出现BAs的蓄积,提示在肠炎肠癌状态下,BAs稳态失衡且蓄积在结肠部位。而与CRC组相比,CRC+VD组小鼠结肠组织中总胆汁酸水平明显降低(P<0.05),见Fig 3D,其中G-DCA、CDCA、G-LCA、LCA、α-MCA、T-DCA、DCA、UDCA和HDCA含量均降低(P<0.05),见Fig 3B,Fig 3C,结果表明给予CRC造模组小鼠VD后,小鼠结肠部位BAs浓度逐渐恢复并趋近于正常水平。

Fig 1 Inhibition of vitamin D on colorectal cancer model
A:Body weight curves of mice; B:The colorectal length of mice; C:The appearance and structure of colon tissue by HE staining.**P<0.01vscontrol group;##P<0.01vsCRC group.

Fig 2 Effects of vitamin D on bile acids in mouse
A:The concentrations of BAs in serum of control group; B:The concentrations of BAs in serum of CRC group; C:The concentrations of BAs in serum of CRC+VD group. D:The concentrations of total BAs in serum. (1:T-β-MCA;2:G-CA;3:CA;4:G-DCA;5:T-CDCA;6:CDCA;7:G-LCA;8:T-LCA;9:LCA;10:α-MCA;11:G-UDCA;12:T-CA;13:T-DCA;14:DCA;15:β-MCA;16:T-UDCA;17:UDCA;18:G-CDCA;19:T-HDCA;20:HDCA).*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsCRC group.
通过绘制的BAs含量图谱发现,结肠部分蓄积的BAs生理活性与毒性均取决于其分子结构的极性。因此,实验中将疏水性胆汁酸浓度除以胆汁酸总浓度,以此比值作为胆汁酸疏水性大小的指标,Fig 4结果所示,在血清与结肠组织样本中胆汁酸的疏水性整体趋势与总体胆汁酸水平的趋势保持一致。与Control组相比,CRC组小鼠结肠组织中疏水性胆汁酸比例增大(P<0.05);而VD的补充明显降低了疏水性胆汁酸的比例(P<0.01)。提示VD的补充能够减少疏水性胆汁酸在结肠部位的比例失衡及蓄积。
肝脏qPCR方法检测FXR、CYP7A1的mRNA表达水平(Fig 5),CRC组中FXR、CYP7A1的mRNA表达与Control组相比明显升高(P<0.01),与CRC组小鼠体内BAs水平升高趋势一致。当给予VD治疗后,FXR和CYP7A1表达降低,其中CYP7A1表达量明显降低(P<0.01),结果证明了VD可以改善CRC小鼠体内BAs失衡的状态。
3 讨论
CRC是世界四大癌症死亡原因之一,据预测到2030年,可达220万个新发病例和110万例死亡人数[2]。CRC被认为是由环境、饮食、慢性炎症、胃肠道代谢紊乱等因素综合作用所导致的癌症,因其发病隐匿,病因复杂,目前仍没有有效的治疗药物。因此,对CRC病因学进行深入研究,探讨影响其发生发展的高危因素,对CRC临床干预策略的优化以及疾病诊断治疗的管控均具有重要的意义。本实验采用LC-MS/MS定量分析方法,测定CRC小鼠血清和结肠组织中BAs的含量变化情况,考察VD对BAs的调控作用,为临床诊断治疗提供参考价值。

Fig 3 Effects of vitamin D on bile acids in mouse
A:The concentrations of BAs in colon of control group; B:The concentrations of BAs in colon of CRC group; C:The concentrations of BAs in colon of CRC+VD group; D. The concentrations of total BAs in colon. (1:T-β-MCA;2:G-CA;3:CA;4:G-DCA;5:T-CDCA;6:CDCA;7:G-LCA;8:T-LCA;9:LCA;10:α-MCA;11:G-UDCA;12:T-CA;13:T-DCA;14:DCA;15:β-MCA;16:T-UDCA;17:UDCA;18:G-CDCA;19:T-HDCA;20:HDCA).*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsCRC group.

Fig 4 Proportion of hydrophobic bile acids in
A:The concentrations of hydrophobic bile acids in serum; B:The concentrations of hydrophobic bile acids in colon;*P<0.05,**P<0.01vscontrol group;##P<0.01vsCRC group.
研究表明,VD与CRC的高发密切相关,缺乏VD、高脂肪或低纤维素等饮食因素在CRC的发生发展中起着至关重要的作用,增加了CRC的发病率,Meta分析显示,与具有低25(OH)D3水平的患者相比,具有高25(OH)D3水平的患者的结肠直肠癌风险降低30%~40%[11]。动物模型研究明确地表明VD的摄入能够延缓化学诱导的低等级肿瘤前病变的形成,甚至阻止结肠高度发育不良的发展[12]。

Fig 5 Relative level of mRNA expression

**P<0.01vscontrol group;##P<0.01vsCRC group.
在本实验中,除Control组外,利用AOM+DSS诱导的CRC模型,并分为CRC组和CRC+VD组。造模结束后对小鼠体重、结直肠长度的统计计算,并观察小鼠结肠组织HE染色情况。CRC组的小鼠造模过程中体重下降,结直肠长度减少,HE染色提示结肠无腺体结构,包膜缺失且细胞增殖情况紊乱,而CRC+VD组则表现出一定的逆转肠炎肠癌进展的表现,即结直肠长度呈现增加趋势,镜下观察结肠腺体结构趋向正常。因此,可以初步得出结论,VD缺乏与CRC的高发密切相关,VD补充能够抑制CRC的发生、发展。
BAs的稳态失衡是CRC发生发展重要诱导因素。动物研究发现在肠炎状态下BAs选择性的在结肠组织中蓄积是炎症转化为癌症的重要环节[3]。本实验结果表明,CRC小鼠的BAs内稳态显著失衡,且在结肠处存在明显的BAs蓄积,因此在肠炎肠癌状态下BAs在结肠组织中蓄积是CRC发生发展的重要环节。VD已被证明在BAs代谢和CRC发展中都发挥重要作用。有文献明确报道了活性VD治疗可以刺激BAs代谢[13]。关于膳食VD的研究结果也进一步证明VD通过抑制限速酶CYP7A1的表达来抑制BAs合成[10]。FXR是一种核激素受体,可作为细胞内BAs水平的主要传感器。从疏水性到亲水性胆汁酸的等级顺序对应于它们对FXR的亲和力如下:LCA> DCA> CDCA> CA> UDCA> MCA[14]。在本实验中,CRC组小鼠肝脏qPCR结果提示CRC小鼠FXR和CYP7A1的mRNA表达水平明显升高,而当给予小鼠VD补充后,小鼠BAs水平明显改善,肝脏mRNA水平逐渐趋于正常。因此,VD的补充可以减少BAs在结直肠的蓄积,从而抑制CRC的发生发展。
疏水性胆汁酸具有细胞毒性,长期的超生理浓度的疏水性胆汁酸暴露可以通过DNA氧化损伤、激活NF-κB、增加细胞增殖以及诱导凋亡抵抗而促进癌症发生[15]。因此,长期暴露在较高的疏水性胆汁酸水平环境中是细胞癌变和CRC发生的重要环节。本实验对小鼠结肠部位胆汁酸的测定中发现CRC组CDCA、LCA和DCA这些疏水性胆汁酸的含量显著升高,而VD的补充能够降低结肠组织中CDCA、DCA以及LCA的水平。结果表明,VD的补充能够减少CRC状态下疏水性胆汁酸的比例,降低疏水性胆汁酸对结直肠的毒性,进一步抑制CRC的发生发展。
综上所述,CRC状态下小鼠体内BAs稳态失衡,而VD可能通过调节体内疏水性胆汁酸的比例从而改善胆汁酸水平,调控了CRC的发生发展。
