蛇床子素通过抑制髓核致炎大鼠脊髓背角CXCL1/CXCR2的表达发挥抗炎镇痛作用
2020-03-20高凤娇张嘉明贺秋兰邹学农孙来保
高凤娇,杨 琳,张嘉明,魏 明,贺秋兰,邹学农,孙来保
(1. 中山大学附属第一医院麻醉科,广东 广州 510080;2. 广州市番禺中心医院麻醉科,广东 广州 511400;3. 中山大学附属第六医院麻醉科,广东 广州 510655;4. 中山大学附属第一医院脊柱外科,广东 广州 510080;5. 广东省骨科学重点实验室,广东 广州 510080)
目前,腰椎间盘突出症是导致慢性腰腿痛最常见的原因之一。据资料表明,约2%~3%的人口长期存在慢性腰腿痛现象,且腰腿痛是导致全球各地区劳动力丧失的首要原因[1]。临床上一部分腰椎间盘突出症的患者,腰椎MR检查结果显示椎间盘无或仅仅少量突出,影像学上无明显的神经压迫征象,但患者的腰腿痛症状却非常明显,那么我们考虑这部分腰椎间盘突出症患者的腰腿疼痛主要是由于腰椎间盘突出的髓核组织引发的神经根炎症,有效控制炎症反应可以显著降低神经根性痛的发病率和疼痛程度[2]。但对于这部分患者目前具体的神经根疼痛机制不完全清楚且有效控制炎症的方法尚不完善。
CXCL1是中性粒细胞趋化因子,通过激活相应受体CXCR2并与之结合后产生促炎效应。近年来研究[3-5]表明,CXCL1/CXCR2在骨癌痛、化疗药物致疼痛及坐骨神经损伤致慢性疼痛的发生发展中均起到重要作用,但在腰椎间盘突出致慢性腰腿痛的发生过程中研究较少且机制不清楚。蛇床子素(osthole,Ost)是一种从中药蛇床子中提取的单体,研究表明其有良好的抗炎镇痛作用,课题组前期研究也表明Ost能有效缓解髓核致炎大鼠的神经根炎性疼痛[6,7],但目前Ost对大鼠髓核源性神经根痛的抗炎镇痛作用机制尚不完全明确。故本实验拟采用自体髓核致神经根痛大鼠模型,探索CXCL1/CXCR2在大鼠神经根痛的发生发展中的作用机制,同时阐明Ost治疗髓核源性神经根痛的机制,及为临床上非手术治疗的腰椎间盘突出症患者开发更有效的抗炎镇痛药物提供实验理论基础。
1 材料与方法
1.1 实验动物SPF级SD大鼠,♂,124只,体质量(200~250)g,许可证号:SCXK(粤)2016-0029。大鼠饲养室温度(23±2)℃、湿度(55±5)% 、噪音<85 dB,提供12 h/12 h白天和黑夜循环照明,本实验所有动物操作均严格按照中山大学动物保护和使用规定。
1.2 试剂及仪器Ost(批号:S2337,Selleckchem,美国);10%二甲亚砜(dimethylsulfoxide,DMSO,Sigma,美国);兔抗大鼠CXCL1一抗(AF5403,Affinity);兔抗大鼠CXCR2一抗(ab14935,abcam,美国);兔抗大鼠GAPDH一抗(AF7021,Affinity);山羊抗兔二抗(ab6721,abcam,美国);CXCL1中和抗体(AF-515,R&D Systems);逆转录试剂盒(RR036A,TaKaRa公司);PCR扩增试剂盒(RR820A,TaKaRa公司);聚乙烯管PE导管(OD:0.5 mm,ID:0.25 mm,宁波安来软件科技有限公司);Von Frey纤毛仪( Stoelting公司,美国);医用显微手术电钻(XSZ-G-1型,上海光电技术有限公司)。
1.3 动物模型建立、分组及处理
1.3.1动物模型建立 ① 髓核致炎组:用2%戊巴比妥麻醉大鼠(40~50 mg·kg-1,ip.)后,将其俯卧位固定于操作台上。大鼠备皮后消毒铺巾,于两髂嵴最高点连线中点做纵向3 cm左右切口,分离背部肌肉后,用医用显微手术电钻在左L5半椎板上钻孔,轻柔地将大鼠左侧L5背根神经节(dorsal root ganglion,DRG)暴露,注意勿损伤神经,再从尾骨椎体上摘取约0.4 mg的髓核通过L5椎板孔放置于左L5背根神经根上(Fig 1),从L5椎板钻孔处将PE-10导管向头侧硬膜外腔轻柔置入约4 mm,并将其固定于同侧肌肉组织,另一端经皮下隧道从颈后引出,回抽无血和脑脊液流出,止血充分后逐层缝合伤口。②假手术组:取出大鼠尾部自体髓核,但不将其置于L5被根神经节上,其余手术操作同髓核致炎组。③空白组:不作任何手术处理。
1.3.2分组及处理 第一部分:将60只♂ SPF级大鼠随机分为3组: 髓核致炎组(NP,n=36)、假手术组(Sham,n=12)、空白组(Blank,n=12)。用up-dwon方法检测大鼠术前1 d,术后3、7、14、21、28 d的50%机械缩足阈值(50% mechanical withdrawal threshold,50% MWT)。Sham组于术后7 d,NP组于术后3、7、14、21、28 d每个时间点均取6只大鼠的L5节段脊髓背角。用q-PCR方法检测脊髓背角CXCL1 mRNA、CXCR2 mRNA和TNF-α mRNA的相对含量;用Western blot方法检测脊髓背角CXCL1和CXCR2蛋白相对浓度。第二部分:将64只♂ SPF级髓核致炎后大鼠随机均分为4组(n=16): NP+NS组,于术后d 3经硬膜外腔给予生理盐水50 μL;NP+DMSO组,于术后d 3经硬膜外腔给予10% DMSO 50 μL;NP+Ost组,于术后d 3经硬膜外腔给予82 mmol·L-1的Ost 50 μL,即每只大鼠1 mg Ost,溶于10% DMSO;NP+AF-515组,于术后d 3给予AF-515 8 μg,溶于10% DMSO。所有大鼠术前、术后、给药后各时间点均进行疼痛行为学指标50% MWT的测定,于术后7 d取材,通过Western blot方法检测脊髓背角CXCL1和CXCR2的相对蛋白浓度。

Fig 1 The schematic diagram of nucleus pulposus (NP)-evoked pain model of rat
A: Represents the lumbar vertebral processing schematic map; B:Represents the drilling treatment of the L5 lamina in rats,and exposing the L5 dorsal root ganglion— “↑”; C: Represents the removal of about 0.4 mg of nucleus pulposus from the caudal vertebra of rats.
1.4 行为学测试用改良后up-down方法检测大鼠50%MWT。疼痛行为学测试时间于9 ∶00~16 ∶00进行,测试前所有大鼠均在试验箱中适应30 min,安静后以不同折力von Frey纤毛刺激大鼠左足足底,避开肉垫使之稍成S形,持续6 s~8 s。大鼠后肢迅速畏缩、撤回,认为是阳性反应。从1.4 g开始,每个强度反复刺激5次,将出现3次以上阳性反应的最小von Frey纤维强度定为大鼠的50%MWT,两次刺激之间至少间隔约15 s。按以上的流程重复测量3次,取均值。
1.5 q-PCR检测脊髓背角CXCL1 mRNA、CXCR2 mRNA及TNF-α mRNA的表达水平2%戊巴比妥(60~80 mg·kg-1,ip)深麻醉大鼠后在冰面上迅速取出L5节段脊髓背角组织,将组织研磨成粉末状后放进匀浆器中,按TRIzol抽提法提取脊髓背角总RNA,再检测RNA浓度和纯度。取适量RNA为模板在逆转录试剂盒(RR036A,TaKaRa公司)及相应条件下得到cDNA。采用Primer5.0设计基因特异性引物,CXCL1引物序列:5′-GCAGACAGTGGCAGGGATTC-3′(上游),5′-CGACCATTCTTGAGTGTGGCTAT-3′(下游);CXCR2引物序列:5′-GTTCTTTGCCCTGACCTTGCC-3′(上游),5′-TGTACTTGTGGCGTGGACGAT-3′(下游);TNF-α引物序列:5′-GCCACCACGCTCTTCTGTCTA-3′(上游),5′-CGCTTGGTGGTTTGCTACGA-3′(下游); GAPDH引物序列:5′-CTGGAGAAACCTGCCAAGTATG-3′(上游),5′-GGTGGAAGAATGGGAGTTGCT-3′(下游)。根据PCR扩增试剂盒(RR820A,TaKaRa公司)反应体系的相应条件进行预变性、变性、退火、延伸,计算每个样本的循环阈值(Ct值),运用Bio-Rad CFX96荧光定量PCR仪配套的Bio-Rad CFX Manager Software1.6 数据分析软件进行分析,采用2-ΔΔCt法来计算CXCL1 mRNA、CXCR2 mRNA和TNF-α mRNA的相对浓度。
1.6 Western blot检测脊髓背角CXCL1、CXCR2的蛋白表达水平所有大鼠在相应时间点于冰上快速取出L5节段脊髓背角组织,将组织用显微剪剪成小碎片,加入含有蛋白酶抑制剂(78439,Thermo Fisher)的组织裂解液(78510,Thermo Fisher),然后依次进行超声组织匀浆、水浴、及离心后取上清。根据目标蛋白分子量的大小选用10%或12%的SDS-PAGE凝胶进行电泳,Bio-Rad半干转仪将蛋白转至PVDF膜后用5%脱脂牛奶室温封闭2 h,分别与CXCL1一抗(1 ∶1 000),CXCR2一抗(1 ∶1 000),GAPDH一抗(1 ∶1 000)置于4 ℃冰箱孵育过夜,然后与山羊抗兔二抗(1 ∶500)室温下孵育2 h。将PVDF膜与ECL试剂反应后即刻显影,用Image J 6.0软件分析PVDF膜条带的灰度值。实验重复3次,将各样品中CXCL1和CXCR2灰度值分别与相应内参GAPDH灰度值相除作为相应蛋白的相对含量。
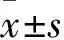
2 结果
2.1 模型建立前后大鼠机械痛阈值的变化各组大鼠术前的50% MWT差异无统计学意义(P>0.05),Sham组50% MWT在术后d 3降低(P<0.05),然后逐渐恢复至术前水平(P>0.05);NP组术后各时间点50% MWT较术前明显降低(P<0.05);与Sham组相比,NP组术后各观测时间点50% MWT明显降低(P<0.05)。见Fig 2。

Fig 2 Variation of 50%MWT before and after surgery )
*P<0.05vspreoperative 50% MWT of NP group ;#P<0.05vssham group;△P<0.05vspreoperative 50% MWT of sham group
2.2 建模后不同时间点CXCL1 mRNA、CXCR2 mRNA 和TNF-α mRNA的表达情况与Sham组比较,NP组术后3、7、14、21、28 d各时间点NP组大鼠的脊髓背角CXCL1 mRNA,CXCR2 mRNA和TNF-α mRNA的表达量均明显增加(P<0.05)。NP组TNF-α mRNA在术后d 3明显升高(P<0.05)持续至术后14 d(P<0.05),之后稍有下降至术后28 d(P<0.05);NP组CXCL1 mRNA和CXCR2 mRNA在术后3 d开始升高(P<0.05),于术后14 d达高峰(P<0.05)。见Fig 3。

Fig 3 Expression of CXCL1 mRNA,CXCR2 mRNA and TNF-α mRNA in different groups of rats at different time
*P<0.05,#P<0.05,△P<0.05vssham group
2.3 建模后不同时间点CXCL1和CXCR2蛋白的相对表达情况与Sham组比较,NP组术后3、7、14、21、28 d各时间点大鼠脊髓背角CXCL1和CXCR2的蛋白相对表达量均明显增加(P<0.01)。见Fig 4。
2.4 硬膜外腔给予髓核致炎大鼠不同药物对机械痛的影响术前各组大鼠的50%MWT差异无统计学意义(P>0.05),各组大鼠在术后d 3均出现50%MWT显著下降,与术前比较差异有统计学意义(P<0.01)。各组髓核致炎大鼠术后d 3经硬膜外管给予等体积的不同药物。NP+NS组大鼠的50%MWT在硬膜外注射生理盐水(NS)前后无明显变化(P>0.05);NP+DMSO组大鼠的50%MWT在硬膜外注射DMSO前后无明显变化(P>0.05);NP+AF-515组大鼠的50%MWT较给药前有所提高(P<0.05),维持至给药后12 h(P<0.05);NP+Ost组大鼠的50%MWT较给药前明显提高(P<0.01),治疗效果持续至术后d 14(P<0.01)。给药后各时间点,NP+NS组和NP+DMSO组的50%MWT差异无统计学意义(P>0.05)。NP+Ost组和NP+AF-515组的50%MWT较NP+DMSO组均明显提高(P<0.05),其中给药后NP+AF-515组的50%MWT比NP+Ost组低(P<0.05)。见 Fig 5。

Fig 4 Expression of CXCL1/CXCR2 protein in different groups of rats at different time points after
A,B: Western blot results showed an increase of CXCL1 in the spinal cord after surgery on days 3,7,14,21 and 28. C,D: Western blot results showed an increase of CXCR2 in the spinal horn cord after surgery on days 3,7,14,21 and 28.**P<0.01vssham group.
2.5 髓核致炎大鼠硬膜外腔给予不同药物后CXCL1/CXCR2蛋白的表达情况与NP+NS组(0.92±0.11)和NP+DMSO组(0.99±0.10)比较,NP+Ost组(0.49±0.07)大鼠脊髓背角中CXCL1蛋白表达水平明显降低(P<0.01)。NP+NS组和NP+DMSO组大鼠脊髓背角中CXCL1蛋白表达差异无统计学意义(P>0.05)。与NP+NS组(1.02±0.05)和NP+DMSO组(1.00±0.11)比较,NP+Ost组(0.45±0.06)大鼠脊髓背角中CXCR2蛋白表达水平明显降低(P<0.01)。NP+NS组和NP+DMSO组大鼠术后d 7脊髓背角中CXCR2蛋白表达差异无统计学意义(P>0.05)。见 Fig 6。

Fig 5 Effect of epidural application of different solutions on 50%MWT of rats with nucleus pulposus-induced hyperalgesia
“↑”: administration of different drugs.**P<0.01,*P<0.05vsNP+DMSO group.
3 讨论
腰椎间盘突出髓核组织的致炎特性是非压迫性腰椎间盘突出所致根性神经痛的重要机制之一[8]。自体髓核作为椎间盘中的“隔离抗原”,一旦椎间盘的突出后暴露被免疫系统识别,即可激发机体产生自身免疫反应,诱发炎症,促使中性粒细胞、单核巨噬细胞等炎性细胞募集、增殖,释放各种溶酶、炎症细胞因子,引起神经根肿胀、空泡变性。课题组前期的动物模型研究证实,突出的髓核组织接触神经根后大鼠产生明显的痛觉过敏[9,10]。同时,腰椎间盘突出的髓核引发的非菌性炎症与患者的腰腿痛临床表现也有密切联系[8]。研究表明,自体的髓核组织能够引起硬脊膜和/或神经根的化学性炎症,突出的椎间盘组织含有生化和/或免疫刺激物,可引起机体炎症反应及免疫应激反应[11]。有效控制炎症能够明显降低神经根性痛的发病率和炎症反应的程度,这已成为国内外椎间盘突出症致腰腿痛研究的重要方向[12]。
趋化因子是一种小的趋化细胞因子,可以控制白细胞和外周免疫和/或胶质细胞的迁移行为,同时趋化因子参与病理性疼痛的发生与发展,如炎症和神经性疼痛。胶质细胞和神经细胞可以激活趋化因子来影响外周致敏和神经可塑性,从而调节疼痛过程。CXCL1是C-X-C趋化因子家族成员,其氨基末端含有Glu-Leu-Arg序列,是一个中性粒细胞的化学引诱物[13]。CXCL1主要由巨噬细胞和中性粒细胞产生,在中枢神经系统,CXCL1主要表达于星形胶质细胞。趋化因子CXCL1是CXCR2受体的有效激动剂[14],后者属于G蛋白偶联受体-即7次跨膜受体,在中枢神经系统主要表达于神经元细胞。CXCL1蛋白的表达主要受NF-κB的调控,NF-κB是参与炎症过程相关基因表达的重要转录因子[3]。在长春新碱致神经病理性疼痛的研究[4]中,通过靶向抑制CXCL1/CXCR2通路,可以明显缓解小鼠的痛觉过敏。另外,CXCL1-CXCR2通路的活化介导小鼠骨癌痛的发生发展[3,15]。坐骨神经损伤的研究中,星形胶质细胞中CXCL1的激活在痛觉过敏的发生发展过程中也起到重要作用[5]。本实验采用大鼠自体髓核致炎模型,髓核致炎组机械痛阈值在术后d 3开始降低,到d 7降至最低,可持续至术后d 28,且术后炎症因子TNF-α mRNA的表达明显升高,表明模型建立成功。通过取L5节段脊髓背角做q-PCR检测发现,髓核致炎组大鼠脊髓背角CXCL1 mRNA、CXCR2 mRNA和TNF-α mRNA的表达较Sham组均明显增加,Western blot实验检测到脊髓背角CXCL1和CXCR2的蛋白相对表达量也增加,说明髓核致炎模型大鼠的脊髓背角中存在CXCL1/CXCR2的活化增加。

Fig 6 Expression of CXCL1/CXCR2 in different groups of rats atdifferent time points after intrathecal injection of different solutions
**P<0.01vsNP+DMSO group.
为了进一步验证CXCL1/CXCR2是否参与髓核致炎大鼠神经根痛的发生发展,在模型建立后d 3经硬膜外导管给予CXCL1的中和抗体(AF-515),可观察到大鼠的机械痛阈值升高,但持续时间仅12 h左右,其中在给药后7 h出现较明显的痛阈值增高。CXCL1中和抗体经硬膜外腔单次给药可中和大鼠脊髓局部CXCL1,使得CXCL1激活相应受体CXCR2的量减少,同时与CXCR2的结合也减少,以发挥对CXCL1-CXCR2通路的阻断效应,这可能是本实验中AF-515改善大鼠机械性痛敏发挥抗炎效果的主要原因。因而,我们认为CXCL1-CXCR2可能参与了髓核致炎大鼠髓核源性神经根痛的发生发展。Ost是一种中药单体,化学结构为7-甲氧基-8-异戊烯基香豆素,具有抗炎镇痛的作用。在本实验中,术后d 3经硬膜外导管给予Ost 1 mg,可明显改善大鼠自体髓核诱发的机械性痛敏,且作用效果可以维持至术后d 14(给药后d 11);在术后d 7(给药后d 3),NP+Ost组大鼠脊髓背角CXCL1和CXCR2蛋白均发生下调。因而,Ost能有效缓解髓核致炎大鼠的痛觉过敏,并伴有L5脊髓背角CXCL1/CXCR2蛋白表达明显减少。本实验的研究结果表明,抑制髓核致炎大鼠脊髓背角CXCL1/CXCR2的表达很可能是蛇床子素发挥抗炎镇痛作用的重要机制之一。
NF-κB作为CXCL1蛋白生成的主要转录因子,调控CXCL1的生成与活化。本研究中仅探索了Ost对CXCL1-CXCR2通路的抑制作用,而Ost是否通过影响上游的转录因子NF-κB的活化来调控大鼠的痛觉过敏未进行深入研究。由于CXCl1中和抗体硬膜外腔单次给药仅能短时间内抑制疼痛行为学,我们有理由再进一步探究CXCL1的上游调控体系,以完善Ost抗炎镇痛的理论依据及探究Ost在髓核致炎大鼠中通过下调CXCL1/CXCR2表达的具体机制。
综上,自体髓核置于L5神经根周围诱导产生神经根炎症和疼痛超敏反应后,大鼠脊髓背角中CXCL1/CXCR2的表达明显增加,给予CXCL1中和抗体(AF-515)和蛇床子素后,大鼠行为学改善并且脊髓背角CXCL1/CXCR2的表达明显下调。本研究证实大鼠脊髓背角中的CXCL1/CXCR2在髓核导致的神经根痛的发生发展中起到重要角色,且Ost可能通过抑制趋化因子CXCL1及其受体CXCR2的表达而缓解大鼠痛觉过敏。
(致谢:本实验研究在广东省广州市中山大学第一附属医院骨科研究所完成,感谢各位老师和实验室同事对本实验的指导和帮助!)
