基于铜/银纳米簇检测铜离子的方法研究
2020-03-19孙亚兰蔡伊娜任冰雪彭池方
孙亚兰,蔡伊娜,任冰雪,彭池方,*
(1.江南大学 食品学院,江苏 无锡 214122;2.深圳海关 食品检验检疫技术中心,广东 深圳 518045)
铜是人体内含量第三的金属元素,但摄入过量的铜离子(Cu2+)也会影响人体机能,损伤器官[1-2]。因此,对环境和食品中Cu2+的检测受到关注。目前,Cu2+的检测方法主要有原子吸收光谱法(AAS)[3]、共振散射光谱法[4]、电感耦合等离子体质谱法[5]等,但这些方法需专业人员操作,成本高。因此,开发操作简单、成本低廉的Cu2+检测方法具有重要的应用价值。
近年来,金属纳米簇以其低毒性、高荧光强度和良好的生物相容性引起了人们的极高兴趣。至今,已有多种金属纳米簇(包括金、银、铜等)在细胞成像、医疗诊断、小分子检测和离子检测等领域得到广泛应用[6]。同时,人们还发现双金属纳米簇(NCs),如Au/AgNCs[7]、Cu/AgNCs[8-9]等也具有许多优异的特性。Li等[9]利用DNA-Cu/AgNCs建立了一种高灵敏度的乙酰胆碱酯酶检测方法,该法检测乙酰胆碱酯酶的线性范围为0.05~2.0 mU/mL,检出限为0.05 mU/mL。
与传统荧光材料相比,金属纳米簇的荧光强度相对较弱,因此,增强纳米簇的荧光强度也是研究者关注的重点之一。2010年,Martinez课题组[10]通过DNA分子杂交将富含鸟嘌呤(Guanine,G)的DNA序列放置在DNA-AgNCs附近,发现DNA-AgNCs的荧光增强了500倍。Li等[11]通过“TTTTT”环将含G序列的适配体与合成银纳米簇的DNA序列直接连接,利用连接后的核酸序列作为模板DNA合成了荧光增强型的AgNCs,并将DNA-AgNCs应用于细胞成像中。在此基础上,Wang等[12]提出G-四联体可以作为DNA模板的一部分,尤其是作为C3A(CCCA)结构的DNA模板的一部分合成荧光增强型的DNA-AgNCs。综上所述,将G碱基插入到邻近C序列的位置时会使AgNCs出现荧光增强现象。Guo等[13]发现,当将G碱基插入到连续的C序列模板中间位置时也可使AgNCs出现荧光增强现象。而双金属Cu/Ag纳米簇(Cu/AgNCs)是否存在G碱基邻近或插入增强效应尚未见报道。
本文选择常见的富C碱基序列制备DNA-Cu/AgNCs,探究了邻近或插入G碱基序列对的DNA序列对DNA-Cu/AgNCs的荧光增强效应,以及对不同金属离子的选择性;并基于此建立了快速高灵敏的Cu2+荧光检测新方法。
1 实验部分
1.1 仪器与试剂
紫外分光光度计(UV-2802pcs,优尼柯公司);高分辨透射电子显微镜(JEM-2100,日本电子株式会社);分析天平(MS105DU,梅特勒-托利多仪器上海有限公司);荧光分光光度计(F97Pro,上海棱光技术有限公司)。
硝酸铜(Cu(NO3)2)、硝酸银(AgNO3)、硝酸铁(Fe(NO3)3)、硫酸镍(NiSO4)、硝酸铝(Al(NO3)3)、氯化锰(MnCl2)、硝酸铅(Pb(NO3)2)、硝酸锌(Zn(NO3)2)溶液和硝酸汞(Hg(NO3)2)、硼氢化钠(NaBH4)均为分析纯,购自上海阿拉丁生化科技股份有限公司;甘氨酸、5-吗啉丙磺酸(MOPS)、九水合硝酸铁(Fe(NO3)3·9H2O)、六水合硫酸镍(NiSO4·6H2O)、九水合硝酸铝(Al(NO3)3·9H2O)、四水合氯化锰(MnCl2·4H2O)、硝酸铅(Pb(NO3)2)、六水合硝酸锌(Zn(NO3)2·6H2O)、硝酸汞(Hg(NO3)2)均为分析纯,购自国药集团化学试剂有限公司。实验用水为Millipore制备的18.2 MΩ·cm的超纯水。
相关的DNA序列均由生工生物工程(上海)有限公司合成,7条不同模板DNA序列见表1。

表1 制备铜/银纳米簇的DNA模板序列
1.2 DNA-Cu/AgNCs的制备
DNA-Cu/AgNCs的合成方法根据文献[14]方法稍作调整,具体如下:将45 μL AgNO3(1.0 mmol/L)、45 μL Cu(NO3)2(1.0 mmol/L)和10 μL不同序列的DNA(500 μmol/L)模板加入到90 μL磷酸盐缓冲液(40 mmol/L,pH 7.0)中混合均匀,然后置于冰浴中孵育15 min后立即加入30 μL NaBH4(2.0 mmol/L),置于暗处,室温下孵育9.0 h。将所得DNA-Cu/Ag NCs溶液置于4 ℃下保存待用。
1.3 选择性分析
分别配制20 μmol/L的硝酸铁(Fe(NO3)3)、硫酸镍(NiSO4)、硝酸铝(Al(NO3)3)、氯化锰(MnCl2)、硝酸铅(Pb(NO3)2)、硝酸锌(Zn(NO3)2)和硝酸汞(Hg(NO3)2)溶液。取上述金属离子溶液各50 μL,分别与50 μL DNA-Cu/AgNCs溶液室温下孵育15 min后测定荧光发射光谱。
1.4 铜离子(Cu2+)检测方法
首先将30 μL NaBH4(100 μmol/L)与20 μL汞离子(5.0 μmol/L)(含不同浓度铜离子)溶液室温下混合均匀并孵育20 min,屏蔽汞离子。取用MOPS缓冲溶液(10 mmol/L,pH 8.0)稀释2 000倍的DNA-Cu/AgNCs溶液30 μL,与20 μL上述含不同浓度铜离子的溶液室温下孵育15 min,取该孵育后溶液100 μL加入石英比色皿,检测反应液在500 nm激发波长处的荧光发射光谱。
1.5 样品分析
收集实验室的自来水和湖水(取自无锡太湖)进行加标回收实验。在自来水样品中加入不同浓度(0.2、2.0、5.0 μmol/L)的Cu2+,用0.22 μm微孔滤膜过滤,即得到用于检测的加标自来水样品。按照“1.4”方法测定加标样品的荧光发射光谱并计算回收率。类似地,在湖水中分别加入浓度为1.0、10.0、25.0 μmol/L的Cu2+,经微孔滤膜过滤,用超纯水稀释5倍,按上述方法测试计算。
2 结果与讨论
2.1 DNA-Cu/AgNCs的制备与表征
根据Guo等[13]的研究得知,在DNA模板中邻近C碱基的位置添加G碱基可以增强银纳米簇荧光,由此,本文设计了3种在C碱基邻近位置添加G碱基的方式,共得到7条不同序列,编号2~8,对照模板为合成银纳米簇的常用模板,编号为1,如表1所示。

图1 DNA1-Cu/AgNCs~DNA8-Cu/AgNCs的荧光光谱图
将使用DNA1~8合成的DNA-Cu/AgNCs分别编号为DNA1-Cu/AgNCs~DNA8-Cu/AgNCs,由荧光光谱图(图1)可见,DNA1-Cu/AgNCs在最大激发波长为472 nm时,最大发射波长为566 nm;DNA2-Cu/AgNCs在最大激发波长为500 nm时,最大发射波长为583 nm;DNA3-Cu/AgNCs~DNA8-Cu/AgNCs在最大激发波长为465~469 nm时,最大发射波长为550~560 nm;其中,DNA2-Cu/AgNCs相对于使用对照模板合成的铜/银纳米簇(DNA1-Cu/AgNCs)来说,不仅最大发射波长红移了17 nm,而且在最大发射波长处的荧光强度显著增强,这也与之前报道的将G序列插入C碱基的邻近位置会导致银纳米簇荧光增强的结果一致[12]。
如图2A所示,DNA2-Cu/AgNCs的紫外吸收光谱仅在262 nm处有最强吸收峰,这表明所制备的纳米簇颗粒尺寸超小;而在最大激发波长500 nm下,DNA2-Cu/AgNCs于583 nm处有最强吸收峰。由图2B可知,DNA2-Cu/AgNCs的粒径约3.0 nm,在水溶液中呈均匀分散状态。由图2C可见,DNA2-Cu/AgNCs主要由C、N、O、P、Cu、Ag 6种元素组成,其中Cu元素含量显著高于Ag元素;元素面扫描分析(图2D)也与此结果一致。
2.2 选择性分析
为了考察DNA2-Cu/AgNCs对Cu2+检测的选择性,研究了该方法对常见的10种金属离子(Fe2+、Ni2+、Al3+、Mn2+、Pb2+、Zn2+、 Hg2+、Ca2+、Mg2+、Cu2+)的响应。结果如图3A所示(IF0为初始荧光强度,IF为加入Cu2+的荧光强度),10 μmol/L的其他阳离子对反应体系的荧光强度无显著影响,而1.0 μmol/L的Hg2+和10 μmol/L的Cu2+使DNA-Cu/AgNCs的荧光强度明显猝灭。说明该纳米簇对Hg2+和Cu2+均存在响应。为了实现对Cu2+的高选择性测定,探讨通过Hg2+的屏蔽来实现单一离子的检测。如图3B所示,5 μmol/L的NaBH4使被Hg2+猝灭的DNA2-Cu/AgNCs荧光强度得到完全恢复。已有研究表明,AgNCs表面存在许多Ag+,而Hg2+与Ag+之间存在强烈的亲金属作用。因此,推测Hg2+对DNA-Cu/AgNCs的猝灭效应主要来自Hg2+与Ag+之间的亲金属作用。NaBH4可将Hg2+快速还原为Hg0,这将破坏Hg2+与Ag+之间的亲金属作用[14],使DNA2-Cu/AgNCs的荧光恢复。
如图3C所示,对比a、b、c和d 4组实验,发现NaBH4可以使DNA2-Cu/AgNCs被Hg2+猝灭的荧光得到恢复。e与f组实验结果一致,说明掩蔽剂可以屏蔽Hg2+的影响。同时,NaBH4对Cu2+的检测也基本无影响(图3C中f、g)。上述结果表明,NaBH4可以在此传感体系中作为Hg2+的掩蔽剂。
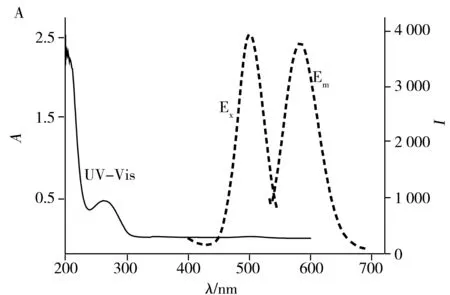



图2 DNA2-Cu/AgNCs的荧光光谱与紫外吸收光谱(A)、TEM图(B)、EDX谱图(C)及元素面扫描图(D)



图3 检测方法对不同金属离子的选择性(A)、不同浓度的NaBH4对Cu2+检测的影响(B)以及不同反应体系对DNA2-Cu/AgNCs荧光性能的影响(C)
Fig.3 Selectivity of the assay for different metal ions(A),effect of NaBH4on Cu2+detection(B) and effect of different reaction system on the fluorescence intensity of DNA2-Cu/AgNCs(C)cHg2+:1.0 μmol/L,cother ions:10 μmol/L;NCs:DNA2-Cu/AgNCs
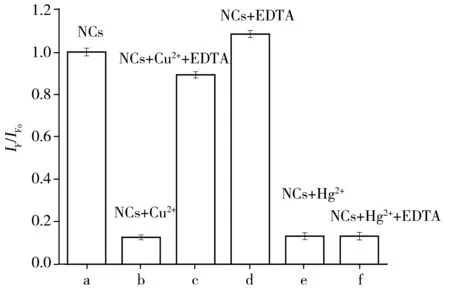
图4 EDTA对DNA2-Cu/AgNCs(NCs)荧光的影响
2.3 Cu2+与DNA-Cu/AgNCs之间的作用
由图4可见,DNA2-Cu/AgNCs的荧光被Cu2+猝灭后加入乙二胺四乙酸二钠(EDTA),其荧光强度可基本恢复;而EDTA对DNA2-Cu/AgNCs的荧光强度仅有较小影响。因此推测,Cu2+对于纳米簇的荧光猝灭主要是通过核酸模板分子的络合作用而发生。研究显示,鸟嘌呤(G)可由其N7和O6原子以及胞嘧啶(C)上的N3和O2原子与Cu2+发生络合作用[15]。另外,在DNA2-Cu/AgNCs的荧光被Hg2+猝灭后加入EDTA,其荧光强度无任何变化(图e,f)。上述实验结果表明,Hg2+主要通过和Ag+间的亲金属相互作用导致纳米簇荧光猝灭。由于EDTA对Hg2+的络合作用难以破坏Hg2+-Ag+键合作用,因此纳米簇荧光难以恢复。
2.4 Cu2+荧光检测的条件优化及标准曲线
为了提高DNA2-Cu/AgNCs检测Cu2+的灵敏性,对实验条件进行了优化。确定DNA2-Cu/AgNCs与Cu2+溶液的最适孵育时间为15 min,DNA2-Cu/AgNCs的最适稀释倍数为2 000倍(图5A,B)。在最优反应条件下,利用NaBH4掩蔽Hg2+,Cu2+浓度(x)在0.01~5.0 μmol/L范围内与荧光猝灭率IF/IF0(y)呈现良好的线性关系,线性方程为y=0.740 17-0.084 77x,r2=0.982 55,最低检出限为5.0 nmol/L(根据3σ/s计算,其中σ为空白对照的标准偏差,s为指线性方程的斜率)。该方法的检出限远低于《生活饮用水卫生标准》(GB 5749-2006)中规定的Cu2+的限量1.0 mg/L(15.6 μmol/L)。

2.5 实际样品检测
采用本方法测定自来水和湖水样品中的Cu2+含量并与原子吸收光谱(AAS)方法测定结果进行比较,同时对实验室的自来水进行0.2、2.0、5.0 μmol/L 3个水平的加标实验,对湖水进行1.0、2.0、5.0 μmol/L 3个水平的加标实验,结果如表2所示。该方法对Cu2+的回收率为89.6%~107%,相对标准偏差(RSD)为2.7%~8.6%,表明该方法具有良好的准确性和重复性。

表2 自来水和湖水样品中Cu2+的检测(n=3)
(续表2)

SampleAdded(μmol/L)Found(nmol/L)Recovery(%)RSD(%)AAS(μmol/L)Lake water0239.0--223.71.0964.396.47.9 -2.02 1081055.3 -5.05 3101065.4-
3 结 论
基于双金属DNA-Cu/AgNCs存在的G碱基邻近增强效应以及由此产生的对Cu2+的特异性响应,建立了测定Cu2+的荧光传感方法。该方法的线性范围为0.01~5.0 μmol/L,检出限低至5.0 nmol/L。方法可用于实际样品检测,且具有简单快速、选择性高、成本低等优点。
