离线二维色谱结合糖苷外切酶酶解用于IgG与人血清糖蛋白中N-糖链的结构表征
2020-03-19张含智康经武
李 凤,张含智,康经武
(1.西安文理学院 化学工程学院,陕西 西安 710065;2.上海市食品药品检验所,上海 201203;3.中国科学院上海有机化学研究所 生命有机化学国家重点实验室,上海 200032)
蛋白质糖基化是一类重要的翻译后修饰过程,糖蛋白中的糖链结构不仅影响蛋白质的性质,如折叠、稳定性和溶解性等,还在细胞识别、信号转导、细胞粘合以及免疫应答等多种细胞过程中具有重要作用[1]。在这些糖蛋白中,N-糖链的还原端通过糖肽键连接到肽链的天冬酰胺(Asn)残基上,而O-糖链连接到肽链的丝氨酸(Ser)或苏氨酸(Thr)残基上。免疫球蛋白是血清中高丰度的糖蛋白,也是一类重要的免疫效应分子。人体血清中抗体的主要成分——免疫球蛋白G(Immunoglobulin G,IgG)由两条重链和两条轻链组成[2]。糖链对抗体的稳定性至关重要,可调节或者协调抗体的功能以及生物活性[3],通过优化重组单克隆抗体(Monoclonal antibody,MAb)糖基化作用来改善药效是一个重要的研究领域[4]。研究表明自身免疫性疾病以及癌症中IgG糖基化发生改变的原因对理解这类疾病的分子发生机制,以及寻找合适的药物靶标都非常有意义[5]。
血清作为人体最重要的体液,在临床诊断和疾病的监控中应用广泛,其中糖蛋白的糖基化与疾病的发生和发展密切相关[6]。目前,基于抗体的免疫化学测试在癌症的诊断和监测中应用较为广泛,如卵巢癌的CA125,乳腺癌的CA19-9或者CA15-3等[7]。但这些测试在癌症早期检测中的特异性和灵敏度均较差,仍需寻找与疾病密切相关的糖链应用于临床[8]。因此,建立糖蛋白中糖链的分析方法对寻找与疾病相关的生物信息具有重要的现实意义。Callewaert教授利用DNA测序仪建立了糖蛋白中N-糖链的分析平台,发展了GlycoirrhoTest方法应用于慢性肝脏疾病的诊断,该方法的特异性为86%,敏感性为79%,与临床Fibrotest诊断方法相结合则可将特异性提高到100%[9]。Rudd教授与Waters公司合作建立的高效、自动化糖分析平台,也成功应用于临床人血清样品生物标志物的研究中。分析发现,与正常组相比,乳腺癌患者血清样本的N-糖链唾液酸化程度、分支结构以及岩藻糖化程度明显增加[10]。
糖蛋白N-糖链常用的分离鉴定方法包括液相色谱、毛细管电泳(CE)、质谱及其联用技术等[11-13]。其中CE具有分离效率高、样品消耗少等优点,在复杂糖链结构表征中具有很大的应用潜力。Guttman课题组长期致力于将CE应用于糖链的结构分析中,实现了糖蛋白类抗体药物N-糖链的结构鉴定[14]。王文波等利用毛细管电泳对原研抗CD20人鼠嵌合单抗和4个生物类似药的N-糖链进行分析[15]。本课题组将激光诱导荧光毛细管电泳(CE-LIF)用于中药多糖中单糖组成的定性定量分析,并建立了人血清N-糖链的指纹图谱[16]。但对于复杂的生物样本,蛋白种类繁多,动态范围极广,对低丰度的糖蛋白N-糖链进行结构分析困难较大。本文采用离线二维色谱,将弱阴离子交换色谱与CE-LIF相结合,实现了不同唾液酸化程度的N-糖链的分离。并将糖苷外切酶测序分别应用于中性N-糖链和不同唾液酸化程度N-糖链的结构鉴定中,最终确定了IgG的18种糖型。将其应用于人血清中N-糖链的指纹图谱结构分析,发现人血清中的主要中性N-糖链与IgG中的中性N-糖链结构非常类似,同时发现人血清中含量最丰富的是含有两个唾液残基的糖链,其中两天线的N-糖型FA2G2S2含量最高。
1 实验部分
1.1 仪器与试剂
P/ACE MDQ CE系统配LIF检测器(美国Beckman Coulter公司),激发波长488 nm,发射波长520 nm。Agilent 1260液相色谱系统配有紫外光度检测器(VWD)和荧光检测器(FLD);Agilent 7820A气相色谱仪。弹性石英毛细管柱50 μm i.d.,360 μm o.d.(Polymicro Technologies,USA);聚乙烯醇(PVA)中性涂层毛细管柱(实验室自制)。
肽N-糖苷酶F(PNGase F)试剂盒、唾液酸酶、β1-4 半乳糖苷酶购于美国纽英伦生物技术有限公司(New England Biolabs,USA)。α-L-岩藻糖苷酶(来源于牛肾)、免疫球蛋白G(IgG)、正常人血清、甲酸铵、乙酸铵、碳酸氢铵、二硫苏糖醇(DTT)、二甲亚砜(DMSO)、三乙胺、甲酸、乙酸(HAc)、三氟乙酸(TFA)、聚乙二醇(Mw20000)、聚乙烯醇(PVA)、2-氨基苯甲酰胺(2-AB)、葡聚糖混合物(Dextran ladder)、1 mol/L 氰基硼氢化钠溶液(溶剂为四氢呋喃)、氰基硼氢化钠(Na2BH3CN)、聚酰胺固相萃取小柱(DPA-6S)、胎球蛋白(Fetuin)购自于Sigma-Aldrich。 Sep-Pak C18固相萃取小柱购自Waters。多孔石墨化碳柱(Graphitized carbon cartridge,PGC小柱)购自Grace 。8-氨基芘-1,3,6-三磺酸三钠盐(APTS)购于美国Invitrogen。APTS标记的葡聚糖混合物(Glyko®APTS-(Maltodextrin Ladder))购自Agilent。乙腈、甲醇、超滤管(0.5 mL,3 kDa MWCO)购自美国Merck。实验用水为18 MΩ·cm超纯水(Millipore超纯水系统,美国Millipore公司)。所有溶液使用前需用0.22 μm滤膜过滤。
1.2 样品前处理
1.2.1 N-糖链的制备由于N-糖链与蛋白质的天冬酰胺残基连接,需将其从糖蛋白上酶解后再进行分析。IgG酶解方法如下:在100 μL 100 mmol/L碳酸氢铵溶液(含有5 mmol/L DTT)中配制IgG糖蛋白溶液(蛋白质量浓度为1 mg/mL),于100 ℃和25 ℃交替加热20 s,重复6次;冷却至室温,加入 2 μL(1 000 U)PNGase F酶,于37 ℃水浴酶解过夜,真空离心,浓缩至干备用。人血清样品酶解方法如下:首先用3 kDa 超滤管处理去除血清样品中的低分子量组分,然后将人血清样品5 μL(蛋白质量浓度 10 mg/mL)参考PNGase F试剂盒的操作流程进行如下处理,首先加入10 μL 2% 十二烷基苯磺酸钠(SDS)于60 ℃下孵育10 min,依次加入5 μL 4% 乙基苯基聚乙二醇(NP-40)以及2 μL PNGase F,37 ℃水浴酶解过夜。加入一定体积的预冷乙醇,使乙醇最终含量为75%,混匀后于-20 ℃静置0.5 h,13 400 r/min离心15 min。取上清液,真空离心,浓缩至干备用。
1.2.2 N-糖链的纯化酶切后的样品溶于0.5 mL 5%(体积分数,下同)乙腈(含0.1% TFA)中,通过PGC小柱纯化N-糖链:固相萃取柱先用 4 mL 80%乙腈(含0.1% TFA)活化,上样后用2 mL 5%乙腈(含0.1% TFA)冲洗,最后用1.0 mL 40%乙腈(含0.1% TFA)洗脱样品,回收洗脱液,真空离心,浓缩至干备用。
1.2.3 N-糖链的荧光衍生2-氨基苯甲酰胺(2-AB)荧光衍生:用DMSO-HAc(7∶3,体积比)配制50 g/L 2-AB和60 g/L NaBH3CN混合溶液,取5 μL该混合溶液加入样品中,于37 ℃放置过夜后完成衍生反应。
APTS荧光衍生:用15%(体积分数)乙酸配制20 mmol/L的 APTS溶液,在糖链样品中加入2 μL该APTS溶液以及2 μL 1 mol/L NaBH3CN的四氢呋喃(THF)溶液,于37 ℃放置过夜后完成衍生反应。
1.2.4 衍生后N-糖链纯化2-AB和APTS衍生后的样品均可通过固相萃取小柱DPA-6S纯化。先用 4 mL 95%乙腈平衡小柱,上样后用95%乙腈(含50 mmol/L三乙胺)冲洗,最后用1 mL 50 mmol/L三乙胺水溶液洗脱样品,回收洗脱液,真空离心,浓缩至干备用。
1.2.5 荧光标记N-糖链的酶切将从50 μg蛋白样品(IgG或人血清)中制得的N-糖链以HPLC分离,得到不同唾液酸程度的组分。APTS荧光标记并纯化后,离心浓缩干燥,溶解在50 μL 50 mmol/L乙酸铵缓冲溶液(pH 5.5)中,依次加入2 μL唾液酸酶、2 μLα-L-岩藻糖苷酶、2 μLβ1-4 半乳糖苷酶进行单一或混合酶切,酶切后的样品真空离心浓缩至干,加入50 μL超纯水溶解后,进行CE-LIF分析。
1.3 PVA 涂层柱的制备
配制6% PVA溶液,超声脱气10 min。截取4 m,50 μm i.d.的毛细管柱,在氮气作用下,向毛细管柱通入6% PVA溶液,持续2 h,然后去除未与毛细管表面结合的PVA,最后将其置于气相色谱仪的恒温箱中,以5 ℃/min的速率程序升温至145 ℃,保持5 h。
1.4 CE条件
PVA涂覆毛细管柱50 cm(有效长度39.5 cm);分离电压:20 kV;压力进样:0.3 psi×5 s;柱温为25 ℃;背景电解质为25 mmol/L 乙酸铵(pH 4.75)和0.4% PEG 20000。
1.5 HPLC条件
色谱柱为Asahipak ES-502N(7.6 mm×100 mm,9 μm);流动相:A为20% 乙腈水溶液,B为含250 mmol/L 甲酸铵(pH 4.5)的20%乙腈水溶液。梯度洗脱:0~10 min,2.5% B;10~36 min,2.5% ~67.5% B。流速:0.8 mL/min;进样量:10 μL;柱温:30 ℃;荧光检测,激发波长为330 nm,发射波长为420 nm。
2 结果与讨论
2.1 IgG中N-糖链的结构分析
2.1.1 离线二维色谱鉴定IgG的唾液酸化程度本文采用离线二维色谱的分离模式。第一维是弱阴离子交换色谱(Anion exchange chromatography,AEC),选用Asahipak ES-502N色谱柱,以亲水性聚乙烯醇为载体基质,表面键合二乙胺乙基官能团,通过盐的梯度洗脱将所有N-糖链按照所含唾液酸的个数(0~4)进行分离;对相同唾液酸个数的组分,分别制备后,进一步通过APTS荧光衍生进行第二维的CE-LIF分析。由于糖链进行CE-LIF分析前,需采用APTS进行荧光衍生,而衍生试剂含有4个磺酸根,与弱阴离子交换色谱分离模式不兼容,可通过以下操作解决:(1)先用中性衍生试剂2-AB荧光衍生,对色谱条件进行优化,确定最优条件下不同唾液酸糖链的保留时间;(2)未衍生的糖链以上述相同的色谱条件进行分离,按照已确定的保留时间窗口制备得到不同唾液酸程度的糖链产品;(3)制备的糖链经过反相C18固相萃取小柱脱盐后,以APTS荧光衍生,再进行CE-LIF分离。在色谱条件优化时,以标准糖蛋白胎球蛋白(Fetuin)N-糖链的唾液酸个数为参考标准进行IgG中N-糖链的归属。
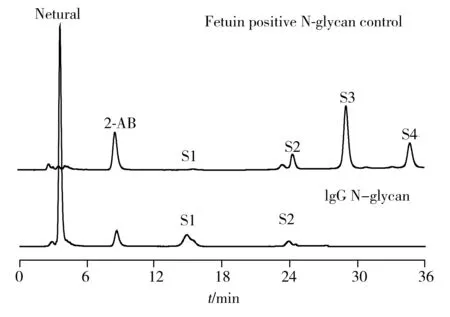
图1 弱离子交换色谱分析IgG中N-糖链荧光衍生产物

图2 CE-LIF分离不同唾液酸化程度的IgG的N-糖链
如图1所示,以Fetuin中N-糖链的保留时间为参考标准归属IgG糖链的唾液酸化程度。实验发现,IgG中含量最丰富的是中性糖链(占总量的90%),同时也含有少量单唾液酸(Monosialylated,S1)以及二唾液酸(Disialylated,S2)的糖型。对不同唾液酸程度的N-糖链进行制备,荧光衍生后进行CE-LIF分析。如图2所示,制备后各组分的荧光强度明显上升,有利于后续采用糖苷外切酶酶切测序进行结构鉴定。
2.1.2 CE-LIF结合糖苷外切酶酶解鉴定IgG的糖型糖蛋白N-糖链中的常见组成单糖类型包括甘露糖(Man)、N-乙酰葡萄糖胺(GlcNAc)、半乳糖(Gla)、岩藻糖(Fuc)和唾液酸(Sia)。同时所有N-糖链都有一个由3个甘露糖和2个N-乙酰葡萄糖胺组成的核心五糖结构,即GlcNAc2Man3。N-糖链的结构解析选择针对不同单糖、不同糖苷键特异性的糖苷外切酶酶切进行,通过建立酶阵列分析即利用CE-LIF测定依次特异性切除单糖后剩余的寡糖结构,实现自上而下的酶解消化(Top-down digestion)。具体而言,就是对去除端部单糖(如唾液酸、岩藻糖、半乳糖或N-乙酰氨基葡萄糖)后得到的糖链进行CE-LIF分析,重复上面的过程直至只剩下核心五糖结构。通过比较分析酶切前后所有的CE谱图,考察酶切引起的色谱峰迁移时间的改变,将整个糖链结构进行重建实现自下而上的结构归属(Bottom-up identification)。
如图3所示,对IgG中的中性糖链进行结构归属。采用上述分析策略,以β1-4半乳糖苷酶和α-L-岩藻糖苷酶进行单一或混合酶切。结果表明,两种酶完全酶切后,分别得到含量稍高的两天线型N-糖链以及平分型GlcNAc的N-糖链(图3d)。实验发现,从核心岩藻糖两天线的糖型FA2G2中去除α1-6岩藻糖引起的葡萄糖单元数(即GUs值)变化为1.08,而从类似糖型FA2BG2中去除α1-6岩藻糖引起的GUs值变化为0.89。这是由于在CE分离中,酶切前后GUs的变化除与酶切去掉的单糖个数有关,还与糖链的主体结构密切相关,因为寡糖的电泳淌度由待分析物的流体力学体积所决定[17]。
在鉴定中性N-糖链结构的基础上,进一步对单唾液酸组分进行分析,发现其最主要的组分是FA2G2S1和含有分叉型GlcNAc的类似物。其中FA2[3]G1异构体的含量相对较高,而中性组分中这类糖型的含量相对较低(图3A,a;图4)。文献发现,IgG中α1-6连接的甘露糖残基与CH2结构域的多肽存在较强的相互作用,而α1-3的甘露糖延伸至重链以外的空间[18]。所以α1-3天线的半乳糖发生唾液酸化更有利,蛋白更加稳定。采用bottom-up策略对单唾液酸糖链组分和二唾液酸糖链组分进行归属(图4),结果显示其主要含有的糖链类型是FA2G2S3以及FA2BG2S3。
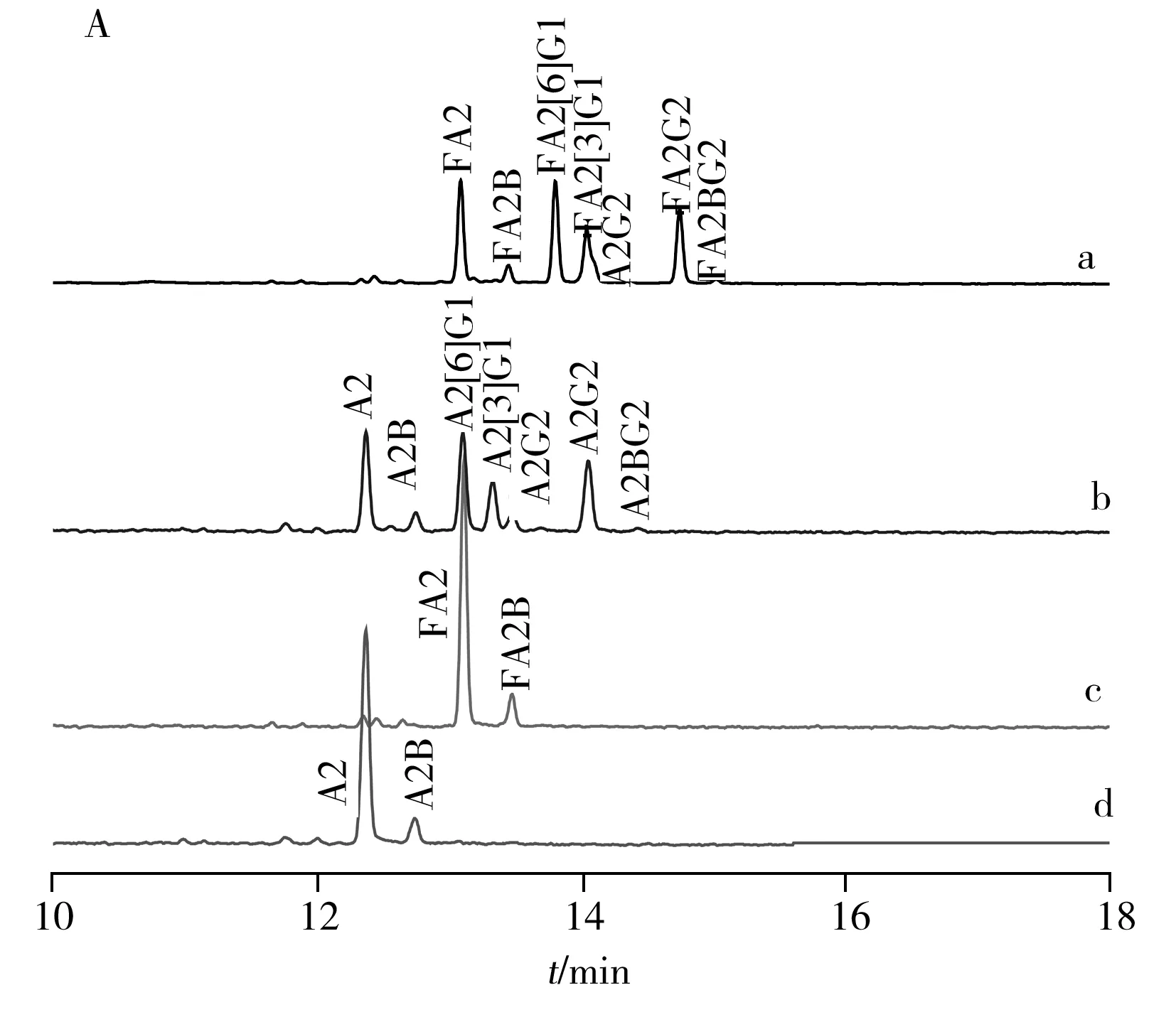

图3 糖苷外切酶测序分析IgG中性糖链的CE-LIF色谱图(A)和结构示意图(B)


图4 CE-LIF结合外切酶测序分析单唾液酸(A)和二唾液酸(B)IgG的N-糖链

图5 IgG中18种糖型的CE-LIF色谱图
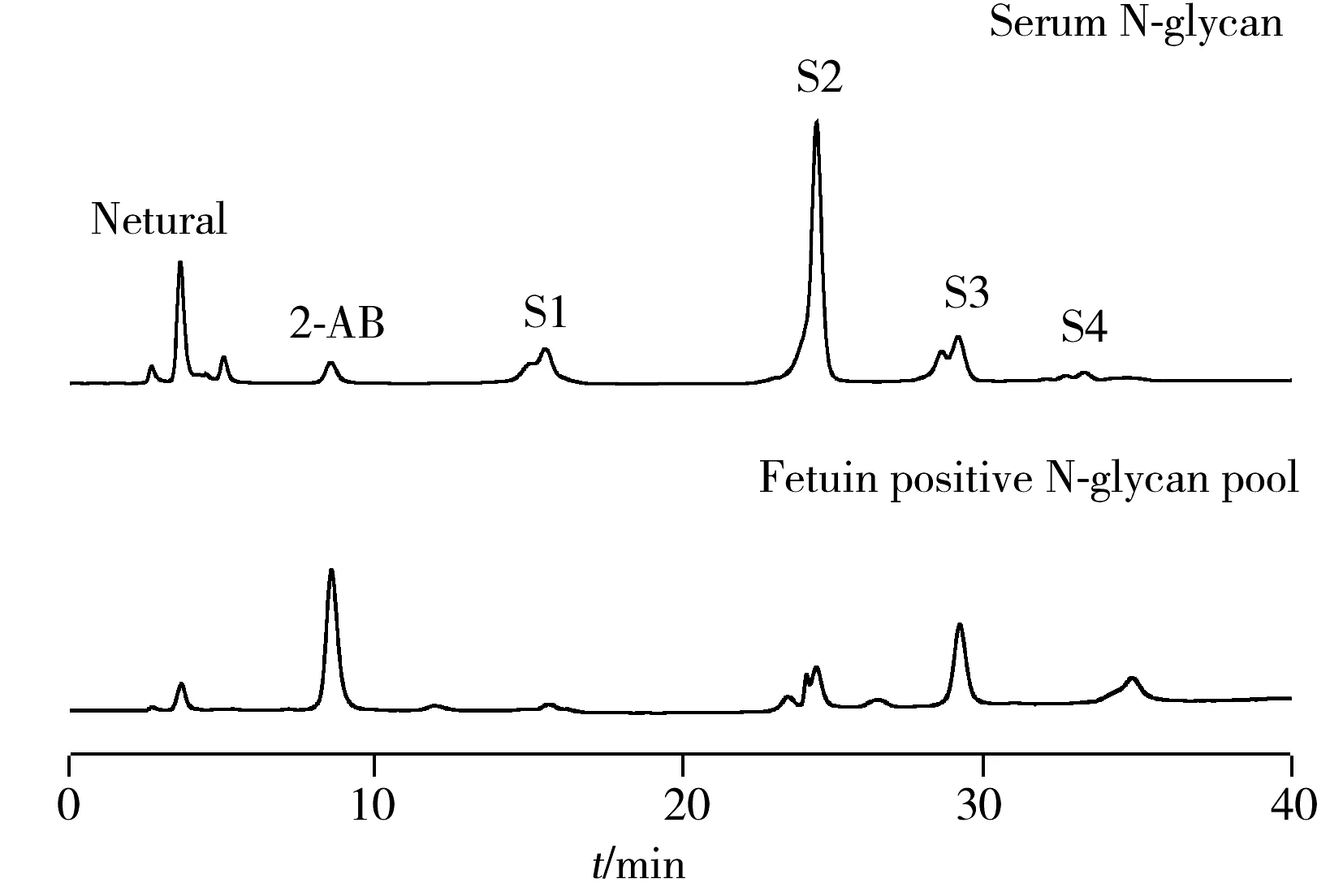
图6 弱阴离子交换色谱分析人血清中N-糖链
相比于亲水相互作用色谱(HILIC)方法,CE-LIF可以较容易地实现异构体FA2[6]G1与FA2[3]G1的分离。可能是因为,HILIC的主要分离原理是基于待分析物的亲水性差别,而CE-LIF的分离效果与待分离组分的流体力学体积相关,可以更好地实现异构体的分离[10]。通过将离线二维色谱与糖苷外切酶测序相结合,CE-LIF方法共分离鉴定了IgG中的18种糖型(图5),所鉴定的糖型包括Wuhrer课题组讨论的IgG中常见的16种糖型,证明该方法与文献报道的结果较一致[19]。与色谱-质谱联用技术相比,部分含量较低的高甘露糖糖型未被鉴定,说明本方法的灵敏度还有待进一步提高[20]。但基于毛细管电泳的方法成本更低,容易实现高通量检测,在生物制药行业具有重要的应用潜力。
2.2 离线二维色谱鉴定人血清中N-糖蛋白的唾液酸化程度
将离线二维色谱与糖苷外切酶分析相结合,对CE-LIF分离得到的人血清电泳图中的N-糖链进行结构归属。先通过弱阴离子交换对血清中的N-糖链进行制备,分别得到Neutral、S1、S2、S3以及S4 5个组分的糖链混合物,其组分内具有相同的唾液酸化程度(图6)。5个组分间唾液酸化程度糖链的相对量为S1∶S2∶S3∶S4=4.7∶20.9∶6∶1。对这5个组分唾液酸酶酶切前后的情况进行CE-LIF分析(图7),并以IgG中N-糖链作为标准,对CE-LIF中丰度较高的组分进行结构归属,发现其中含量最高的是FA2G2S2。实验发现人血清糖蛋白的中性N-糖链结构与IgG非常类似,这与文献报道的IgG是人血清中含量最高的免疫球蛋白一致[17]。

图7 CE-LIF分析人血清中不同唾液酸化程度的N-糖链
3 结 论
本文将弱阴离子交换色谱以及毛细管电泳的二维分离平台应用于IgG以及人血清中N-糖链的结构鉴定。采用“bottom-up”的策略对IgG中的糖链结构进行鉴定,发现酶切前后GUs的变化即寡糖的电泳淌度,与糖链的流体力学体积密切相关。通过将离线二维色谱与糖苷外切酶测序结合,采用CE-LIF共分离鉴定了IgG中18种糖型。将上述策略进一步应用于人血清中N-糖链的分析,发现不同唾液酸化程度糖链的相对量为S1∶S2∶S3∶S4=4.7∶20.9∶6∶1。同时,研究表明人血清中含量最丰富的是二唾液化的糖型,其中两天线的FA2G2S2含量最高。本文实现了人血清中N-糖链指纹图谱的初步结构分析,在发现糖蛋白类生物标志物中具有较大的应用潜力。
