柳江流域不同水文季节水质对附生硅藻群落的影响研究
2020-03-19李佳静刘威邓培雁
李佳静,刘威,邓培雁,
1.华南师范大学化学与环境学院,广州 510631
2.广州大学环境科学与工程学院,广州 510405
0 前言
硅藻是河流生态系统的重要初级生产者,在生态系统的物质循环和能量流动中起着重要作用[1]。相对于底栖动物和鱼类,硅藻具有种类繁多、生命周期短、对水环境变化敏感等特征,其群落结构变化能较好地反映各种污染物对河流累积产生的综合生态效应[2],常被广泛用作水质监测和水生态健康评价的有效指示生物[3]。
水质、地理因子、人为干扰等是影响硅藻群落形成时空分布特征的重要因素,而水质被认为是最主要的影响因素[4-6],这是因为在流域尺度上,地理因子或者人为干扰都以水质为介质对附生硅藻群落起作用[7]。然而,河流作为一个动态系统,其水质理化特征往往因人为活动和地形、降雨等自然因素的驱动而存在不同的时空差异性[8]。不同硅藻对水体中营养物、有机污染物和重金属等的敏感程度和耐受能力不同,其群落组成在不同的理化条件下也会产生较大差异[9-10]。刘麟菲等[1]报道了渭河水系硅藻群落特征及其水质影响因子在枯水期和丰水期具有显著差异。Dalu 等[6]也强调了水文季节变化下的水质因子对硅藻种类组成,群落演替的作用程度不同。因此,阐明水质动态变化对硅藻群落时空变化的影响,才可更好地利用硅藻进行河流的生态监测与管理。
柳江流域是珠江流域西江水系的第二大支流,干流全长 751 km,面积 58520 km2,发源于贵州省独山县,跨越黔、桂、湘三省,是流域周围居民生活和工农业生产的重要水源[11]。同时,该流域属于雨源型河流,受季风影响显著,4—8 月为雨季,降水占全年总降水量的 72%,与其余月份具有明显的丰、枯水期变化特征[12]。目前已有学者对柳江流域支流贝江[13]和龙江[14]的硅藻群落特征进行了研究,也有学者基于附生硅藻对柳江河流构建了水质多指标的评价体系[3],但针对柳江流域硅藻群落结构的时空分布特征及其与水质因子关系的研究尚未见报道。为此,本文运用聚类分析、主成分分析和冗余分析等方法,研究了水质因子在不同水文季节变化下的硅藻优势种组成及群落结构的时空分布特征,并阐明水质动态变化对河流附生硅藻的影响,旨在为深入研究柳江流域硅藻群落的分布特征奠定基础,以期为柳江流域水质生物监测评价及水质的利用和管理提供理论依据。
1 材料和方法
1.1 采样时间与位置
本研究于 2017 年 3月(枯水期)和 6 月(丰水期)分别对柳江流域的附生硅藻和水质进行采样。根据柳江流域不同河段的地形地貌和环境状况等特征,共设置 19 个采样点(S1—S19),覆盖柳江流域的干流及支流,各采样点地理位置分布如图1所示。
1.2 采样与分析方法
根据 EN 13946 和 EN 14407 欧盟标准方法[13],并结合采样点实际情况进行采样,为减小误差,确保采样的代表性和准确性,每个样点采集 3 个平行样本。附生硅藻采样基质选取能抵抗水流、地势开阔处无树荫遮挡的石头,在每个采样点至少采集 5 块石头,用干净的硬牙刷在石块向阳面刷取硅藻,经自来水冲洗至不锈钢托盘,并收集刷洗下的硅藻样品装入广口塑料瓶中,加入 5%甲醛溶液固定保存。

图1 柳江流域采样点分布Figure 1 Location of the sampling sites in Liujiang River Basin
硅藻样品经 30%的过氧化氢溶液加热后消解,静置去除上清液,用浓盐酸进行酸化,洗涤离心后制成封片。在光学显微镜下采用 1000 倍的油镜镜检,视野内所有完整及破损面积不超过 1/4 的硅藻细胞都要鉴定和计数,每个玻片鉴定的总数大于400 个,鉴定具体到硅藻的种等级。硅藻种类鉴定主要根据 Krammer & Lange-Bertalot 鉴定体系(1986—1991)[15]开展。
水样运送回实验室后,根据《水和废水监测分析方法(第 4 版)》[16]测定高锰酸盐指数(CODMn)、氨氮(NH4+-N)、砷(As)、汞(Hg)、镉(Cd)、铅(Pb)等水质指标,水体溶解氧(DO)用多参数水质分析仪(YSI Pro 2000 美国)现场测定。
1.3 数据处理与分析
Czekanowsiki 相似系数计算公式为:
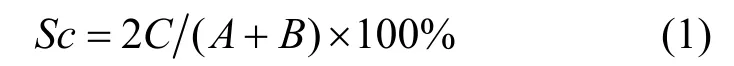
优势种以优势度指数(Y>0.02)判断,其计算公式为:

式中,A、B分别为枯、丰水期水体中的硅藻种类数,C为 2 个水期水体中共有的种类数,fi为第i种的出现频率,Pi为第i种的个体数与样品中总个体数的比值。
选择至少在2个采样点中出现且相对丰度超过1%的硅藻种,其种类拉丁文名的缩写见附录。运用主成分分析(PCA)筛选出枯、丰水期对硅藻群落影响较为显著的水质驱动因子。然后对硅藻相对多度进行降趋势对应分析(Detrended correspondence analysis,DCA),用物种单峰影响值梯度来判断是线型分布还是单峰型分布,以判定影响硅藻群落结构分布的水质因子。单因素方差分析和聚类分析在IBM SPSS 19.0 软件中处理,PCA 和 DCA 分析等在 Canoco 4.5 软件中完成。
2 结果与分析
2.1 硅藻群落种类组成
共鉴定出附生硅藻137种,隶属于6目9科34属,舟形藻属(Navicula)和曲壳藻属(Achnanthes)在各采样点中均有出现,为该流域的主要优势藻属。枯、丰水期硅藻种数分别为 99 种和 102 种,种类相似系数为 63.68%。枯水期各采样点硅藻丰富度的范围为 13—35 种,平均值为 21 种,丰水期各采样点硅藻丰富度的范围为 16—42 种,平均值为31 种(图2)。在水文季节变化上,表现为丰水期明显高于枯水期。
2.2 硅藻优势种
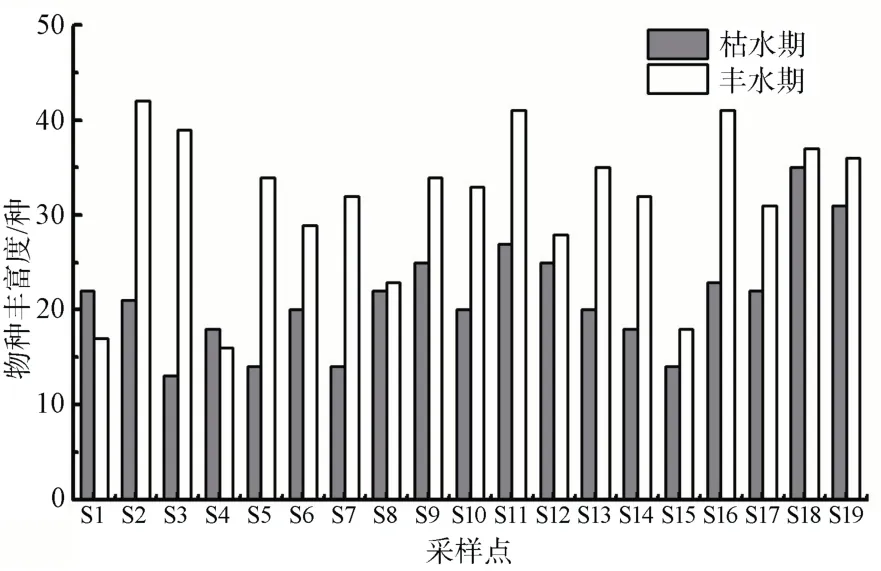
图2 各采样点硅藻种类丰富度Figure 2 Species richness of diatoms at each sampling site
两次调查共发现硅藻优势种为 11 种,其中枯水期有5种,丰水期有8种,优势度指数为0.021—0.363(表1)。硅藻优势种组成随水文季节变化呈现明显的更替状态,极小曲壳藻(Achnanthes minutissima)和隐头舟形藻(Navicula cryptocephala)在枯、丰水期都成为优势种,而Cyclotella fottii、具星小环藻(Cyclotella stelligera)和Cymbella laveis仅在枯水期为优势种,Amphora montana、Achnanthes petersenii、Cymbella minuta、变异直链藻(Melosira varians)、短喙舟形藻(Navicula rostellata)和谷皮菱形藻(Nitzschia palea)仅在丰水期为优势种。
2.3 硅藻群落聚类分析
在同等相似水平下,枯水期聚类分析将 19 个样点划分为 3 个硅藻类群(图3),类群 A1 优势种组成包括C.fottii、C.stelligera、A.minutissima和C.laveis等;类群 A2 优势种A.minutissima和Nitzschia valdecostata的丰度较高;类群 A3 优势种为N.cryptocephala、A.montana和A.minutissima等(表2)。丰水期 19 个样点被划分为 2 个硅藻类群(图3),类群 B1 优势种组成主要以N.palea为主;类群 B2 优势种为A.minutissima、A.montana和A.petersenii等(表3)。
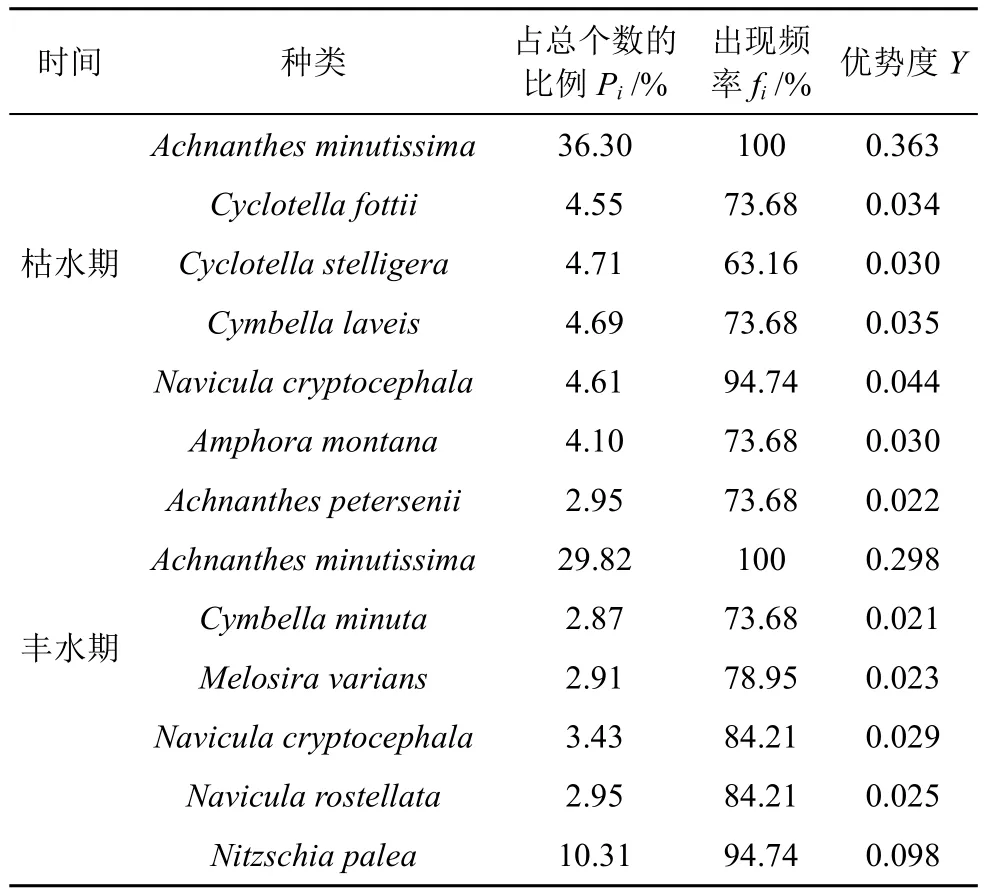
表1 柳江流域硅藻优势种组成Table 1 Composition of dominant species of diatoms in Liujiang River Basin
2.4 水质因子及其主成分分析
枯水期 DO 随着类群 A1、A2、A3 在空间分布上的变化呈现依次降低的趋势,其他水化学指标相反。丰水期 DO 随着类群 B1、B2 的变化呈上升趋势,其他指标则相反(表4)。单因素方差分析结果表明,水质理化指标在枯、丰水期存在显著性差异(P< 0.05),且 DO、CODMn、NH4+-N、Hg、Cd 和Pb 在丰水期的平均值均高于枯水期。主成分分析(PCA)结果表明,选定与两主轴相关系数大于 0.3的因子为主要水质驱动因子,枯水期为 DO、CODMn、As、Hg、Cd 和 Pb;丰水期为 DO、CODMn、NH4+-N、As 和 Cd。
2.5 硅藻群落与水质因子的关系
DCA 显示枯、丰水期的排序轴梯度最大值为2.545 和 2.414,均小于 3.0,表明柳江流域硅藻物种对水质的响应是线性的,故应采用冗余分析(RDA)来分析硅藻群落与水质因子之间的关系。

图3 枯水期(a)和丰水期(b)各样点硅藻群落的聚类分析Figure 3 The cluster analysis of diatom communities in dry season(a) and wet(b) season

表2 枯水期各类群硅藻优势种Table 2 Dominant species of diatoms in various groups in dry season

表3 丰水期各类群硅藻优势种Table 3 Dominant species of diatoms in various groups in wet season

表4 水质理化特征(平均值±标准差)Table 4 Physical and chemical characteristics of water quality(Mean ± SD)
RDA 分析结果显示,枯水期轴 1 与轴 2 的特征值为 0.116 和 0.099,丰水期前两轴的特征值分别为 0.133 和 0.064,结合物种-环境关系的累积百分比,枯、丰水期分别解释了硅藻群落变化的59.7%和 60.3%,说明枯、丰水期的 RDA 排序图都能较好地反映硅藻种类分布与水质因子之间的相关关系。在枯水期,重金属因子 Pb、Cd、Hg、As 和CODMn位于第一轴的右侧,与轴 1 呈正相关,DO位于第三象限,与轴 1 和轴 2 均呈负相关(图4);在丰水期,Cd、As 和 NH4+-N 位于第一轴的右侧,与轴 1 呈正相关,DO 位于第一轴的左侧,则呈负相关,CODMn位于轴 2 的下方,与轴 2 呈负相关(图5)。同时结合水质因子与前 2 轴的相关性分析结果(表5),可以看出枯水期主要水质驱动因子对硅藻群落分布的影响程度依次表现为 Pb>Cd>Hg> As>CODMn>DO,丰水期则表现为 As>DO>CODMn> NH4+-N>Cd。

图4 枯水期硅藻物种与水质因子的RDA排序图Figure 4 RDA ordination diagram of diatom species and water quality factors in dry season

图5 丰水期硅藻物种与水质因子的RDA排序图Figure 5 RDA ordination diagram of diatom species and water quality factors in wet season

表5 RDA前2轴与水质因子之间相关系数Table 5 Correlations between water quality factors and the first two axis of RDA
RDA 排序图表明,硅藻优势种与水质驱动因子的对应关系趋势在不同水文季节表现基本一致。其中,硅藻优势种A.minutissima、C.laveis、Aulacoseira ambigua和C.stelligera等都分布在轴2 的左侧,主要与溶解氧呈正相关,表现出偏好溶解氧高,有机负荷程度低,重金属污染小的水环境;而硅藻A.montana、A.petersenii、N.cryptocephala、M.varians、C.minuta、N.palea和N.rostellata等则分布在轴 2 的右侧,主要与重金属因子、CODMn和 NH4+-N 呈正相关,表明其更喜好有机营养负荷高或重金属含量高的水环境。
3 讨论
3.1 硅藻群落结构特征
本研究中,硅藻群落在枯、丰水期具有明显的空间分布特征,主要可能是受各采样点的水质因子所影响[17],河水的水体理化特征往往因人为活动和降雨等自然因素的驱动而存在不同的时空差异性[8]。在柳江流域中,枯水期有 3 个不同的硅藻类群大致依次分布在该流域干流及支流段的上游、中游以及下游。其中,样点 S1 和 S5 分别位于林地和景观区中,S7、S8 和 S11 样点周边多为裸地,说明上游几个采样点受人为活动影响较小,水质状况良好,硅藻优势种组成的相似性较高;中游大多数采样点(S3、S6、S9、S10 和 S15)主要分散在乡村附近,人口较为密集,养殖、农业和居民生活等活动明显,水体主要受生活污水和农业养殖用水排放的影响,使得流入水体的营养盐等陆源物质类型相似,营养水平上升,对硅藻群落影响较为一致;下游采样点(S16、S18 和 S19)分布在城市附近,工业生产等人为活动频繁,伴随着中上游污染物的积累,导致水体中重金属及有机物等污染物的含量增加,进而使得硅藻群落组成的相似性也较高。 3 个硅藻类群的空间变化体现了采样点周围人为活动方式及强度的不同导致水质的污染来源有所差异[18-19],从而使得水质逐渐变差,具有明显的空间梯度变化。进入丰水期,群落结构演替为 2 个不同的硅藻类群,基本依次呈现在该流域的中下游和上游。丰水期雨量较大,地表径流的增加促使有机物等陆源性物质被冲刷汇入河流,导致各种污染物和离子等浓度的增加[20],同时充沛的水量增强了河流水系之间的连通性,也促进了中下游水体之间的流动,从而缩小了水质在其空间分布上的差异,提高了群落结构的相似性。因此,枯、丰水期硅藻群落结构类群划分的不同体现了地表径流受雨季影响的变化,说明硅藻群落结构及物种组成与水化学变量和水文季节的变化有关[21-22],可能是人为活动和降雨等水文过程可间接改变水体中的各项理化指标,进而造成附生硅藻群落分布的差异性[23-24]。
根据 Van 等[25]的硅藻生态指示划分,C.stelligera、C.laveis和A.ambigua为贫污染性种类,主要出现在溶解氧高,有机污染负荷和营养水平较低的水体中,而A.montana、A.petersenii、N.cryptocephala、M.varians和G.parvulum为 α —中污染性种类,常生活在中营养状况的水体中,能够忍耐较高的有机污染物,与本文的RDA排序结果一致。研究发现,运动性较强的N.palea是富营养化水体和重金属污染水体的常见种[26],在本文中,其主要分布在丰水期柳江流域的下游,偏好于有机营养负荷和重金属含量高的水体。因此,硅藻群落组成的变化体现了这些种类对水质环境变化的适应性。本文硅藻优势种组成的季节演替伴随着由更敏感的物种向更耐污染的物种组成转变(表1),与其他学者[27-28]研究的结论大体相同,反映了该流域丰水期水质的污染程度高于枯水期,这与理化监测结果一致(表4)。但值得注意的是,本文 RDA 排序分析显示A.minutissima偏好于污染较小的水环境,但它在柳江流域各个采样点的出现频率却为 100%,可能是由于该种的分布范围较广,其对水体环境并不敏感,无论在是否受到污染的水体中,它都有可能成为优势种[29]。
3.2 水质因子对硅藻群落的影响
RDA 结果表明,水质因子 Cd、As、DO 和CODMn在枯水期和丰水期都对柳江流域附生硅藻群落分布产生影响,但其影响程度不完全一致。由于不同硅藻物种对水体重金属的敏感程度和耐受能力不同[30],重金属则是影响附生硅藻群落组成的重要因素[31]。在本研究中,枯水期附生硅藻分布受水体重金属的影响程度较大。有研究报道,具星小环藻(C.stelligera)和C.laveis与重金属浓度呈负相关[32],与本文研究结果一致。这一现象说明枯水期硅藻优势种在空间分布上的变化可能是由于其对重金属含量的变化较为敏感。研究发现,丰水期优势种谷皮菱形藻(N.palea)与重金属 As、Cd 浓度之间呈正相关[33],且在柳江流域中,Cd、As 是影响硅藻分布的主要重金属因子,在一定程度上反映了该流域重金属污染可能主要以 Cd、As 污染为主[12]。
溶解氧是衡量水体初级生产力的重要标志,它在柳江流域也是影响附生硅藻的主要水质因子之一,这与其他学者在其他区域的研究结果相似。陈向等[34]研究东江惠州河流段的硅藻群落时,认为溶解氧对群落结构起着重要作用。在本研究中,水体溶解氧含量在丰水期较高,其对硅藻影响较大。究其原因,一方面可能是丰水期水生植物和藻类的生长迅速,在光合作用下释放大量的氧气;另一方面可能是丰水期降雨频繁,水体持续流动增加了空气中氧的溶解效率,良好的氧化环境有利于有机物的矿化和营养盐的再生,从而间接影响硅藻群落结构的特征[35-36]。然而,在柳江流域下游,硅藻物种丰富度较高,但水体中溶解氧含量却下降,可能是由于人为活动频繁,大量污水排放和中上游污染物的积累致使水体中营养水平等上升,从而导致藻类及其他浮游生物的繁殖,消耗大量的氧气,使得水体中溶解氧量下降[37]。
柳江流域硅藻群落在一定程度上也受水体中CODMn的影响,说明其在解释硅藻群落结构的时空变化中起着重要作用。CODMn是衡量水体中有机物含量的指标,其值越大,有机物越多,微生物经氧化分解产生的可被藻类利用的营养盐越多,而相关研究认为营养盐也是影响硅藻生长的重要因子[38]。本文硅藻优势种与水体 CODMn存在一定的响应关系,可能是由于人为活动和地表径流导致水体中CODMn出现浓度梯度的变化,从而影响硅藻群落的分布。从研究结果看,本文所涉及的水质因子在枯、丰水期分别解释了 59.7%和 60.3%的硅藻群落变异,尚有部分变化还未能得到相应的解释。除此之外,其他如水温[35]、透明度[18]及蓝藻、浮游动物的生物作用[39]等也是影响硅藻种群密度和生物量的重要因子。因此,在探讨硅藻群落结构变化的机理时,还需要对其他影响硅藻种群特征的影响因素做进一步的基础生态学研究。
4 结论
(1)柳江流域共鉴定出附生硅藻 137种,隶属于6目9科34属,主要优势藻属以舟形藻属和曲壳藻属为主。其中,硅藻种在枯水期和丰水期的变化不大,种类相似度为 63.68%,而各采样点硅藻丰富度随季节变化明显,表现为丰水期高于枯水期。硅藻优势种组成在不同水期也存在差异,极小曲壳藻和隐头舟形藻为枯、丰水期共有的优势种,而其余优势种发生了更替。
(2)聚类分析显示,柳江流域19个采样点在枯水期可划分为 3个硅藻类群,在丰水期则可划分为 2个硅藻类群,其群落结构类群在空间和时间上划分的不同,可能主要与采样点周围人为活动和地表径流导致水质的空间梯度变化有关。
(3)主成分分析(PCA)和冗余分析(RDA)结果表明,Cd、As、DO 和 CODMn在枯、丰水期都对柳江流域附生硅藻群落分布产生影响,但其影响程度发生变化。其中重金属因子在枯水期对硅藻影响较大,而溶解氧在丰水期对硅藻影响较大。

附表1 硅藻种类及缩写Appendix 1 Diatom species and abbreviation
