奎宁功能化聚乙烯咪唑修饰硅胶亲水相互作用色谱固定相的制备及应用
2020-03-18张樱山邱洪灯
周 行, 陈 佳, 张樱山, 赵 亮, 邱洪灯*
(1.中国科学院兰州化学物理研究所, 中国科学院西北特色植物资源化学重点实验室, 甘肃省天然药物重点实验室, 甘肃 兰州 730000; 2.中国科学院大学, 北京 100049; 3.甘肃省中药现代制药工程研究院有限公司, 甘肃 兰州 730000)
色谱固定相作为色谱分离技术的核心,是推动色谱分离技术发展的基础[1,2]。1990年Alpert[3]创立了亲水相互作用色谱(hydrophilic interaction chromatography, HILIC),在亲水相互作用分离模式下,强极性、强亲水性物质均可分离检测,弥补了反相色谱的不足,使其HILIC得以迅速推广与应用[4]。HILIC流动相由一定盐浓度的水溶液和高比例的有机溶剂组成,固定相是强极性吸附剂,分析物通常是极性化合物,因此填料越亲水、溶剂的极性越强,溶质在柱子上的保留越强;随着水系比例的增加,溶质被逐渐洗脱,从而使待分离物质得以分离[5-7]。近年来,有大量文献报道将极性官能团的有机小分子[8,9]和亲水碳纳米材料[10-12]键合到硅胶表面,在HILIC模式下用于碱基核苷、氨基酸、天然药物等亲水性物质的分离检测。
离子液体(ionic liquids, ILs)是一类由有机阳离子和阴离子组成的非分子物质,常温常压下一般为液态,故也称为室温熔融盐[13]。咪唑类阳离子液体由于其咪唑环上的两个氮原子可以提供反应活性位点用于后修饰,可较容易地获得不同功能化的咪唑阳离子液体[14]。目前关于咪唑类色谱固定相的工作已被广泛报道[15-18]。Zhang等[19,20]在大量研究工作的基础上,综述了在1H-咪唑和聚乙烯咪唑中的N3位通过亲核取代反应进一步对咪唑环修饰的方法,从而为开发不同类型咪唑修饰硅胶色谱固定相提供了广阔的思路。
奎宁,俗称金鸡纳碱,是茜草科植物金鸡纳树及其同属植物树皮中的主要生物碱。奎宁具有苯并吡啶、叔铵正电中心、多个手性位点以及便于修饰的羟基和末端烯烃官能团,适合作为修饰小分子键合于硅胶表面或作为单体聚合成整体材料用于色谱分离分析[21-24]。目前文献[25]报道关于奎宁分子的色谱固定相大多数采用反相以及强阴离子交换模式,其主要利用奎宁分子的苯并吡啶环与待分离物的π-π相互作用和奎宁分子中的叔铵型阳离子结构。本研究将奎宁分子进一步修饰后的固定相应用于HILIC模式,主要考虑两个方面的原因,在HILIC模式下,带有叔胺阳离子结构的奎宁固定相会为离子型分析物的分离提供静电相互作用;(2)奎宁分子中的甲氧基、吡啶环,以及通过异氰酸酯桥联后形成的酰胺和酯键将会显著增加固定相的极性,同时提供丰富的与分析物氢键相互作用的位点,以提高色谱柱在亲水相互作用模式下的分离性能。
本工作将咪唑离子液体和奎宁分子相结合,制备了一种奎宁功能化聚乙烯咪唑修饰硅胶亲水色谱固定相(Sil-PIm-Qn)。首先,通过自由基链转移聚合反应将乙烯基咪唑聚合于硅胶表面,然后将2-氯乙基异氰酸酯修饰后的奎宁接枝于聚乙烯咪唑的N3位,制备得到Sil-PIm-Qn,并进行了亲水色谱分离能力的考察。
1 实验部分
1.1 仪器、试剂与材料
Agilent 1260型高效液相色谱仪-二极管阵列检测器(HPLC-DAD, Agilent公司,美国); Vario ELⅢ型元素分析仪(EA, Elementar公司,德国); IFS 120HR型傅里叶变换红外光谱仪(FT-IR, Bruker公司,德国); Milli-Q型超纯水净化设备(Millipore, Billerica公司,美国); IKA-RV8V型旋转蒸发仪(IKA公司,美国); LSP01-1A型注射泵(保定兰格恒流泵有限公司)。
裸硅胶(bare silica,粒径:5 μm,孔径:9 nm;比表面积:306 m2/g)购于日本Fuji Silysia Chemical公司;3-巯丙基三乙氧基硅烷(纯度>98.0%)购于北京百灵威科技有限公司;偶氮二异丁腈(AIBN,纯度>99.0%)购于日本Nacalai Tesque Inc公司,使用之前经过重结晶纯化;乙醇(纯度>99.7%)购于山西同杰化学试剂有限公司;二氯甲烷(纯度>99.5%)购于天津利安博华医药化学有限公司;碱基核苷类、磺胺类、氨基酸类等测试标准品,以及奎宁(quinine,纯度>97.0%)、2-氯乙基异氰酸酯(2-chloroethyl isocyanate,纯度>97.0%)、乙烯基咪唑(1-vinylimidazole,纯度>97.0%)、乙腈(ACN,色谱纯)、乙酸铵(ammonium acetate,色谱纯)、甲醇(MeOH,色谱纯)均购于上海阿拉丁生化科技股份有限公司;超纯水在实验室用Milli-Q超纯水净化设备纯化后获得;氯化胆碱(ChCl,纯度>99.0%)和乙二醇(EG,纯度>99.5%)购于美国Sigma-Aldrich公司。
1.2 实验方法
1.2.1低共熔溶剂(DES)的制备
将ChCl和EG按照1∶3的物质的量之比加入圆底烧瓶中,并将其置于60 ℃油浴中以300 r/min的转速磁力搅拌至澄清透明溶液,得到本实验所需的低共熔溶剂。
1.2.2巯丙基修饰硅胶(Sil-MPS)的制备
称取6.0 g硅胶超声分散,置于装有50 mL DES的三口圆底烧瓶中,并用流动注射泵将2.9 mL 3-巯丙基三乙氧基硅烷逐滴加入到三口烧瓶中,然后将三口烧瓶置于60 ℃油浴中以250 r/min机械搅拌24 h;待反应冷却至室温后,产物依次用乙醇、超纯水、乙醇各洗涤3次,将最后得到的Sil-MPS置于60 ℃烘箱中干燥。
1.2.3聚乙烯咪唑修饰硅胶(Sil-PIm)的制备
采用表面自由基链转移聚合反应,将3.0 g巯丙基硅胶超声分散于装有30 mL DES的三口圆底烧瓶中,先加入0.02 g AIBN,再将2.0 mL乙烯基咪唑在机械搅拌下逐滴加入到三口圆底烧瓶中,在氮气保护下于60 ℃油浴中聚合反应20 h;待反应冷却至室温后,产物依次用乙醇、超纯水、乙醇各离心洗涤3次,置于60 ℃烘箱中干燥,得到Sil-PIm。
1.2.4Sil-PIm-Qn的制备
首先将2.3 g奎宁溶解于装有50 mL无水二氯甲烷(分子筛除水)的三口烧瓶中,并将其置于冰水浴中;将0.6 mL 2-氯乙基异氰酸酯加至10 mL无水二氯甲烷中,通过流动注射泵将其逐滴加至奎宁溶液,并将混合溶液置于室温下反应16 h,待反应结束后,用旋转蒸发仪浓缩,获得2-氯乙基异氰酸酯修饰的奎宁(2-chloroethyl isocyanate-modified quinine, Ci-Qn),然后将其溶解于50 mL乙醇中,并在超声辅助下加入2.8 g Sil-PIm,在氮气保护下于85 ℃回流反应48 h。反应结束后,产物依次用乙醇、超纯水、乙醇各离心洗涤3次,置于60 ℃烘箱中干燥。最终得到Sil-PIm-Qn。图1为制备过程示意图。

图1 Sil-PIm-Qn的制备示意图
1.2.5色谱填料装柱
采用匀浆液填充法,将2.1 g Sil-PIm-Qn超声分散于22 mL四氯化碳溶液中直至其形成匀浆液;正己烷作为顶替液,在45 MPa下将匀浆液装填入不锈钢色谱柱(150 mm×4.6 mm)中。
1.2.6色谱条件
采用Agilent 1260型高效液相色谱仪-蒸发光散射检测器或二极管阵列检测器分析,其中蒸发光散射检测器的气体流量和温度分别为1.5 L/min和60 ℃,二极管阵列检测器的检测波长为254 nm;色谱柱为Sil-PIm-Qn;柱温为30 ℃;流速为1 mL/min;进样体积为10 μL。
分离氨基酸:流动相为乙腈-0.10 mol/L乙酸铵水溶液(85∶15, v/v);等度洗脱。分离磺胺类药物:流动相为(A)乙腈和(B)0.02 mol/L乙酸铵水溶液;梯度洗脱条件为0~12 min, 95%A; 12~30 min, 87%A。分离碱基核苷:流动相为(A)乙腈和(B)0.10 mol/L乙酸铵水溶液;梯度洗脱条件为0~10 min, 93%A; 10~13 min, 93%A~83%A; 13~30 min, 83%A。
2 结果与讨论
2.1 Sil-PIm-Qn色谱固定相的表征
2.1.1元素分析
采用Vario ELⅢ型元素分析仪分别对球形多孔硅胶、Sil-MPS、Sil-PIm和Sil-PIm-Qn中的C、N、H元素含量进行测定(见表1)。结果表明,Sil-MPS中C和H元素的含量分别增加至4.01%和0.71%,证实了3-巯丙基三乙氧基硅烷成功键合于裸硅胶表面。Sil-PIm元素分析结果显示,由于乙烯基咪唑中含有N和C原子,使得其N、C含量分别达到2.62%和8.70%,证实了乙烯基咪唑通过自由基链转移聚合反应成功聚合在Sil-MPS上。在Sil-PIm-Qn中,N、C、H元素的含量分别为3.20%、11.18%和1.44%,相较于Sil-PIm有所增加,证实了Sil-PIm-Qn色谱固定相的成功制备。
表1 裸硅胶、Sil-MPS、Sil-PIm和Sil-PIm-Qn的元素分析结果

Table 1 Elemental analysis results of bare silica, Sil-MPS, Sil-PIm and Sil-PIm-Qn

图2 Sil-MPS、Sil-PIm和Sil-PIm-Qn的红外光谱图
2.1.2红外光谱分析
为了进一步验证Sil-PIm-Qn色谱固定相的成功制备,对其进行了红外光谱表征,结果见图2。在所有谱图中,在1 110 cm-1处的吸收峰为硅胶上Si-O键的弯曲振动峰;3 425 cm-1处的吸收峰为硅胶表面残留的硅羟基O-H键的伸缩振动峰。在Sil-MPS谱图中,当硅胶被3-巯丙基三乙氧基硅烷修饰后,2 980 cm-1和2 930 cm-1处的2个吸收峰为Sil-MPS巯丙基中亚甲基的伸缩振动峰,表明3-巯丙基三乙氧基硅烷成功修饰于裸硅胶表面。另外,在Sil-PIm谱图中,在1 440 cm-1和660 cm-1处出现了两个新的吸收峰,它们为乙烯基咪唑中C=C和C=N的伸缩振动峰和弯曲振动峰,进一步证实了乙烯基咪唑通过自由基链转移聚合反应修饰在了巯丙基硅胶上。在Sil-PIm-Qn谱图中,1 580 cm-1和1 500 cm-1处的2个峰为奎宁分子中苯并吡啶骨架C=C伸缩振动峰,同时证明了奎宁分子成功通过亲核取代反应接枝于聚乙烯咪唑硅胶上。
2.1.3Ci-Qn的核磁共振氢谱分析
异氰酸酯与醇羟基的反应十分剧烈,且等物质的量的比例趋近于完全反应。虽然本实验常温反应16 h后,体系中还残留有未反应的少量奎宁和2-氯乙基异氰酸酯,但在旋转蒸发干燥溶剂时可以将少量未反应的2-氯乙基异氰酸酯除去,而少量未反应的奎宁并不会和聚乙烯咪唑修饰硅胶反应。因此实验并没有对合成的2-氯乙基异氰酸酯修饰的奎宁作进一步纯化,直接旋蒸干燥后使用。实验通过过柱获得少量纯化的Ci-Qn,并对其进行核磁共振氢谱分析,其实验结果如图3所示,其中化学位移8.02 ppm(10-6)对应2-氯乙基异氰酸酯修饰的奎宁中-NH-的氢核;化学位移3.52 ppm和3.34 ppm分别对应Ci-Qn中的两个亚甲基-CH2-的氢核。因此可以证实合成的产物为Ci-Qn。

图3 Ci-Qn的核磁共振氢谱图
2.2 Sil-PIm-Qn对氨基酸的分离
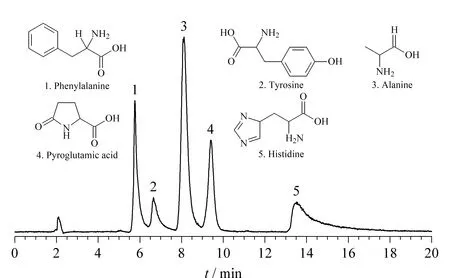
图4 5种氨基酸在Sil-PIm-Qn柱上的色谱图
首先,通过对苯丙氨酸、酪氨酸、丙氨酸、焦谷氨酸和组氨酸5种氨基酸进行分析,以评价Sil-PIm-Qn的分离性能。5种氨基酸在Sil-PIm-Qn上的色谱分离结果见图4,说明该色谱固定相能实现对5种氨基酸的分离检测。
2.3 Sil-PIm-Qn对磺胺类药物的分离
本实验通过对磺胺、磺胺吡啶、磺胺二甲基嘧啶、磺胺甲基嘧啶、周效磺胺、磺胺嘧啶、磺胺二甲氧基嘧啶、磺胺噻唑和磺胺异噁唑9种磺胺类药物进行分析来评价Sil-PIm-Qn在亲水相互作用模式下的分离性能。9种磺胺类药物在Sil-PIm-Qn上的分离情况见图5a,可以看出,25 min内成功实现9种磺胺类药物的分离检测。

图5 9种磺胺类药物在(a)Sil-PIm-Qn柱和 (b) Sil-PIm柱上的色谱图
首先,磺胺的保留时间(tR)最短,是因为其分子结构中没有吡啶、嘧啶等带有杂原子的芳香环,使其与Sil-PIm-Qn中奎宁分子的π-π相互作用减弱,导致其最先出峰;其次,磺胺二甲基嘧啶、磺胺甲基嘧啶和磺胺嘧啶的tR递增,是因为它们嘧啶结构中甲基数目不同导致极性依次增强,因此亲水作用色谱模式下的保留时间逐渐增加;磺胺、磺胺吡啶和磺胺嘧啶的保留时间逐渐增加的原因可能是因为其芳香环中氮原子的数目逐渐增加,Sil-PIm-Qn表面含有丰富的聚合咪唑鎓离子、奎宁中的三级胺以及酯基、酰胺等官能团,流动相中乙酸铵水溶液会在Sil-PIm-Qn表面形成很薄的富水层,待分离物质会在固定相表面的富水层和流动相之间产生亲水分配作用[26],因而随着芳香环中氮原子数目逐渐递增,其与固定相相互作用也逐渐增加,从而使保留时间延长;磺胺噻唑和磺胺异噁唑,保留时间相对于其他7种化合物较长,其可能的原因是其分别含有两个S/N、O/N杂原子的特殊五元环,增强了其与固定相的相互作用,从而延长了保留时间。
为了证实奎宁分子的引入增加了该固定相的分离能力,进一步选用Sil-PIm固定相为对比色谱柱,9种磺胺类药物在Sil-PIm固定相上的分离情况见图5b。可以看出,各磺胺类药物的保留时间明显缩短,且9种磺胺类药物不能得到基线分离,其原因是Sil-PIm固定相中缺乏奎宁的芳香苯并吡啶环与磺胺的苯环的π-π相互作用。因此本实验制备的Sil-PIm-Qn在磺胺类药物的分离分析中有广泛的应用前景。
2.4 Sil-PIm-Qn对碱基核苷的分离
实验还通过对胸腺嘧啶、胸苷、尿嘧啶核苷、腺嘌呤核苷、腺嘌呤、胞嘧啶、肌苷、胞嘧啶核苷、鸟嘌呤核苷和黄嘌呤核苷等10种碱基核苷的分析进一步评价制备得到的Sil-PIm-Qn在亲水作用模式下的分离性能。10种碱基核苷在Sil-PIm-Qn上的分离情况如图6所示,可以看出,在27 min内成功实现了10种碱基核苷的分离检测。
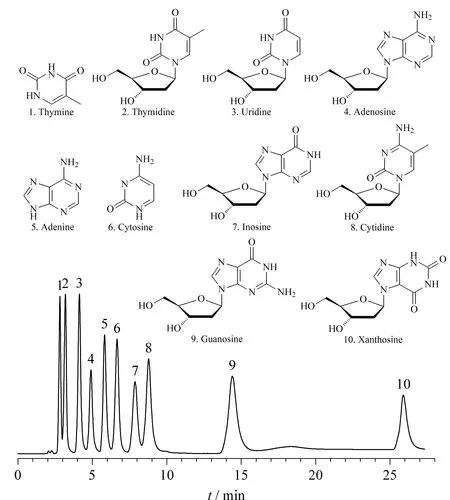
图6 10种碱基核苷在Sil-PIm-Qn柱上的色谱图
2.5 Sil-PIm-Qn亲水相互作用模式考察
亲水作用模式下,色谱固定相对分离物质的保留行为及选择性不仅与色谱固定相的种类有关,还与流动相组成、流动相中缓冲盐浓度等有着密切关系,选择最优的流动相对物质的分离检测至关重要。因此本实验继续选择碱基核苷为待分离对象,系统考察流动相中乙腈含量和乙酸铵浓度对待分离物保留行为的影响。
首先,通过改变流动相中有机相乙腈的体积分数来考察该色谱柱在亲水相互作用模式下,乙腈体积分数的变化对待分离物质保留行的影响,结果见图7。从图中可以看出,随着乙腈体积分数的递增,待分离物质在固定相上的保留逐渐增强,证实Sil-PIm-Qn具有典型亲水相互作用模式的色谱分离性能。使用Sil-PIm-Qn时,可以通过合理调节有机溶剂的含量来改变不同待分离物质的保留行为,从而提高各分离物质间的分离度。
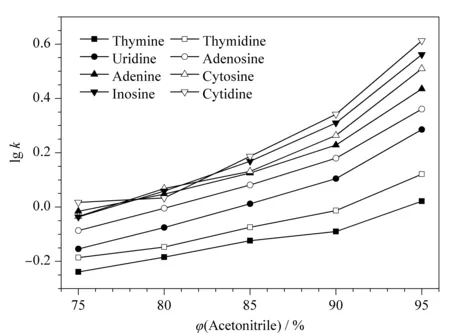
图7 8种碱基核苷在Sil-PIm-Qn上的lg k值与流动相中乙腈体积分数的关系图

图8 8种碱基和核苷在Sil-PIm-Qn上的lg k值与流动相水相中乙酸铵浓度的关系图
其次,在保持流动相中乙腈和乙酸铵水溶液体积比为95∶5的前提下,进一步考察水相中乙酸铵浓度对待分离物质保留行为的影响。结果如图8所示,待分离物质在固定相上的保留能力随乙酸铵浓度的递增有不同程度的增加,其原因是流动相水相中乙酸铵浓度越高,在固定相表面形成的亲水层越厚,使得待分离物质与固定相的相互作用增强,导致保留时间的延长。但是乙酸铵浓度过高,可能导致其在有机相中析出堵塞管路和色谱柱,因此选择合适的乙酸铵浓度至关重要。
2.6 Sil-PIm-Qn的重复性考察
对8种碱基核苷连续进样10次,考察Sil-PIm-Qn的重复性。结果表明,8种碱基核苷在Sil-PIm-Qn色谱柱中保留时间的RSD为0.8%~2.3%(n=10),证实其具有较好的分离重复性。
2.7 Sil-PIm-Qn柱效测试
本研究选取磺胺、磺胺吡啶、磺胺二甲基嘧啶、磺胺甲基嘧啶、周效磺胺、磺胺嘧啶、磺胺二甲氧基嘧啶和磺胺噻唑8种磺胺类药物作为待测物对色谱柱的柱效和峰形进行了考察。8种磺胺类药物在Sil-PIm-Qn固定相上的理论塔板数约30 000块/m;拖尾因子(T)为1.06~1.28,虽然通过拖尾因子判断,8种磺胺在该固定相上均出现轻微拖尾(对称峰的T为0.95~1.05),查阅相关文献[27]推测该现象是因为磺胺类化合物在该流动相中少部分以离子形式存在,会和硅胶表面残留的硅羟基产生强静电相互作用,该原因引起的拖尾是一种“动力学拖尾”,商品柱常常采用硅羟基封端技术消除该现象,而氨基酸电离程度往往很大,这种“动力学拖尾”现象更加明显。
3 结论
本研究采用表面自由基链转移聚合反应和亲核取代反应制备得到奎宁功能化聚乙烯咪唑修饰硅胶亲水色谱固定相,并对其色谱分离性能进行了评价。该固定相对亲水性物质有优异的分离选择性及良好的分离重复性,在磺胺类药物、生物样品中碱基核苷等亲水性物质的分离分析中有广阔的应用前景。
