过氧化物酶体增殖物激活受体δ下调载脂蛋白F在肝细胞中的表达
2020-03-18沈雪彬徐尚华林小端
沈雪彬, 徐尚华, 林小端
近年来,随着我国居民生活水平的提高及生活方式的转变,冠状动脉粥样硬化性心脏病(冠心病)和脑血管疾病等疾病已成为我国一大医疗负担[1]。迄今为止,冠心病的发病机制尚未完全阐明。如何防治动脉粥样硬化成为研究难题[2]。过氧化物酶体增殖剂激活受体δ(peroxisome proliferator activated receptorδ,PPARδ)是核激素受体家族中的配体激活受体,在糖和脂质代谢中扮演重要角色。PPAR通过与视黄醇类X受体形成二聚体,结合上游启动子区或编码区内的DNA应答元件(peroxisome proliferator response element,PPRE),调控靶基因的转录[3],对代谢综合征相关致病基因有潜在的调控作用[4]。载脂蛋白F(apolipoprotein F,ApoF)能选择性抑制血浆胆固醇酯转移蛋白(cholesterole stertransferprotein,CETP)的活性,其代谢异常与胆固醇逆向转运、高脂血症、动脉粥样硬化等关系密切[5-6]。本研究拟通过构建全长ApoF启动子,观察PPARδ激动剂对ApoF启动子、mRNA及蛋白表达水平的影响,为心脑血管疾病的防治提供新的潜在靶点。
1 材料与方法
1.1材料及试剂 HepG2人肝癌细胞株由福建医科大学消化道恶性肿瘤教育部重点实验室提供。限制性内切酶和T4 DNA连接酶(美国NEB公司);PPARδ激动剂GW0742(美国Sigma公司);鱼精DNA、高保真Taq DNA聚合酶(美国Invitrogen公司);胰酶、DMEM培养基、胎牛血清(美国Gibco公司);细胞基因组DNA抽提试剂盒DNeasy Tissue Kit(美国Qiagen公司);质粒小量抽提试剂盒(上海超世生物科技有限公司),质粒大量抽提试剂盒(美国Qiagen公司);逆转录试剂盒、Realtime PCR试剂盒(日本TaKaRa公司);TRIzol(美国Invitrogen公司);ApoF特异性抗体(美国Pierce公司);PPARδ抗体(美国Abcam公司);内参β-actin抗体(美国Santa Cruz公司);荧光素酶检测试剂盒(美国Promega公司);Realtime PCR及克隆构建所需的引物及重组载体的测序(中国博尚生物技术有限公司)。
1.2方法
1.2.1Realtime PCR定量检测ApoF mRNA水平 细胞加入不同浓度PPAR激动剂GW0742干预细胞后,使用TRIzol提取总RNA,逆转录为cDNA。内参GAPDH,ApoF及PPARδ的引物序列见表1,其中GAPDH及ApoF引物序列由福建医科大学消化道恶性肿瘤教育部重点实验室提供,PPARδ引物序列参考文献[7]。

表1 内参GAPDH,ApoF,PPARδ的引物序列
反应体系为:PCR正向引物 0.4 μL;PCR反向引物0.4 μL;SYBR Premix Ex Taq (2×) 10 μL;ROX Reference DyeⅡ(50×)0.4 μL;DNA模板2.0 μL;ddH2O 6.8 μL;总体积20 μL。反应条件:95 ℃ 3 min→95 ℃ 15 s→60 ℃ 30 s,40个循环。
1.2.2Western-blot检测PPARδ和ApoF蛋白表达 用预冷的PBS洗涤各组HepG2细胞3次,使用细胞裂解缓冲液于冰上裂解细胞5 min,收集至离心管中,经超声破碎后,加入上样缓冲液电泳、转膜、封闭,使用洗膜液洗涤2~3遍;加入一抗孵育20~30 min,继续洗涤2~3遍,加入二抗,将PVDF膜放置暗盒中曝光,使用扫描仪扫描并分析图片。
1.2.3ApoF启动子重组载体构建 从NCBI获取ApoF启动子全长序列,按照DNeasy Tissue Kit试剂盒说明提取HepG2细胞基因组DNA,使用高保真Taq DNA聚合酶扩增ApoF上游约2 000 bp的序列(ApoF的基因转录起始位点定为+1),所获得的PCR条带经测序公司测序并通过DNAMAN比对无误。引物序列为:
正向:5′GGGGTACCCCCAACCTGAGCACTGCT3′
反向:5′CCGCTCGAGCCAAATTACCACACAGTCCAGTCATT3′
DNA回收试剂盒回收PCR扩增片段,电泳图显示条带位置正确(图2)。经上海博尚生物技术有限公司测序无误。构建ApoF的启动子全长命名为pGL3B-ApoF。
1.2.4双荧光报告素酶基因检测 HepG2细胞转染pGL3B-ApoF 48 h后,用细胞洗涤液洗涤已转染pGL3B-ApoF基因的HepG2细胞,并吸净残留的洗涤液,加入裂解液裂解细胞10 min,并收集含pGL3B-ApoF及pGL3B的细胞裂解液置于干净的EP管,离心取上清液至另一干净的EP管。采用冷光仪(Orion Ⅱ Microplate Luminometer, Berthold Detection Systems)检测荧光信号。pGL3B-ApoF组及阴性对照组所得荧光素酶活性值均除以各组的pRL-SV40荧光素酶活性值,以平衡各组的转染效率,获得相应的荧光素酶校正值。结果以相对的荧光素酶活性值表示。每次转染均做3个复孔,每次实验至少重复3次。
1.3统计学处理 采用SPSS 13.0软件处理,采用方差分析比较GW0742干预后不同组间的荧光活性值及mRNA水平差别。P<0.05为差别有统计学意义。
2 结 果
2.1PPARδ激动剂干预HepG2细胞对ApoF mRNA及蛋白表达水平的影响 HepG2细胞经不同浓度GW0742(0.1,1,10,25 μmol/L)及不同时间(24,48,72 h)处理后提取细胞RNA,Realtime PCR检测PPARδ和ApoF的mRNA表达水平,以10 μmol/L的GW0742干预细胞24 h后,Western-blot检测干预后的ApoF蛋白水平表达变化,其结果提示PPARδ被其激动剂GW0742激活后,ApoF mRNA和蛋白表达水平明显下降(P<0.05,图1)。
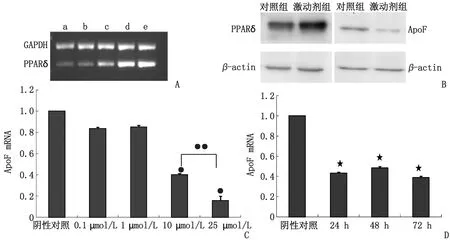
A:不同浓度的GW0742对PPARδ mRNA表达水平的影响(a~e:对照组及0.1,1,10,25 μmol/L的GW0742浓度下对PPARδ mRNA表达水平的影响); B:10 μmol/L GW0742条件下PPARδ及ApoF蛋白表达水平的影响; C:不同浓度GW0742条件下ApoF mRNA的水平(与阴性对照组、0.1 μmol/L及 1 μmol/L组比较,●:P<0.05;与10 μmol/L组比较,●●:P<0.05); D:同一浓度不同时间GW0742条件下ApoF mRNA的水平(与阴性对照组比较,★:P<0.05).图1 PPARδ激动剂对ApoF mRNA及蛋白表达水平的影响Fig.1 PPARδ agonists affect the expression of Apolipoprotein F mRNA and protein
2.2ApoF启动子全长基因构建 通过NCBI获取ApoF距离转录起始点上游约2 000 bp的启动子序列,抽提HepG2基因组DNA,克隆ApoF基因启动子全长,经过KpnI和XhoI双酶切鉴定及DNA测序,序列比对正确无误,电泳图显示扩增产物位置正确(图2)。
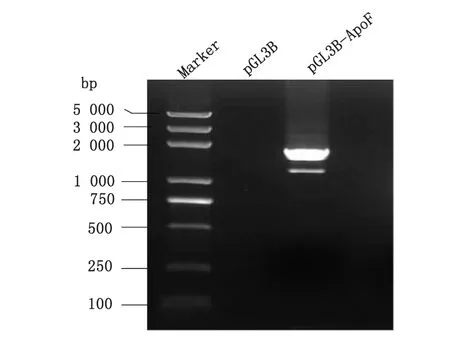
图2 载脂蛋白F启动子PCR扩增产物Fig.2 PCR products of Apolipoprotein F promoter
2.3PPAR激动剂对ApoF启动子活性的影响 ApoF启动子的双荧光报告基因重组载体与内参表达载体pRL-SV40共转染HepG2细胞,并使用10 μmol/L的GW0742干预细胞24 h后检测荧光素值。ApoF启动子全长pGL3B-ApoF荧光素酶的荧光值设为1,对比干预之后荧光素值的变化,其结果显示随着GW0742浓度升高,pGL3B-ApoF荧光素酶的活性明显下降。当其浓度超过10 μmol/L时,差别有统计学意义(P<0.05,图3)。

与对照组比较,★:P<0.05.图3 载脂蛋白F启动子双荧光报告素酶基因相对活性的变化Fig.3 The changes of the relative activity of the double fluorescent reporter enzyme gene of Apolipoprotein F promoter
3 讨 论
文献报道,PPARδ可以通过结合靶基因的启动子进一步促进或抑制靶基因的表达[8]。笔者课题组前期研究发现,ApoF的核心转录调控区在启动子上游1 618 bp范围内,并进一步通过凝胶电泳迁移率及染色质免疫共沉淀等实验验证了其受ETS-1/2和CEPα转录因子调控[9]。近期有研究提示,抑制ApoF的表达水平与非酒精性脂肪肝病的发生、发展有关[10]。PPAR能调控ApoM和其他脂代谢通路相关基因的表达,并扮演重要角色[11-12]。PPAR是否对ApoF产生影响尚不清楚。
本研究通过不同浓度的PPAR激动剂GW0742干预肝细胞,检测ApoF的mRNA水平,结果提示PPARδ可以显著降低肝细胞中ApoF的mRNA和蛋白表达水平。笔者进一步构建ApoF的全长启动子,采用双荧光素酶报告基因检测ApoF启动子活性的变化,结果显示启动子活性显著降低,其结果与mRNA及蛋白表达水平的变化一致;此外,通过TFsearch及NUBIScan等转录因子预测网站预测ApoF上游启动子区潜在的核受体结合位点,提示在上游启动子区+43及+966存在高度匹配的结合位点,故PPARδ有可能通过竞争性地结合上游核受体结合位点,从而抑制ApoF的启动子活性及表达。笔者推测,PPARδ可能通过调控ApoF的表达,进而在非酒精性脂肪性肝病中扮演重要角色,其结果可为更有效预防和治疗代谢综合征等相关疾病提供有益借鉴。
