柳厚壁叶蜂幼虫生长发育与虫瘿增长的相关性
2020-03-16祁靖宇薛琪琪柳春雨张倩闫晓璐门丽娜张志伟
祁靖宇, 薛琪琪, 柳春雨, 张倩,闫晓璐, 门丽娜,2*, 张志伟,2*
(1.山西农业大学林学院, 山西 太谷 030801; 2.山西省林业危险性有害生物检验鉴定中心, 山西 太谷 030801)
垂柳(Salixbabylonica)隶属杨柳科(Salicaceae)柳属(Salix),是一种落叶乔木,是我国常见树种之一[1]。因其扦插成功率高,适应能力强,生长速度快,覆盖面广,且树姿优美极具观赏价值,常被用于园林绿化、通道绿化、护堤抗洪、速生用材等方面,在西部的生态环境建设及植被恢复过程发挥重要作用[2-3]。然而近年来,柳厚壁叶蜂(Pontaniadolichura)的发生逐年加重,在垂柳叶片上形成虫瘿抑制其光合作用,减缓垂柳的生长发育,并严重影响垂柳景观绿化效果。
柳厚壁叶蜂又称柳瘿叶蜂,属于膜翅目(Hymenoptera),叶蜂科(Tenthredinidae),瘿叶蜂属(Pontania),该虫1年发生1代,主要分布在我国的中北部地区[4],潜食垂柳叶片,被取食部位逐渐隆起形成虫瘿[5-6]。随着瘿内幼虫的生长,取食量增加,虫瘿逐渐增厚变大[7],受害树枝不堪重负下垂变黄甚至脱落[8-9],严重时,虫瘿聚连成串,受害叶片叶绿素含量显著降低,严重影响光合作用,削弱垂柳的长势,对垂柳的景观绿化效果产生较大影响[10-12]。
由于柳厚壁叶蜂在整个为害时期都居于完全封闭的虫瘿内获取寄主营养,不易观察和研究,生长发育阶段不易判断,最佳防治时期也难以把握[13]。目前国内对虫瘿的研究主要集中于其形态结构及致瘿昆虫类型[14-15],而致瘿昆虫生长发育和成瘿机制尚不清楚。有研究推测,植物叶片受到致瘿昆虫分泌的唾液酶刺激而形成虫瘿[16-17];也有研究认为,致瘿昆虫产卵时释放的雌性激素及一些无机物可以刺激瘿组织的产生[18-19]。Parr[20-21]和Plumb[22]应用致瘿昆虫的抽提混合物成功诱导产生虫瘿,然而把混合物中的某些物质单一注入寄主植物体内,均无法诱导生成虫瘿[23]。综合来看,虫瘿系统学研究及多数学者皆认为虫瘿的形成与昆虫行为有较大关系[24],虫瘿的形态是致瘿者为害的外在表现。为了进一步研究柳厚壁叶蜂幼虫的生活习性,掌握其发生发育规律,本研究通过系统分析幼虫形态与虫瘿形态的相关性,建立应用虫瘿的外部形态来科学预测其内部柳厚壁叶蜂幼虫的生长发育状态的线性模型,能够为研究取样和柳厚壁叶蜂最佳防治时期的选择提供本底资料,为致瘿昆虫诱导成瘿机制的研究提供科学依据。
1 材料和方法
1.1 试验材料
选择山西农业大学校园内带虫瘿较多且虫瘿分布均匀的垂柳叶片上的虫瘿为研究对象。研究地点位于E 112°34′、N 57°25′,海拔约790 m。位于黄土高原东翼,属于温带大陆性季风气候,全年平均气温10 ℃,年均降水量为450 mm,年蒸发量约为1 740.5 mm[25]。
1.2 研究方法
由于柳厚壁叶蜂幼虫生长在虫瘿内部,难以直接观察,根据每个虫瘿内部有一头幼虫的特点,从2018年4月20日垂柳叶片刚刚发育开始,采用随机取样法,每3 d取样一次,直至2018年10月30日柳厚壁叶蜂的老熟幼虫脱瘿、入土结茧越冬为止,共取样55次。随机剪取10片带有虫瘿的新鲜垂柳叶片,于室内进行显微测量。在Zeiss Stemi 2000-C体视镜(卡尔蔡司,德国)下观察并去除已经开缝的虫瘿,保留完整的虫瘿,记录虫瘿在叶片上的位置,然后用体视镜测量虫瘿长(gall length,GL)、虫瘿宽(gall width,GW)和虫瘿厚(gall thickness,GT);用单面刀片沿虫瘿长轴的侧面小心解剖虫瘿,测量虫瘿壁厚(wall thickness,WT),以及虫瘿内的幼虫体长(larva length,LL)、幼虫体宽(larva width,LW)、幼虫头长(head length,HL)和幼虫头宽(head width,HW)。
1.3 柳厚壁叶蜂不同形态指标的主成分、DCA及回归分析
为了探寻不同调查时期柳厚壁叶蜂生长发育过程最具代表性的虫瘿和幼虫形态特征,按照剔除最小特征值主成分中对应的最大特征向量的变量原则[26],对55个采集日期的柳厚壁叶蜂虫瘿长、虫瘿宽、虫瘿厚、虫瘿壁厚及幼虫的体长、体宽、头长、头宽共8个形态特征指标进行主成分分析(principal component analysis,PCA),根据每个形态特征指标的标准化值及特征根、特征向量计算出各主成分值。因为主成分分析结果中各指标之间差异较小,为了显示不同类型形态指标间的差异显著度,将主成分进行方差最大化旋转分析。
去除趋势对应分析(detrended correspondence analysis,DCA)侧重物种自身特征量的分布,只需一个矩阵即可[27-28]。将8个形态特征指标的55个调查时期数据,建立8×55数据矩阵,导入软件Canoco 5.0[29-30]完成DCA排序。
对4个虫瘿形态指标之间、4个幼虫形态指标之间以及虫瘿与幼虫形态指标之间分别进行一元线性回归分析。
1.4 数据统计与分析
采用Microsoft Excel 2019软件记录并整理测量数据,运用Canoco 5.0软件进行主成分分析和DCA分析,用Sigmaplot 12.5软件(Systat Software, Inc., San Jose California, USA)进行线性回归分析。
2 结果与分析
2.1 柳厚壁叶蜂虫瘿及幼虫形态特征的主成分分析
柳厚壁叶蜂虫瘿及幼虫形态特征的主成分分析结果(表1)显示,前2个主成分的累计贡献率分别达到88.13%、98.06%,即前2个主成分可以代表检测指标的大部分信息,因此对前2个主成分进行进一步分析。

表1 主成分分析的特征值及贡献率Table 1 Eigenvalues and contribution rates of principal component analysis
成分载荷矩阵反映各形态指标在主成分中的作用方向及大小程度。8个形态指标的主成分载荷矩阵见表2,可以看出,主成分1中,虫瘿及幼虫的8个指标的载荷系数均较高;主成分2中,这8个变量的载荷系数均较低。其中虫瘿的4个形态指标在第1和第2主成分中均起负向作用。对两个主成分进行旋转后,第1主成分中虫瘿4个形态指标的载荷系数均较高,而幼虫4个形态指标的载荷系数均较低。因此,第1主成分主要体现虫瘿的形态指标;第2主成分中幼虫4个形态指标的载荷系数均较高,而虫瘿的形态指标载荷系数均较低,表明第2主成分主要代表幼虫的形态指标。其中虫瘿壁厚对第1主成分的贡献率最高,载荷系数为0.897,幼虫体宽对第2主成分的贡献率最高,载荷系数为0.907。
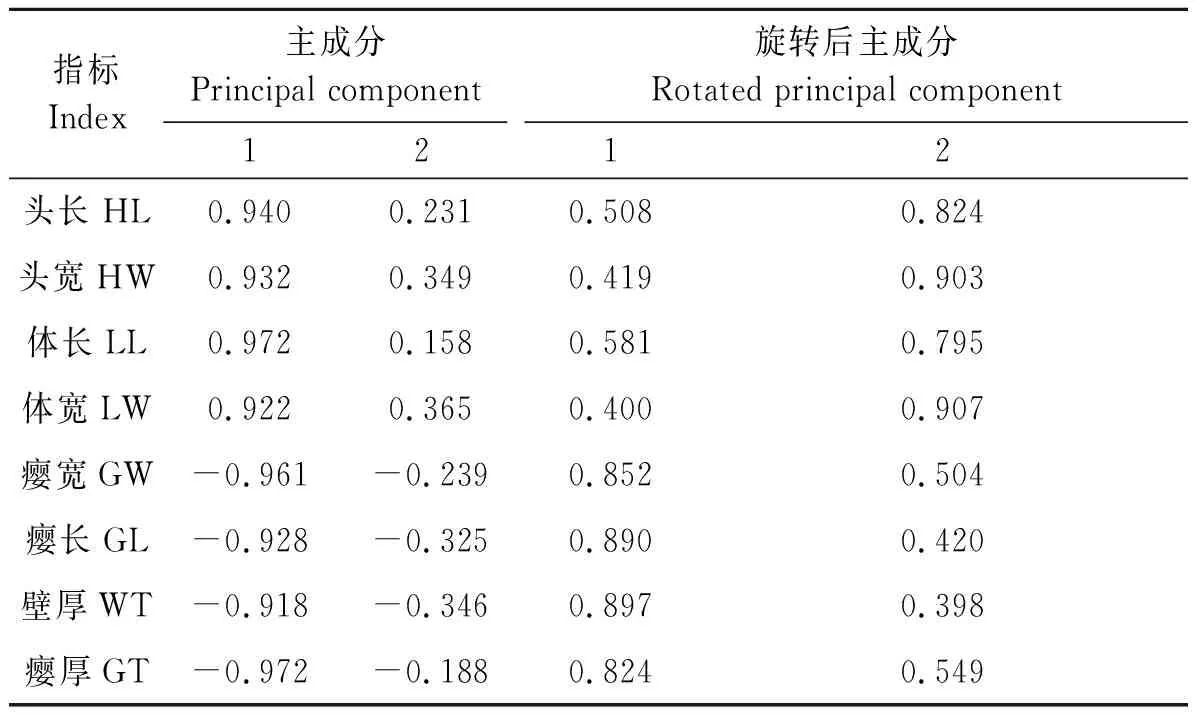
表2 主成分分析的载荷矩阵Table 2 Load matrix of principal component analysis
主成分分析的得分和载荷见图1。其中的点代表不同发育时期8个形态指标综合参数得分值,箭头分别表示8个形态特征,箭头所处的象限表示该形态特征与对应主成分相关性的正负值[31]。可见,不同发育时期的形态学综合指标的得分值初步聚为三类,分布于4个象限中,说明不同调查时期柳厚壁叶蜂的生长发育规律差异明显。调查日期4月20日和4月23日距离虫瘿及幼虫的8个形态学指标均较远,表明该时期柳厚壁叶蜂虫瘿及幼虫的生长发育变化幅度较小。6—9月检测点的得分值主要密集出现于第3象限,与虫瘿的长、宽、厚、壁厚均呈正相关,说明这个时期虫瘿的生长发育形态变化占主导地位,且在此期间,各形态指标集中分布于坐标轴中心附近,说明这个时期虫瘿和幼虫的综合形态学指标之间的相关性较强。10月检测点的得分值处于第2象限,与幼虫的体长、体宽、头长、头宽呈正相关,说明10月幼虫的生长发育形态变化占主导地位。幼虫的体长、体宽、头长和头宽均聚集于第2象限,表明幼虫的形态指标与主成分1呈负相关,与主成分2呈正相关;虫瘿的长、宽、厚以及壁厚均聚集于第3象限,表明虫瘿的形态指标与主成分1和2均呈负相关。也可看出,幼虫形态指标之间与虫瘿形态指标之间均表现为自相关。不同来源的形态指标之间,虫瘿厚与幼虫体长的矢量夹角最小,说明二者相关性最强[32]。连线的长短表示该形态特征所能代表的形态指标的贡献率大小。柳厚壁叶蜂幼虫头长的连线最短,说明幼虫的头长指标对幼虫整体生长发育的贡献率最小;而虫瘿及幼虫的其余形态指标连线长度相似且都较长,表明这些特征的贡献率较大。连线在对应主成分的斜率表示该形态特征与此主成分的相关性强弱,斜率越小,相关性越强。可见,虫瘿厚及幼虫体长与主成分1的相关性较强,因而在柳厚壁叶蜂生长发育过程中可以用虫瘿厚及幼虫体长分别代表虫瘿及幼虫的生长发育状况。
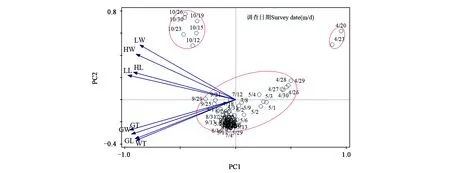
图1 主成分分析的载荷及得分Fig.1 Load and score of principal component analysis
2.2 柳厚壁叶蜂虫瘿及幼虫形态特征的去除趋势对应分析
DCA排序可以反映各物种在主要生长梯度的分布特征,通过这些物种与排序轴的相关性分析找出与排序轴显著相关的特征量。柳厚壁叶蜂虫瘿及幼虫各形态特征的DCA分析结果见表3,可见,DCA前两个排序轴的特征值分别为0.009 4、0.000 2,第1、2排序轴累计解释方差为80.3%,大于70%[33],表明这两个排序轴可反映柳厚壁叶蜂虫瘿、幼虫形态特征数据分布的基本全貌,即这两个排序轴包含了大部分形态特征信息。因此采用第1、2排序轴的特征值,绘制二维排序图。
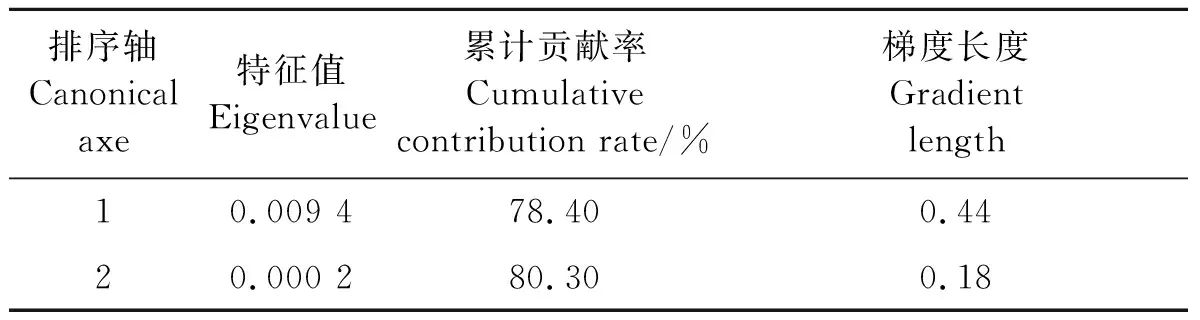
表3 柳厚壁叶蜂虫瘿及幼虫形态特征的DCA分析Table 3 DCA analysis of the morphological characteristic of the gall and larva of P. dolichura
DCA排序图可以综合反映物种和群落或物种和物种之间的相关程度及其在平面散点图内的综合对比关系[28]。由图2A可知,幼虫体宽数据位于第1象限,在x和y轴的投影都较大,表明该形态指标对柳厚壁叶蜂幼虫的生长发育形态贡献率较大;虫瘿壁厚数据位于第4象限,在y轴的投影较大,表明该指标对虫瘿生长发育形态贡献率较大。虫瘿厚这一指标在x和y轴的投影均较小,表明该指标对虫瘿生长发育的贡献率较小。从图2A也可明显看出,幼虫体宽和虫瘿壁厚这两个指标与其他形态指标距离较远,说明这两个指标与其他形态指标的相关性较差。对角线基本反映了虫瘿和幼虫形态特征的变化规律,即第2、3象限主要是虫瘿的形态特征,逐渐过渡至以幼虫形态特征为主的第1象限。DCA得分(图2B)中,DCA第一轴主要反映了调查时期的进程,第二轴主要反映了从虫瘿生长发育为主逐渐到幼虫的生长发育为主的变化过程。调查日期4月20日和4月23日处于x轴最左端,而调查日期10月12日—10月30日处于x轴最右端,基本反映出沿着DCA的x轴从左到右,逐渐由春季向秋季转变的趋势。形态数据在调查时间上明显可以分为3段:4月23日之前,4月26日—9月29日和10月12日之后,这与PCA分析结果一致。
2.3 虫瘿各形态指标之间的自相关分析
对虫瘿的4个形态指标之间进行自相关分析,结果见图3,可见,在研究期内,虫瘿宽(x)和虫瘿厚(y)的线性回归方程为y=1.283x-2.297 (R2=0.942,P<0.000 1)。虫瘿长(x)和虫瘿宽(y)的线性回归方程为y=0.917x-1.997 (R2=0.908,P<0.000 1)。虫瘿厚与虫瘿宽之间、虫瘿长与虫瘿宽之间也均呈显著线性相关关系,两个线性方程的R2皆大于0.90,P值均小于0.000 1,虫瘿其余形态指标之间的R2值均大于0.80,且P值均小于0.000 1。说明柳厚壁叶蜂虫瘿各形态指标两两之间的线性关系较为可靠。因此,虫瘿各形态指标之间,可以根据线性回归方程进行相互转换,这为虫瘿形态变化规律的研究奠定了基础,也为判断柳厚壁叶蜂幼虫生长发育规律提供强有力的数据支撑。

图3 柳厚壁叶蜂虫瘿各形态指标之间的线性回归分析Fig.3 Linear regression analysis between gall morphological indexes of P. dolichura
2.4 幼虫各形态指标之间的自相关分析
对柳厚壁叶蜂幼虫的4个形态指标两两之间进行自相关分析,结果见图4,可见,在研究期内,柳厚壁叶蜂幼虫各形态指标之间存在显著线性关系,幼虫体长(x)与体宽(y)的回归方程为y=0.190x-0.111(R2=0.980,P<0.000 1);幼虫体长(x)与头宽(y)的回归方程为y=0.117x+0.092(R2=0.966,P<0.000 1);幼虫体宽(x)与头宽(y)的回归方程为y=0.605x+0.168(R2=0.958,P<0.000 1);幼虫体长与体宽、体长与头宽、体宽与头宽的线性回归的R2值均高于0.95,P值均小于0.000 1。因此,幼虫的形态指标之间均存在一定的线性关系,可以根据线性回归方程进行相互转换。

图4 柳厚壁叶蜂幼虫各形态指标之间的线性回归分析Fig.4 Linear regression analysis between larva morphological indexes of P. dolichura
2.5 虫瘿与幼虫代表形态特征之间的线性关系
由于虫瘿、幼虫各形态特征指标之间的自相关很强,并基于PCA和DCA分析结果,选择虫瘿厚和幼虫体长分别作为虫瘿形态特征和幼虫形态特征的代表,进行虫瘿和幼虫形态指标的线性回归分析,结果见图5A,可见虫瘿厚和幼虫体长间存在显著的线性关系,R2为0.511。可以看出,发育前期形态测量数据点的分布较为聚集,而发育后期,幼虫的形态测量数据出现剧烈增长趋势,表现出明显的形态数据分段规律。进一步对发育前期的数据进行线性分析,结果见图5B,可见,当幼虫体长小于等于6.90 mm时,虫瘿厚(y)与幼虫体长(x)的线性回归方程为y=1.771x+0.653 (R2=0.920,P<0.000 1),线性关系显著,这与PCA结果一致。因此,虫瘿厚和幼虫体长的线性关系表现为明显的条件函数关系。进一步对虫瘿与幼虫的其他形态特征进行分析,发现虫瘿与幼虫各形态指标之间均存在条件函数关系,在幼虫发育初期至中期存在显著的线性关系;在幼虫发育后期,幼虫的形态指标突然变大,即老熟阶段[25],幼虫形态呈现跳跃式增长。
3 讨论
本研究运用主成分分析、去除趋势对应分析以及线性回归分析方法对柳厚壁叶蜂幼虫生长发育与虫瘿增长的相关性进行研究。主成分分析中,虽然虫瘿壁厚和幼虫体宽分别对虫瘿和幼虫的贡献率最高,但是这两个形态指标的相关性较其他形态指标的相关性小,所以本研究选择矢量夹角最小、相关性最强的虫瘿厚与幼虫体长来分别代表虫瘿与幼虫进行一元线性拟合。
DCA排序图的对角线基本反映了虫瘿和幼虫形态特征的变化规律,即调查时期由春季向秋季转变的过程,同时反映了柳厚壁叶蜂虫瘿内幼虫的生长发育过程。虫瘿壁厚和幼虫体宽两个指标距离其他形态指标较远,即这两个形态指标与其他指标的相关性较差,这与PCA的研究结果一致。由于纳入分析的数据包括虫瘿形态和幼虫形态两类,所以在进行不同组别数据之间的DCA分析时,排序轴存在明显差别。

A: 线性回归分析;B: 条件线性回归分析。A: Linear regression analysis;B: Conditional linear regression analysis.图5 柳厚壁叶蜂虫瘿厚与幼虫体长的线性回归和条件线性回归分析Fig.5 Linear regression and conditional linear regression analysis between gall thick and larva length of P. dolichura
主成分分析及DCA分析结果中,不同调查时期柳厚壁叶蜂虫瘿及幼虫均有较为明显的界限与分布范围。虫瘿及幼虫的8个形态指标在不同调查时期明显聚为3类,反映出柳厚壁叶蜂虫瘿及幼虫各形态指标在不同发育时期呈现一定的规律性,即4月23日之前,虫瘿及幼虫皆处于初生状态,发育都比较缓慢,形态变化较小;4月26日—9月29日,虫瘿与幼虫皆处于生长阶段,发育平稳,体型增长较快,规律性较强;10月12日之后,幼虫进入老熟阶段,幼虫各形态数据突然增大,而虫瘿的形态数据变化较小,两类形态数据的关系从线性转变为条件线性关系。
致瘿昆虫在虫瘿中以植物组织为食或从植物的筛管中获取营养[34-35],为扩大虫瘿内部昆虫的取食面积,获取更多营养来供给幼虫,就必须通过增大虫瘿体积来增大内部表面积。本研究发现,幼虫老熟阶段前(9月)柳厚壁叶蜂虫瘿的形态随着幼虫的体长、体宽增加不断增长,且二者的变化趋势基本一致,可能是由于致瘿昆虫取食或者产卵刺激植物组织导致虫瘿不断增长[36],随着虫瘿内幼虫的生长,刺激程度不断积累,虫瘿也会逐渐增厚变大。因此,虫瘿的形态指标可作为估计害虫发育状态和预测危害程度的重要依据[37]。当柳厚壁叶蜂幼虫进入老熟阶段初期,由于大龄幼虫取食量的增加,幼虫形态和体积发生剧变,虫瘿与幼虫表现出条件线性关系,就二者代表性指标而言,只有当幼虫体长≤6.90 mm时,虫瘿厚和幼虫体长才存在线性关系,且这一阶段的虫瘿瘿室达到最大、瘿壁达到最厚,随着幼虫进入老熟阶段,发育至不食不动状态,虫瘿的增长速度减缓甚至停止,最后随着幼虫离开虫瘿而略皱缩[7]。
关于致瘿昆虫与虫瘿之间的互作机制, Hapai等[38]和陈湖等[39]认为,致瘿昆虫通过取食虫瘿中特殊营养层细胞来维持生存,而营养层细胞又会不断进行增殖分化供给虫体生长所需的营养,虫瘿大小和质量的增加可能与营养层细胞愈伤组织的增生有关。外在影响因素如虫瘿密度、分布范围以及所在气候环境,内在影响因素如致瘿昆虫释放刺激物的时间、种类、数量等都可能是造成虫瘿在幼虫老熟阶段前不断生长的原因,具体机制仍将是后续研究的重点。
致谢:诚挚感谢山西农业大学南宏伟副教授、禹飞讲师和田成讲师对数据分析提出宝贵建议。
