基于TFOS DEWSII标准的单纯红斑狼疮患者合并干眼的相关研究
2020-03-16
干眼是眼表的多因素疾病,其特征是泪膜稳态的丧失,伴随眼表症状,其病因包括泪膜不稳定、泪液高渗透压、眼表炎症与损伤和神经感觉异常[1-3]。2017年,国际泪膜和眼表协会干眼疾病工作组第二次会议(The Tear Film & Ocular Surface Society Dry Eye WorkshopII,TFOS DEWS II)对干眼进行了上述重新定义。与过去的干眼标准相比,TFOS DEWS II标准更加客观、精确。干燥综合征(Sjögren's syndrome,SS)合并干眼已被大量研究证实并报告,但是同属自身免疫性疾病的系统性红斑狼疮(systemic lupus erythematosus,SLE)合并干眼的相关研究较少[4,5]。SLE患者异常的免疫能力突显,多种炎症信号通路被激活[6]。TFOS DEWS II指出眼表炎症持续存在是泪膜稳态下降的重要因素,因此我们认为参照新的TFOS DEWS II标准分析SLE患者[不合并干燥综合征(Sjögren's syndroms,SS)]眼表改变,将有助于深入了解SLE患者的干眼发病率及分型并为SLE干眼提供更加精准的治疗,意义重大。
资料与方法
一、一般资料
采用横断面研究方法。选择2017年10月~2018年9月期间在安徽医科大学第一附属医院明确诊断为SLE患者(不合并SS)共70例,男女比例1:13,年龄15~67岁。选取性别、年龄相匹配的70例正常人作为对照组。纳入SLE患者均为抗SSA及抗SSB阴性,且无口干病史。具有任何其他自身免疫性疾病、眼表疾病、近2周内有滴眼液使用史及既往眼科手术史的参与者被排除。这项研究通过了“安徽医科大学第一附属医院伦理委员会”批准。
二、眼表评估
根据TFOS DEWS II干眼诊断标准,评估每例患者的干眼症状、泪膜参数和眼表特征。所有的检查遵循先无创检测后有创检测的原则,以防影响检测结果。泪膜的参数由Keratograph 5M非侵入性眼表综合分析仪检测获取,检测按照以下顺序:泪河高度、无创泪膜破裂时间、脂质层观察、睑板腺拍摄、睑缘检测、角膜荧光染色。所有参与者都在同一地点接受评估,由同一检测者检测。
1.干眼主观症状评估:选取国际通用的眼表疾病指数(ocular surface disease index,OSDI)问卷,对SLE患者进行干眼症状评估,评价内容包括:过去1周的眼表症状、视功能及环境因素等等。OSDI满分为100分,当≥13分时,进入干眼客观检查流程。
2.泪河高度:反映泪液的量。利用非侵入性眼表综合分析仪测量瞳孔中央正下方泪河上下极对应点之间的距离获得泪河参数。医生对同一患者测试3次,取平均值。泪河正常为0.2~0.35 mm,高泪河≥0.35 mm,低泪河分为<0.2 mm。
3.无创泪膜破裂时间(non-invasive keratograh breakup time,NIKBUT):反映泪膜的稳定状态。利用非侵入性眼表综合分析仪记录患者泪膜图并分析NIKBUT。医生对同一患者测试3次,取平均值。正常平均破裂时间为11~15 s,高标准为>15 s,而低标准为<10 s。
4.脂质层观察:反映泪膜的脂质层改变。这项检查可以弥补传统干眼检测方法无法评估泪膜脂质层的不足。利用非侵入性眼表综合分析仪显示脂质层图片并进行脂质层分级。0级:脂质层颜色暗淡苍白,无定形;1级:脂质层色彩微灰,结构较模糊;2级:脂质层色彩丰富,结构清晰;3级:脂质层色彩极为丰富,结构高度清晰。
5.睑板腺拍摄:利用非侵入性眼表综合分析仪获取上睑板腺图片,用 ImageJ 软件进行睑板腺缺失面积计算并分级。0级:睑板腺无缺失;1级:睑板腺缺失面积≤1/3;2级:睑板腺缺失面积>1/3且≤2/3;3级:睑板腺缺失面积>2/3。
6.睑缘检测:利用裂隙灯对患者进行睑缘评级。评价上下睑中1/3区域睑板腺的分泌物性状。0分:睑脂透明;1分:睑脂污浊;2分:睑脂污浊伴碎屑;3分:睑脂呈牙膏状。此外,观察睑板腺开口是否堵塞。睑缘检测与上述的脂质层检测及睑板腺面积缺失检测有助于蒸发过强型干眼的判断。
7.角膜荧光染色:反映眼表的受损程度。将角膜分为4个象限,按象限加和积分。0分:无着染;1分:染色点<5个;3分:出现片状染色或丝状物,2分:介于以上两者之间。角膜染色共计0~12分。
三、TFOS DEWS II干眼诊断流程
首先鉴别并排除多种与干眼相似的情况,分析可能的高危因素(如吸烟、角膜接触镜的佩戴等)。然后,应用OSDI问卷对患者进行干眼症状评分。当OSDI评分≥13分时,使用非侵入性检查来全面评估眼表情况。当NIKBUT<10 s或角膜染色评分>5分时,即提示眼内平衡受到了破坏。基于OSDI评分和一个或多个眼内平衡标志物的阳性结果确诊干眼。之后,结合其他眼表检测参数(泪河高度、脂质层分级、睑板腺缺失面积及睑缘分级)对干眼的亚型及严重程度进行判断。与既往不同,TFOS DEWS II将干眼分为3型:水液缺乏型,蒸发过强型及混合型干眼。
四、统计学方法
采用SPSS 17.0软件进行统计分析。双眼的资料被收集,但只纳入干眼检测更差眼的资料用于统计学检验。检测数据采用(均数±标准差)表示。对于率或构成比比较采用卡方检验。服从正态分布的数据,两组间比较采用配对t检验。对非正态分布的数据,两组间比较采用Wilcoxon秩和检验。3组及3组以上的比较采用方差分析。对于符合正态分布的数据,用Pearson相关分析检验相关性。对于非正态分布的数据间的相关性,用Spearman秩相关分析检验。P<0.05(双侧)被认为差异有统计学意义。
结 果
70例SLE患者(65例女性,5例男性)的平均年龄为(35.70±9.30)岁,70例正常人(65例女性,5例男性)的平均年龄为(37.10±7.60)岁,两者之间无统计学差异。表1显示了参与者的人口统计学特征、眼表特征和泪膜特征。总体而言,有更大比例的SLE参与者符合TFOS DEWS II干眼诊断标准(41%对23%,P<0.05)。
OSDI评分在SLE组比对照组更高,差异有统计学意义(15.10±12.60 vs. 9.30±4.10,P<0.05)。SLE组的NIKBUT比对照组偏低,差异有统计学意义(9.70±4.30 vs. 13.10±2.90,P<0.05)。SLE组的泪河高度较对照组偏低,两者之间差异有统计学意义(0.18±0.07 vs. 0.23±0.05,P<0.05)。与对照组相比,脂质层分级在SLE组显示的较差,差异有统计学意义(P<0.05)。与对照组相比,SLE组的睑板腺缺失面积较多,差异有统计学意义(P<0.05)。两组的睑板腺开口分级比较,差异无统计学意义(P>0.05)。两组的角膜荧光染色比较,SLE组评分更高,但差异无统计学意义(P>0.05)。
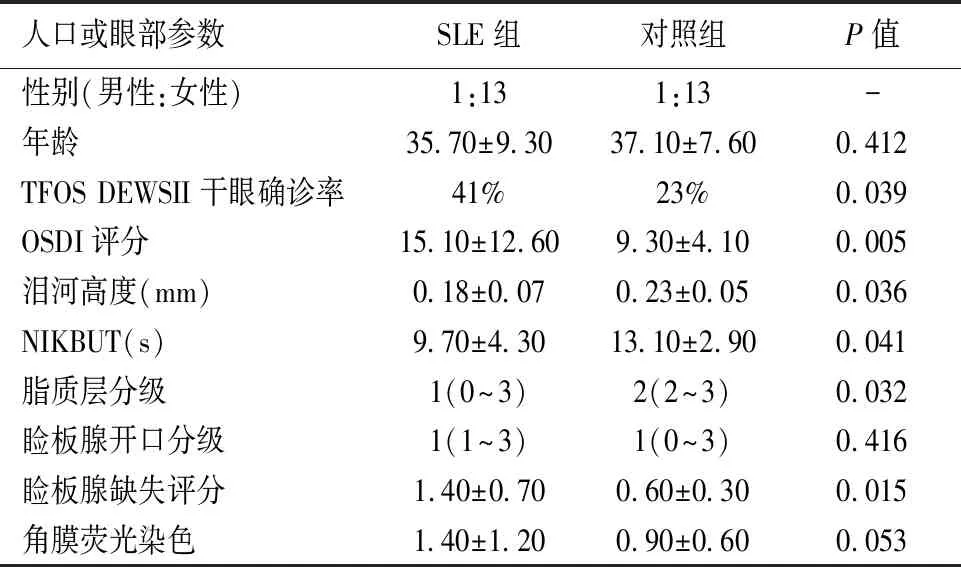
表1 SLE组与对照组人口资料与眼部检测结果比较
对SLE组患者的干眼程度进行分级,结果显示:干眼为29例,非干眼为24例,疑是干眼为17例。三者之间在OSDI评分、NIKBUT及泪河高度的差异有统计学意义(P<0.05);但三者在病程和睑板腺缺失面积方面的差异无统计学意义(P>0.05)(见表2)。根据TFOS DEWS II的分型标准,SLE干眼患者中,水液缺乏型干眼为13例,蒸发过强型干眼为7例,混合型干眼为9例(见表3)。
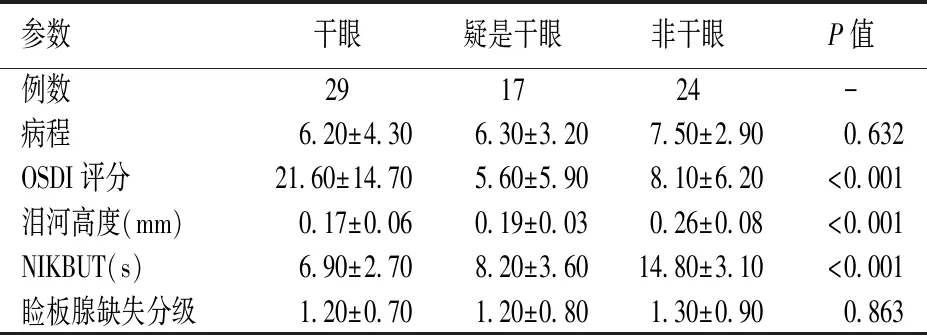
表2 SLE组不同程度干眼的人口资料与眼部检测结果
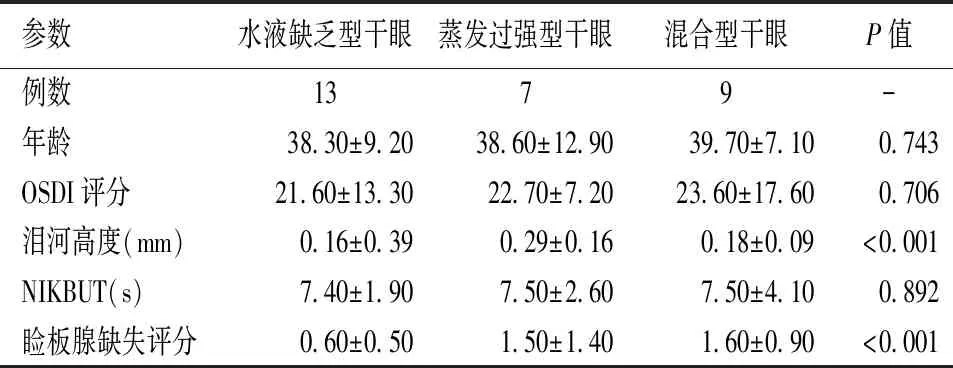
表3 SLE组不同类型干眼的人口资料与眼部检测结果
讨 论
本研究结果显示,与正常人相比较,有相当大比例的SLE参与者符合TFOS DEWS II干眼诊断标准,干眼风险增加。2017年,TFOS DEWSII对干眼进行了重新定义。泪膜的不稳定性被认为是干眼病的恶性循环中的一个主要原因,泪膜高渗和眼表炎症持续存在,导致眼表损伤。同时,TFOS DEWSII提出了一整套新的干眼诊断标准及分型。与过去的标准相比,新标准更加客观、精确。
自身免疫性疾病因为患者全身的异常免疫状态,可影响多个器官、组织,眼表也是常受累组织。自身免疫性干眼并非是一个新话题,SS干眼已被大量研究并报道[7,8]。但是,同属自身免疫性疾病的SLE合并干眼的相关研究较少。同时,既往的自身免疫性干眼诊断中,由于认识和检测设备等局限,往往集中在泪腺组织的破坏及泪液量的变化,导致了这一类干眼的评估往往不全面,忽略了睑板腺、泪膜脂质层、角膜神经知觉、眼表炎症等其他相关干眼检测。基于以上原因,导致无法精确的对自身免疫性干眼进行诊断、分型以及有针对性的治疗。相对于过去的标准,TFOS DEWS II干眼诊断标准有了很多改变:对眼表更全面评估:更加关注泪膜脂质层;首次引入神经知觉概念;分型更合理,首次纳入了混合型干眼概念。这些改变使得干眼的诊断和分型更加准确。SLE患者正常的免疫能力下降,而异常的免疫能力却突显,多种炎症信号通路被激活。TFOS DEWS II指出眼表炎症持续存在是泪膜稳态下降的重要因素,因此我们认为参照新的标准分析SLE患者的眼表改变,将有助于深入、客观的了解SLE干眼。
我们的研究结果显示,SLE患者的泪河高度偏低,反映了泪液量的改变,这种趋势与以前的SS干眼研究结果一致。泪腺往往是自身免疫性疾病的受累组织,当泪腺的炎症细胞浸润到一定程度会导致泪液分泌减少,引发水液缺乏型干眼。除此之外,我们还观察到SLE受试者的泪膜稳定性和脂质层质量较差,表现出不完整的闪烁,这可能与泪膜的脂质层完整性维持不良有关。有研究显示,瞬目可促进脂质层在眼表均匀分布。这似乎为下面的假设提供了支持,神经系统损害在自身免疫性疾病也十分常见,SLE患者发生角膜神经知觉下降的可能性较正常人高,导致瞬目功能下降,进而影响脂质层在眼表的涂布[9,10]。本研究观察到SLE患者的睑板腺缺失更严重,这也可能参与了干眼的发生。脂质层质量下降增加了泪膜的蒸发和导致干燥的眼表,较高的睑板腺缺失加剧了这种情况。以上这些改变可能会导致眼表炎症的恶性循环,进一步加重干眼症状和体征。我们不难发现,参照TFOS DEWS II干眼诊断标准进行干眼诊断有其优势的一面。既往我们将自身免疫性干眼归纳为单一的水液缺乏型干眼,但是我们的研究显示,SLE患者的泪膜脂质层和睑板腺的质量都较正常人差,这些改变都会加剧蒸发过强型干眼的发生,换而言之,SLE干眼更多的是混合型干眼。这项结果是有临床意义的,因为干眼的准确分型是精准治疗的前提,这有助于我们对不同类型的SLE干眼制定个性化治疗方案。
尽管角膜荧光染色是一种典型的干眼临床表现,但是我们结果显示其在SLE组和对照组之间没有显著差异。事实上,这一点也与其他研究结果相一致。已经有越来越多的学者认可,眼表染色在轻度至中度干眼中缺乏鉴别能力,染色可能是更严重干眼的临床表现[11]。
有趣的是,本研究结果显示SLE病程和任何眼表参数之间并无明显的相关性,这是否提示我们需要关注早期SLE患者干眼的发生并予以干预,这需要进一步研究证实。此外,TFOS DEWS II明确提出神经知觉概念:即便没干眼症状,如果检测符合干眼体征及发现角膜神经知觉异常,即可诊断干眼。考虑到SLE对神经系统的影响,关于SLE患者的角膜知觉改变也是我们需要进一步研究的焦点。TFOS DEWS II干眼诊断标准推动了干眼的精准化进程,之前国内外还未有以TFOS DEWS II干眼诊断标准对SLE干眼的发生率和类型的研究报道。本研究参照新的干眼标准对SLE干眼进行研究,有助于深入了解SLE患者的干眼病程、干眼类型以及为SLE干眼提供更加精准的治疗,具有积极的意义。
