ESR1、MYOD1和hTERT基因启动子DNA甲基化与宫颈癌放化疗敏感性的关系
2020-03-13沈兰陈春华叶冬云南方
沈兰 陈春华 叶冬云 南方
宫颈癌在中国是女性中第二位常见的癌症,是女性因癌症死亡的重要原因[1]。宫颈癌早期阶段采用手术治疗,而局部晚期(FIGO分期ⅡB/Ⅲ)的主要治疗方法是化学放射治疗。患者的总体和无病生存取决于肿瘤分期,而在给定的FIGO分期内,这将取决于肿瘤对治疗的反应[1]。在我们的设置中,大多数患者存在局部晚期疾病,并接受化学放射治疗。因此,重要的是能够预测这一群体的治疗反应,并确定那些对化学放射治疗(化学放射抗药性)反应较差的人,他们的替代方法可能具有潜在价值。DNA甲基化异常是癌症的特征之一,全球低甲基化和区域基因启动子高甲基化是已知的致癌事件[2]。因此,DNA甲基化谱可以作为判断预后的生物标志物和预后的预测因子。然而,关于基因启动子甲基化作为宫颈癌预测指标的数据是有限的。我们对文献进行研究,选择了6个基因,即雌激素受体1(ESR1)、早发期1型乳腺癌(BRCA1)、RAS-关联域族1异构体A (RASSF1A)、变异同系物1 (MLH1)、肌源性分化1 (MYOD1)和人端粒酶逆转录酶 (hTERT),据报道,在浸润性宫颈癌中甲基化的频率为20%~70%[3]。我们排除那些很高或很低频率的启动子甲基化的基因,因为它们可能没有预测价值[4]。选择的基因具有不同的细胞功能,参与细胞分化(ESR1)[5]、细胞增殖(RASSF1A、MYOD1)[6]、放疗/化疗后DNA修复(MLH1、BRCA1)[7]和永生化(hTERT)[8]的调控。本研究推测,这些基因的启动子甲基化状态或转录水平可能与侵袭性宫颈癌对化学放射的整体反应有关,本研究目的是评估ESR1、MYOD1和hTERT基因启动子甲基化谱和相应的转录本表达情况,以确定能够预测化学放射治疗患者的反应基因。
1 资料与方法
1.1 一般资料 本研究是在伦理委员会批准后进行的,审批标准依据1975年赫尔辛基宣言(2000年修订)在细胞学系分子病理学实验室进行的。此项研究获得受试者知情同意,并在2015年1月至2018年11月招募149例患者的连续队列,其中41例因社会和经济原因而退出。取常规的宫颈活检进行组织病理学诊断,其中小部分组织切片被快速冷冻并保存在-80℃。对70%以上肿瘤组织进行冰冻切片/触摸印迹涂片鉴定后,对标本进行分子分析。诊断时患有Ⅳ期疾病的患者、接受过任何形式治疗的患者和无法完成整个治疗过程的患者都被排除。排除41例后,108例浸润性宫颈癌(年龄27~70岁)在FIGOⅡB/Ⅲ期符合本研究的纳入标准。
1.2 治疗方案与患者随访 化学放射治疗采用四野箱照射技术,采用46 Gy/23分度外束照射,每周剂量为40 mg/m2顺铂,三维适形放射治疗。在治疗或完成治疗结束时进行腔内近距离治疗,包括2组高剂量率,间隔1周(每组9 Gy,高剂量率)。治疗方案完成后,第1年每2个月随访1次,5年内每3个月随访1次,5年 后每6个月随访1次。随访过程中,对患者进行临床检查、血常规、肾、肝功能等生化评价及相关的影像学检查,包括B超、骨盆、腹部、胸部CT扫描。没有盆腔控制患者在放射门户内被认为是淋巴区失败,而上述放射门户被认为是失败,包括主动脉旁疾病和全身转移。在上述随访基础上,6例患者治疗过程中发生全身或远处转移,因此被排除在进一步的分析之外。这些患者没有任何局部疾病的证据。建议他们在各自的家乡/村庄进行姑息治疗。在其余102例患者中,27例表现为局部淋巴结衰竭(局部疾病证据,LED),包括在治疗或复发过程中残留的颈部疾病和(或)盆腔淋巴结的患者,这些病例在化疗方案完成后1~18个月发生。其余75例患者在完成化疗方案后36~60个月的随访中无疾病(无疾病证据,NED)。
1.3 Taqman探针化学甲基化分析(甲基光法) 检测ESR1、BRCA1、RASSF1A、MLH1、MYOD1和hTERT基因启动子的甲基化状态。基因组DNA和RNA提取从25~30 mg的组织样本使用TRIzol试剂(美国Invitrogen公司)按照制造商的指示。用TaqMan探针和引物序列对DNA进行亚硫酸盐修饰,然后进行实时聚合酶链反应(PCR)。每个探针在5’端用6-FAM(荧光素酰胺)标记,在3’端用BHQ 1(黑洞猝灭剂1)标记。以外周血单个核细胞SSS 1甲基化修饰DNA为阳性对照;无模板构成阴性对照;ACTB管家基因为参考基因(Cp为15~20)。每个PCR反应含有12.5 μl Taqman mastermix (德国Hilden公司),600 nmol/L各引物(Eurofin MWG Operon,AL,USA),200 nmol/L探针,2 μl(100 ng)修饰DNA,最终体积为25 μl。采用标准运行条件,在ABI 7500实时PCR机(美国Applied Biosystems公司)上进行了实时PCR:初始变性为95℃ 10 min,95℃变性15 s,引物退火1 min,40次循环。所有样本均为一式两份。Cp值为30或更高被认为是甲基化产物的阴性。
1.4 基因转录水平的绝对定量 以DNase处理的总RNA为原料,根据生产厂家的指示,采用第一链cDNA合成试剂盒(美国Fermentas Life Science公司)合成cDNA。基因表达采用SYBRGreen 1实时PCR(qRT-PCR)方法,用前面描述的引物序列进行绝对定量。每个PCR反应含有10 μl SYBR green master mix(德国Roche Applied Science公司),各引物200 nmol/L,1 μl (100 ng)cDNA,终量为20 μl。以管家基因(ACTB)为参照基因,对DNA浓度的变化进行正常化,无模板构成阴性对照。qRT-PCR是在LightCycler 480(Roche Applied Science)上使用以下方案进行的:初始变性为95℃ 10 min,95℃变性15 s,引物退火20 s,72℃ 20 s(延伸荧光检测),40次循环。以管家基因(ACTB)为参照基因,对DNA浓度的变化进行正常化,而不以模板对照作为阴性对照。利用模板DNA的平均分子量和阿伏加德罗常数,计算了单位体积的拷贝数:(6.023×1023=阿伏加德罗常数,C=5×10-5g/ml,Mwt=bp×6.58×102g,OD260=260 nm吸收度)。原液按顺序稀释,得到一个标准系列,从105~1012份/ml,每份稀释度相差10倍。标准曲线效率在1.7~2.0被认为是显著的。试验样本的拷贝数由LightCycler 480软件版本1.5.0.39(Roche Applied Science)自动计算。
1.5 统计学分析 应用SPSS 16.0统计软件,定性或分类变量采用Pearson’s χ2检验或Fischer精确检验。为了评估与非甲基化或甲基化启动子的任何基因组合对结果的影响,利用R统计计算软件(R-3.1.1 for windows),进行层次聚类分析和基因特征分析,实现群体间的区分,并对折叠变化数据集进行判别分析。在考虑平均值的一组中,每个基因生成热图,以2对数的折叠变化为显著性。通过Mann-Whitney U检验,分析组织转录水平与患者预后的关系以及基因启动子甲基化与组织转录水平之间的关系。P<0.05为差异有统计学意义。
2 结果
2.1 患者生活型 本研究共纳入102例浸润性宫颈癌的病理诊断。平均年龄48.7岁(≥50岁44例,<50岁56例)。其中鳞状细胞癌94例(角化48例,非角化46例),腺癌6例。所有患者处于局部晚期,即FIGO ⅡB(n=50)或Ⅲ(n=52),并接受相同的化学放射治疗方案。ESR1、BRCA1、RASSF1A、MLH1、MYOD1和hTERT基因甲基化频率分别为53%、63%、50%、42%、70%和66%。本研究未观察到基因启动子甲基化与患者的年龄和FIGO分期有任何显著的关联。基因启动子甲基化与组织学类型的比较显示ESR1基因启动子甲基化与腺癌亚型显著相关(P=0.028)。6例腺癌中ESR1基因启动子甲基化率为100%,而鳞状细胞癌为50%。在排除10例全身转移瘤患者后,根据其结果和对化学放射治疗的反应,可分为2组:化学放射敏感(NED,n=75)和耐化学放射线(LED,n=27)。2组年龄、FIGO分期、组织学类型等临床或病理特征差异无统计学意义(P>0.05)。见表1。
2.2 基因启动子甲基化与治疗反应的关系 比较2组间基因启动子甲基化和相应基因的表达情况,找出能预测化学辐射反应的最小基因组。通过单变量分析比较化学放射敏感组和化学放射抗性组,发现ESR1和MYOD1基因启动子甲基化与治疗反应显著相关(P值分别为 0.05、0.03)。此外,分层聚类分析和交叉验证表明,2组间的MYOD1、ESR1和hTERT基因启动子甲基化差异有统计学意义(P<0.001)。与单因素分析的结果一致。进一步分析这三种基因的组合基因启动子甲基化或未甲基化与化学放射反应的关系,观察到非甲基化MYOD 1与甲基化hTERT基因启动子和非甲基化MYOD 1与非甲基化ESR1基因启动子组合可预测不良反应(P值分别为0.01、0.03)。见表2、3。

表1 患者特征 n=101
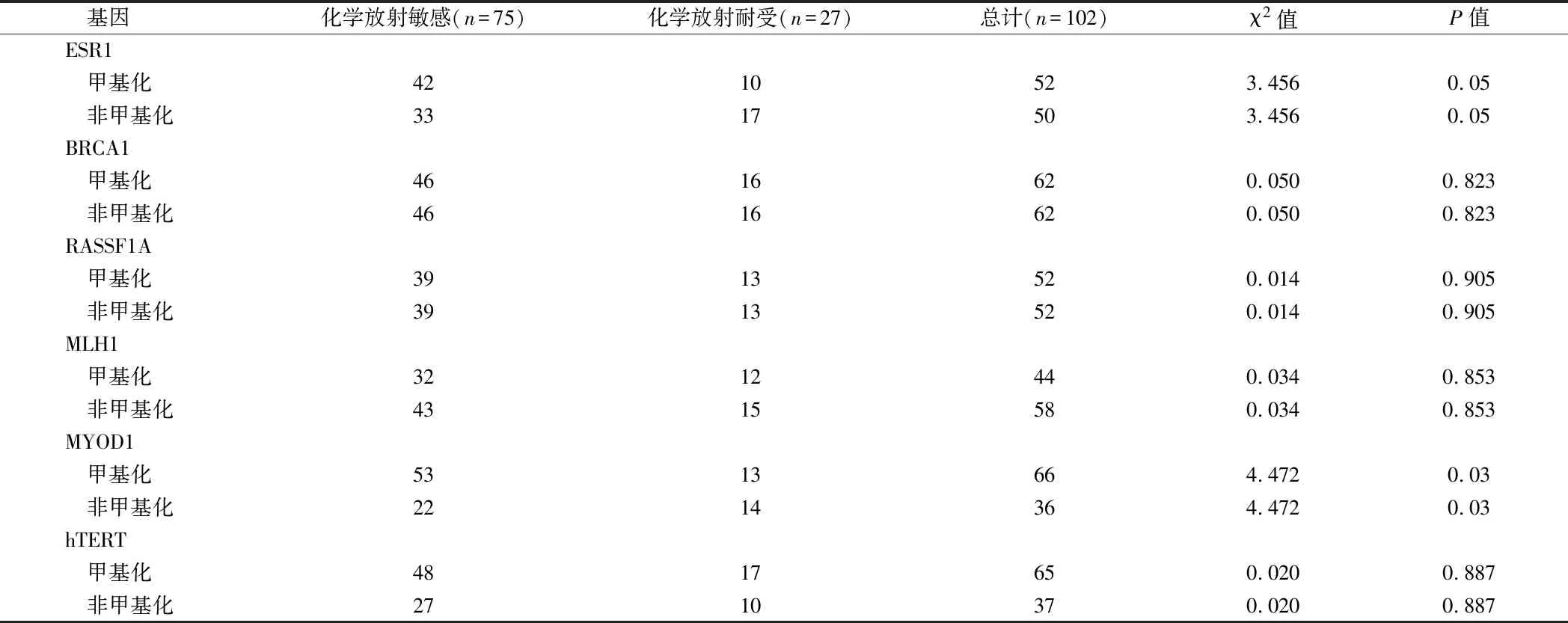
表2 浸润性宫颈癌基因启动子甲基化与化疗反应的关系 例
2.3 ESR1和hTERT基因启动子甲基化频率与HPV 16/18感染的关系 从102例纳入诊断研究的样本中,选取40例进行宫颈病变不同阶段ESR1和hTERT基因启动子甲基化频率与HPV 16/18感染的关系,同时入选的还有CIN 1、2、3级患者各10例,正常对照组40例。结果显示,对于ESR1,40例正常宫颈标本和10例CIN 1组织样本均未被甲基化。10例CIN 2中5例,10例CIN 3中7例,40例宫颈癌组织37例,甲基化率分别为50%、70%和92.5%。hTERT的甲基化频率也呈上升趋势,正常宫颈、CIN 1、CIN 2、CIN 3和宫颈癌组织的甲基化率分别为2.5%、0、30%、70%和87.5%。ESR1和hTERT的甲基化频率与宫颈病变的严重程度相关(P<0.001)。HPV 16/18感染在正常宫颈(5/40)、CIN 1(1/10)、CIN 2(3/10)、CIN 3(5/10)和宫颈癌组织(27/40)中检测到,且与宫颈病变的严重程度相关(χ2=29.957,P<0.001)。见表4,图1。

表3 侵袭性宫颈癌中组合基因启动子甲基化与化学放射反应的关系 例
注:M,甲基化等位基因;U,非甲基化等位基因

表4 宫颈病变不同阶段ESR1和hTERT基因启动子甲基化频率与HPV 16/18感染的关系
注:Kruskal-Wallis h检验(比较各组间ESR1、hTERT和HPV 16/18比率):χ2=79.416,P<0.001;χ2=70.016,P<0.001;χ2=29.957,P<0.001;Mann-Whitney U检验(CIN 1或更低和CIN 2或更高者ESR1、hTERT和hpv 16/18比率比较):Z=-8.542,P<0.001;Z=-3.391,P=0.001,Z=-4.981,P<0.001
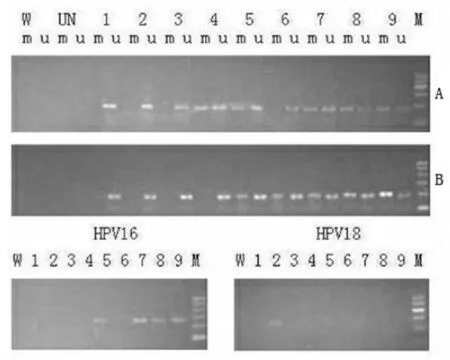
图1琼脂糖凝胶电泳分析ESR1和hTERT基因甲基化及高危人乳头瘤病毒(hr-hpv)在宫颈病变不同阶段的感染
注:A:ESR1;B=hTERT;W=水;M=Marker(100~600 bp);m=甲基化特异性PCR产物;u=非甲基化特异性PCR产物;UN=未经修饰的DNA;1~3泳道=正常组织;4~6泳道=CIN组织;7~9泳道=宫颈癌组织
2.4 基因转录水平与预后的绝对定量 用绝对定量方法测定组织中ESR1、BRCA1、RASSF1A、MLH1、MYOD1和hTERT的转录水平,结果显示化学放射敏感组(NED)和耐化学辐射组(LED)间差异有统计学意义。比较2组之间的中位转录水平,发现ESR1组织转录水平与应答显著相关(P=0.036)。较低的ESR1转录水平与对化学放射治疗的不良反应有关。经层次聚类分析,ESR1基因转录本在2组间差异有统计学意义(P<0.001)。未观察到基因启动子甲基化与我们队列中相应的基因表达有统计学意义;然而,RASSF1A、MLH1和MYOD1基因转录表达与甲基化呈反向关系。见表5。
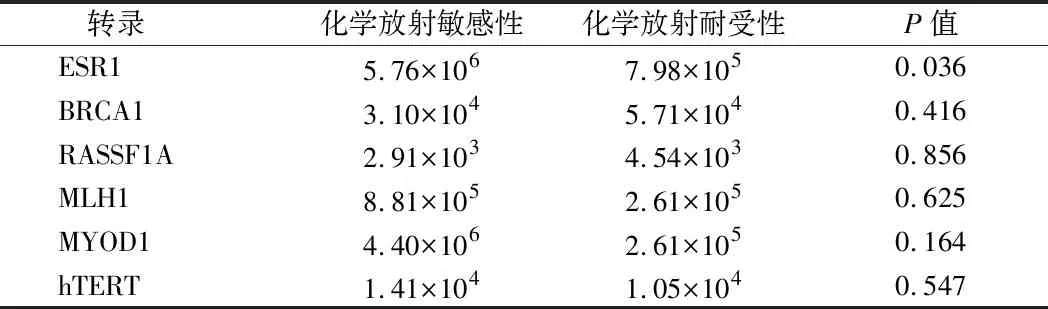
表5 浸润性宫颈癌组织转录水平与化学放射反应的关系
注:Mann-Whitney U 测试
3 讨论
本研究目的是从一组基因中寻找表观遗传生物标记物,这些基因可以预测浸润性宫颈癌患者对治疗的反应。所有患者在FIGO ⅡB/Ⅲ期接受放射治疗,较单纯放疗治疗浸润性宫颈癌更有效,5年生存率由30%~50%提高到50%~70%。辐射治疗通过细胞坏死和凋亡诱导细胞死亡。比较化疗敏感组和化疗耐药组的基因启动子甲基化模式和基因转录本表达,以确定能够预测浸润性宫颈癌患者对治疗反应的最小基因组。目前还没有单一的标记物或多种标记物可以预测放射治疗的疗效。
我们观察到ESR1、MYOD1和hTERT的甲基化状态可以预测结果。甲基化MYOD1预测了一个良好的结果,在浸润性宫颈癌患者治疗的化学放射治疗。非甲基化的MYOD1基因启动子对辐射反应的生物学意义尚不清楚[9]。MYOD 1编码是一种参与肌肉分化的转录因子。因此,其表观遗传失调可能与细胞去分化或激活上皮间充质过渡通路有关,而这些途径正被越来越多地认为与耐药和耐辐射有关[10]。
ESR1启动子甲基化也预示着化学放射治疗的更好结果。此外,6例腺癌均显示ESR1启动子甲基化,5例为化疗敏感,1例为耐药。在最近的报告中,甲基化的ESR1与更高级别的肿瘤有关[11],尽管其与宫颈癌的预后无关,然而,并没有把它作为一种预测指标来评价。相反,MYOD 1和ESR1,甲基化hTERT预测的结果较差。hTERT是一种与端粒酶活性相关的潜在癌基因,笔者尚未见报道。在分析的其他基因中,RASSF1A和BRCA1缺乏与结果的相关性[12]。
基因拷贝数与疾病结局的分析表明,ESR1转录本水平的降低与化疗耐药有关。这一观察得到相关研究[13]的支持,其中ESR1的表达缺失与宫颈癌细胞的侵袭性有关;浸润性鳞状细胞癌与高级别宫颈上皮内瘤变(CIN)相比,ESR1表达明显下降。
启动子甲基化与抑癌基因、细胞周期调控基因的沉默有关,而癌基因则与低甲基化引起的表达增加有关[14]。本研究分析的基因都没有显示甲基化和表达间有统计学上的关联。只有少数研究已经评估基因启动子甲基化和表达在宫颈癌,显示出不同的结果[15]。癌前宫颈病变中DNA甲基化、hTERT mRNA表达与端粒酶活性之间无相关性。同样,在某些宫颈癌细胞株中,ESR1的表达降低并伴随甲基化,而在宫颈癌组织中则不是这样。在其他几种癌症中,RASSF1A启动子甲基化与其沉默有关。BRCA1,MLH1甲基化与转录水平无关;在宫颈癌中没有类似研究。以往有关甲基化模式与基因表达相关的研究大多采用传统的甲基化特异性PCR技术和传统的基于凝胶的逆转录-聚合酶链反应(RT-PCR)技术。使用TaqMan法和qRT-PCR等极其敏感的方法进行基因拷贝数的推导,可能会导致甲基化与基因表达无关的结果。另一方面,基因表达的调控是非常复杂的,可能是由微RNA、长非编码RNA、组蛋白乙酰化等其他因素决定的,这些因素在癌症中都发生了深刻的改变。有报告提示微RNA参与宫颈癌细胞的放射抵抗[16]。
如果有替代疗法,通过甲基化分析来鉴定化疗耐药,可能会对患者有好处。表观遗传疗法使用去甲基化药物,在治疗乳腺癌和肺癌等实体肿瘤的临床试验中显示出一些前景。然而,目前仍没有关于宫颈癌的资料,这将需要进一步的调查。
