广西麻风患者HLA-B*13:01基因检测预防DDS综合征效果分析
2020-03-13段启志许凤妮朱邦勇王砚蕾胡冠豪周志光韦江平
段启志 许凤妮 李 伟 张 杰 朱邦勇 王砚蕾 王 宏 李 峥 胡冠豪 周志光 黄 耿 韦江平 秦 雁
广西皮肤病防治研究所,南宁,530003
氨苯砜(又称二氨基二苯砜)自1908年首次合成以来,因其抗炎、抗菌和抗寄生虫作用,逐渐被应用于麻风、疱疹样皮炎、痤疮等多种皮肤病的治疗,是WHO麻风联合化疗(MDT)的主要药物之一[1,2]。氨苯砜综合征(DHS)是氨苯砜引起的药物超敏反应综合征,其发生和严重程度与剂量无关。除部分表现不全的患者外,DHS常同时累及皮肤、肺、消化、血液等多个器官和系统。研究表明,DHS在我国的发生率约为1%~1.5%,致死率约为9.6%~11.1%,严重威胁患者的生命安全[3,4]。广西是我国麻风流行的一类地区,近10年来年均发现麻风患者65例。2010-2013年,广西应用MDT治疗新发麻风患者时发生DHS 8例,死亡1例。2013年,张福仁等[5]对我国DHS患者的全基因组关联分析研究表明,HLA-B*13:01基因为DHS的易感基因,这意味着DHS的一级预防成为可能。广西于2015年7月1日全面开展“麻风病疗前易感基因检测预防DHS”项目,对近年新发麻风患者进行HLA-B*13:01基因等相关检测,现将结果报道如下。
1 资料与方法
1.1 资料来源 资料来源于全国麻风防治管理信息系统(LEPMIS)、各县(市、区)的各类麻风疫情监测表和HLA-B*13:01基因检测报告。
1.2 研究方法
1.2.1 检测方法 纳入广西2015年7月1日至2018年12月31日全部新发麻风患者,排除既往曾用氨苯砜治疗或砜类药物过敏的患者,在患者充分知情并签订知情同意书后进行HLA-B*13:01基因检测(标本送至山东省皮肤性病防治研究所进行检验,即首先应用QuickGene DNA试剂盒提取外周血基因组DNA,再应用序列特异性寡核苷酸探针进行检测,阳性标本用GenDx公司的NGSgo进行下一代测序以对患者进行HLA基因分型)、血常规、肝肾功能等临床观察需要的检测和葡萄糖-6-磷酸脱氢酶(G6PD)检测[6]。
1.2.2 治疗方案 HLA-B*13:01基因检测阴性和非G6PD缺乏症者予MDT方案治疗,即多菌型(MB)患者应用氨苯砜(5岁以下隔日25 mg、5~9岁每日25 mg、10~14岁每日50 mg、15岁及以上每日100 mg,自服)、利福平(单次剂量为:5岁以下150mg、5~9岁300 mg、10~14岁450 mg、15岁及以上600 mg,每月1次,监服)、氯法齐明(单次剂量为:5岁以下50 mg、5~9岁100 mg、10~14岁200 mg、15岁及以上300 mg,每月1次,监服;5岁以下隔日50 mg、5岁及以上每日100 mg,自服)治疗,疗程12个月,少菌型(PB)患者应用氨苯砜、利福平治疗(剂量同前),疗程6个月。HLA-B*13:01基因检测阳性、G6PD缺乏症等不适合MDT方案治疗的患者使用替代疗法,即视病情将氨苯砜更换为左氧氟沙星(每日400 mg)或克拉霉素(每日500 mg)治疗,疗程同氨苯砜;若患者要求按MDT方案治疗,予以确认并详细记录。随访8周并判断是否发生DHS。
1.2.3 诊断标准 DHS现有的诊断标准为改良Richardus标准[7]:①发热;②原皮疹加重或新发皮疹;③全身乏力和/或胃肠道症状和/或黄疸;④浅表淋巴结肿大(腋窝、腹股沟、下颌等);⑤肝功能异常(超过基线2倍)。符合两条或以上,排除麻风反应、其他疾病及药物不良反应,停用氨苯砜后不良反应消失。
1.2.4 回顾性分析2012年1月1日至2015年6月30日新发麻风患者的病历资料,计算广西麻风患者中DHS的基线发生率,并与2015年7月1日至2018年12月31日的数据进行比较。
1.2.5 统计学方法 采用SPSS 22.0统计软件进行,描述性资料用频数与百分比进行描述,率的比较用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 基本资料 2015年7月1日至2018年12月31日,广西新发现麻风患者127例,排除1例治疗前外迁的患者,共纳入126例患者进行研究,见表1。其中男90例(71.4%),女36例(28.6%);平均年龄(44.4±16.2)岁;壮族55例(43.7%)、汉族49例(38.9%)、瑶族19例(15.1%)、其他民族3例(2.4%);多菌型91例(72.2%),少菌型35例(27.8%)。
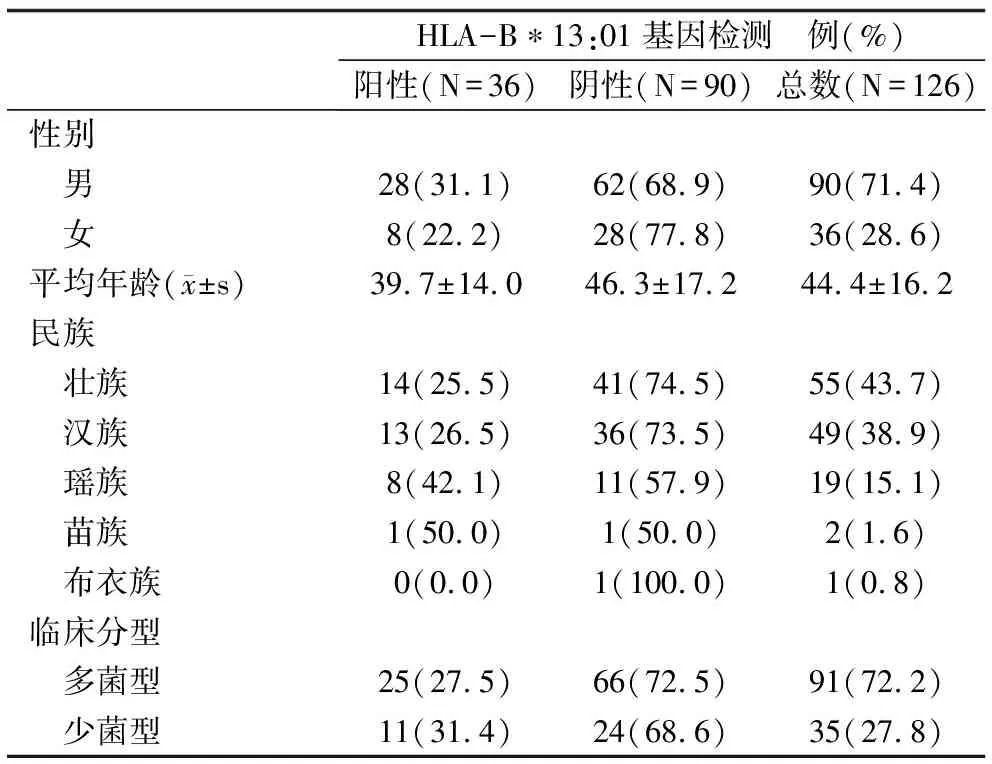
表1 纳入病例的基本信息和HLA-B*13:01基因检测结果
2.2 HLA-B*13:01基因检测结果和治疗情况 126例患者中,HLA-B*13:01基因检测阳性36例(28.6%),其中各个民族检测阳性率分别为:瑶族42.1%(8/19)、汉族26.5%(13/49)、壮族25.5%(14/55)、其他民族33.3%(1/3),见表1。36例检测阳性的患者中有6例起始予MDT方案治疗,其中5例在随访期间更换为替代方案治疗。
2.3 药物不良反应发生情况 在8周随访期间,有38例(30.2%)出现50种不良反应,其中HLA-B*13:01基因检测阳性的患者有11例(30.6%)出现16种不良反应,检测阴性的患者有27例(30.0%)出现34种不良反应,见表2。两组患者不良反应的发生总数(χ2=0.240,P=0.625)及单个不良反应的发生数(χ2=13.735,P=0.132)均无统计学差异。有7例患者出现不止1种不良反应(其中2例为起始予MDT治疗的HLA-B*13:01基因检测阳性的患者),但并没有患者符合DHS的诊断。
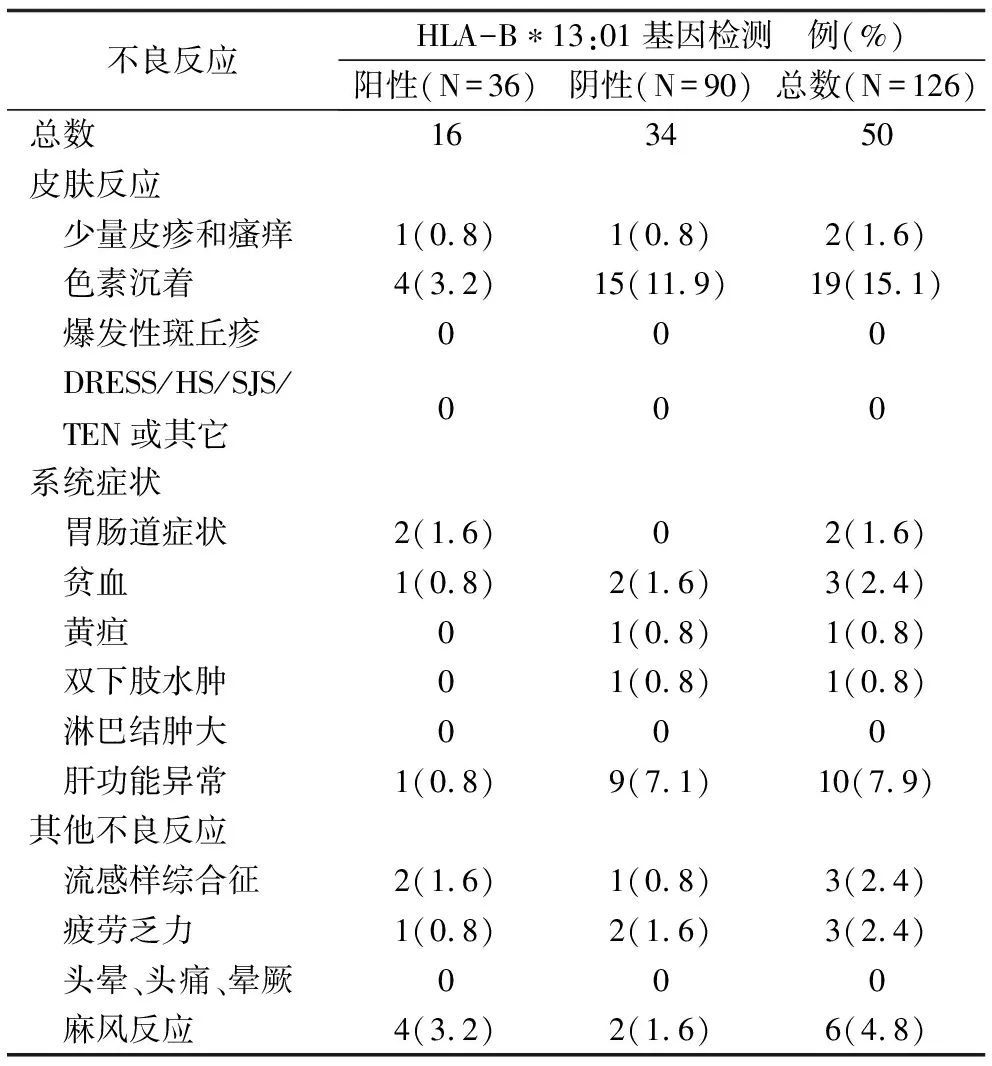
表2 纳入病例8周随访期间药物不良反应发生情况
注:诊断为麻风反应且对症治疗有效的患者不拆分症状。DRESS,drug reaction with eosinophilia and systemic symptoms,伴嗜酸粒细胞增多和系统症状的药疹;HSS, hypersensitivity syndrome,超敏反应综合征;SJS,Stevens-Johnson syndrome,Stevens-Johnson综合征;TEN,toxic epidermal necrolysis,中毒性表皮坏死松解症。
2.4 基线DHS发生率及统计比较 2012年1月1日至2015年6月30日,广西新发现麻风患者182例,排除随访时间不足8周的患者2例,共180例患者,其中8例(4.4%)发生DHS。而2015年7月1日至2018年12月31日纳入的126例患者中没有患者发生DHS。全面开展麻风易感基因检测预防DHS项目后前后DHS的发生率具有显著统计学差异(校正χ2=4.137,P=0.042)。
本项目纳入的126例患者中,HLA-B*13:01基因检测阳性者占28.6%,与刘红等[6]的研究24.3%接近,显著高于全国17.3%的平均水平(χ2=10.022,P=0.002)。检测阳性的患者中,汉族、壮族、瑶族的阳性率分别为26.5%、25.5%、42.1%,瑶族患者的阳性率最高,但几个民族间的阳性率差异没有统计学意义(均P>0.05);不同性别(χ2=0.996,P=0.318)、型别(χ2=0.194,P=0.660)的患者检测阳性率也没有统计学差异。在全国的研究当中,汉族、壮族、苗族、彝族的检测阳性率分别为14.2%、19.9%、38.6%、12.9%[6]。广西壮族麻风患者HLA-B*13:01基因携带率与全国壮族患者水平无明显差异(χ2=0.645,P=0.422),但汉族患者的携带率显著高于全国水平(χ2=5.629,P=0.018)[6]。有研究对贵州布依族、陕西汉族、西藏藏族和新疆维吾尔族的健康志愿者进行HLA-B*13:01基因分型,发现该基因携带率分别为11%、8%、1%、2%[8]。与之相比,广西汉族麻风患者的携带率明显高于陕西汉族志愿者(χ2=9.327,P=0.002);而本项目布依族患者仅有1例,无法进行比较。李焱等[9]对广东汉族人进行HLA-B基因多态性研究,发现HLA-B*13:01的表现频率为16.5%,低于本项目数据,但差异无明显统计学意义(χ2=3.132,P=0.077)。见表1、表3。
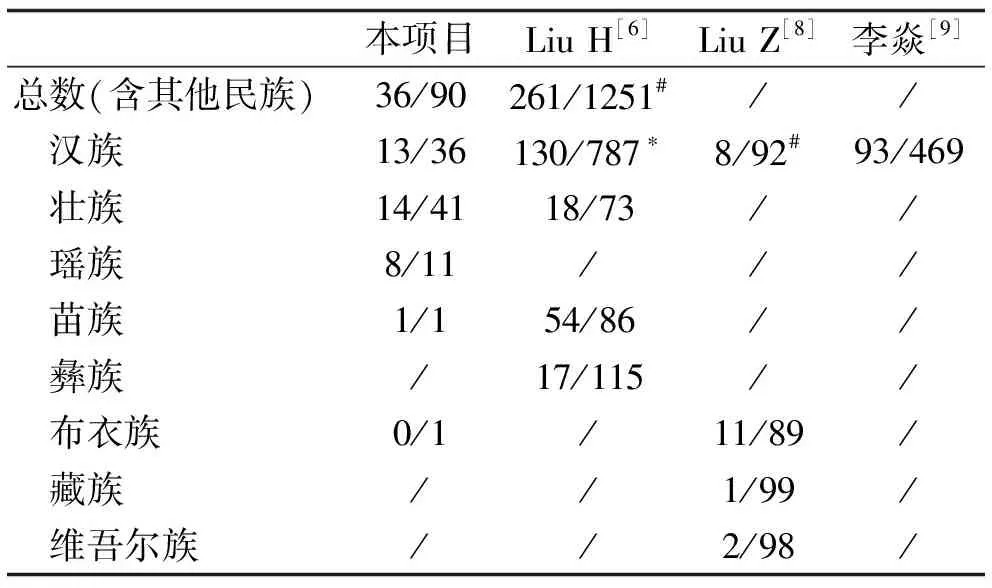
表3 本项目和既往文献HLA-B*13:01基因检测结果比较(阳性/阴性)
注:*本项目数据与之相比P<0.05;# 本项目数据与之相比P<0.01
3 讨论
本项目组对广西近年的新发现麻风患者进行研究,发现HLA-B*13:01基因阳性率显著高于全国平均水平,表明广西是HLA-B*13:01基因高携带地区。由于HLA-B*13:01基因为DHS的易感基因,这可能意味着广西DHS的发生风险高于全国平均水平[5]。广西不同民族的HLA-B*13:01基因阳性率的差异无统计学意义,这可能与各民族纳入病例数过少有关。从民族分类上看,广西壮族麻风患者HLA-B*13:01基因携带率与全国壮族患者水平无明显差异,但汉族麻风患者的携带率显著高于全国汉族患者水平和陕西健康志愿者水平,这可能与该基因南高北低的地域分布有关[6]。广西汉族麻风患者HLA-B*13:01基因携带率与邻近的广东汉族人脐带血大样本研究检测出的携带率有差异,但无显著统计学意义,这可能与样本量差距过大有关,也可能与该基因的地域分布有关。
随访期间,HLA-B*13:01基因检测阳性组和阴性组患者不良反应的发生总数及单种不良反应的发生数均无统计学差异。包含起始予MDT方案治疗的6例HLA-B*13:01基因检测阳性的患者在内的所有患者均未发生严重皮肤反应。这些不良反应被认为与麻风反应、其他疾病以及利福平、氯法齐明以及左氧氟沙星等替代药物有关,而与氨苯砜无关。结合诊断标准及其他研究,本项目组考虑以上患者均未发生DHS[10]。此外,1例HLA-B*13:01基因检测阳性的患者予MDT方案治疗完成并判愈,随访至今已有4年余,并未发生DHS。有学者认为无论HLA-B*13:01基因检测阳性与否均可起始试予MDT方案治疗。但由于目前该基因检测阳性又要求予MDT方案治疗的病例数过少,而DHS危害性大,本课题组认为该基因检测阳性的患者仍首先推荐替代方案治疗。
张福仁等[5]研究表明,HLA-B*13:01基因用于检测我国DHS风险时敏感性为85.5%,特异性为85.7%,该基因缺失可使DHS的风险由1.4%降至0.2%。泰国、韩国、日本等亚洲国家和地区的研究也表明HLA-B*13:01基因和DHS具有相关性,HLA-B*13:01基因是DHS易感基因的机制可能是氨苯砜与该基因抗原识别位点结合后改变了与后者结合的自身肽类,也可能是激活特异性细胞毒性T细胞引发了后续效应[11-14]。因此,理论上,对广西新发麻风患者进行疗前HLA-B*13:01基因检测,检测阳性的患者在MDT中剔除氨苯砜,将大大降低DHS的发生率。实际随访中并未发现有患者发生DHS,结果与基线DHS发生率比较有显著统计学差异,说明疗前HLA-B*13:01基因检测能显著降低广西DHS的发生率,结论与全国的研究相同[6]。本研究中广西HLA-B*13:01基因检测阳性率为28.6%,然而既往DHS发生率为4.4%,说明DHS的发生可能有其他因素的影响。有研究表明,除HLA-B*13:01外,HLA-DRB1的氨基酸变异也可能与DHS有关[15]。理论上HLA-B*13:01基因检测阴性的患者仍有可能发生DHS,但本项目并未观察到该现象,这可能与纳入病例数过少有关。由于近年广西麻风的发病率呈下降趋势,本项目组将继续对广西新发麻风病人进行进一步研究和随访。
综上所述,广西是HLA-B*13:01基因高携带地区,应用HLA-B*13:01基因检测预防DHS的发生是有效的。本项目组将继续扩大样本量进行进一步研究。
