吴茱萸中两种肝毒性成分吴茱萸新碱和二氢吴茱萸新碱的药代动力学研究*
2020-03-13孙向明温静
孙向明,宋 辉,胡 扬,温静,薛 屹,邹 翔**
(1. 哈尔滨商业大学药学院 哈尔滨 150076;2. 哈尔滨商业大学药物工程技术研究中心 哈尔滨 150076)
中药吴茱萸具有散寒止痛、疏肝下气、温中燥湿的功效,通常被用于治疗厥阴头痛、经行腹痛、脘腹胀痛、呕吐吞酸、寒湿脚气、高血压等疾病,其主要化学成分有生物碱类、黄酮类、三萜类等[1-4],生物碱类是主要的有效成分,具有抗动脉粥样硬化、抗肿瘤等生物活性[5-7]。在历代本草中,吴茱萸被列为中品,记载有毒或有小毒。据报道,有人因大剂量服用吴茱萸出现头痛、胸闷、视物模糊、剧烈腹痛等症状[8]。已有学者指出,肝脏是其毒性靶器官之一[9]。目前,吴茱萸的肝毒性已引起国内外学者的广泛关注[10-11],相关的研究陆续展开。动物研究表明,吴茱萸的水提物、醇提物和挥发油均可引起肝毒性,并呈一定的“量-时-毒”关系,其中挥发油的肝毒性作用机制可能与氧化损伤有关[9,12-14]。本课题组前期实验已证明吴茱萸的50%乙醇提取物具有肝毒性,并采用UPLC-Q-TOF MS 技术对吴茱萸的50%乙醇提取物化学成分及血中移行成分进行了结构表征[15],通过谱效相关性研究发现以吴茱萸新碱和二氢吴茱萸新碱为代表的喹诺酮类生物碱是其潜在的肝毒性成分[16]。而吴茱萸中喹诺酮类生物碱同时也具有抗菌消炎等作用,既是有毒成分也是有效成分。为了临床合理的应用吴茱萸及适当的毒性预警,本研究在前期研究成果的基础上,采用UPLC-TQD-MS/MS 技术,针对已筛选出的两种吴茱萸肝毒性成分(吴茱萸新碱和二氢吴茱萸新碱)进行大鼠口服吴茱萸肝毒性部位后的代谢动力学研究,旨在分析毒性剂量下,两种肝毒性成分的体内作用规律,表征吴茱萸肝毒性成分的动力学特征,为指导吴茱萸的临床合理、安全使用提供科学依据。
1 材料
ACQUITY UPLC I-Class 超高效液相色谱与Xevo TQD 三重四级杆质谱联用仪:美国Waters 公司产品;GENIUS N118LA 氮气发生器:英国PEAK 公司产品;Allegra 64R 低温高速离心机:美国贝克曼库尔有限公司产品。
吴茱萸药材:购自哈尔滨三棵树药材市场,由哈尔滨商业大学药学院曲中原教授鉴定为吴茱萸Evodia rutaecarpa (Juss.)Benth;吴茱萸新碱、二氢吴茱萸新碱对照品(上海依赫生物科技有限公司,纯度>98%,批号YH-201604);内标地西泮(上海依赫生物科技有限公司,纯度> 98%,批号YH-201605);甲醇(德国赛默飞世尔公司,质谱纯,批号:20160311);乙腈(德国赛默飞世尔公司,质谱纯,批号20160410);纯净水(屈臣氏,批号20161205);甲酸(色谱纯,上海科锐实业有限公司,批号20160509)。
SPF 级雄性Wistar 大鼠体重(220 ± 20)g,由哈尔滨医科大学实验动物学部提供,许可证号:SCXK-(黑)2013-001。
2 方法
2.1 灌胃药液的制备
采用参考文献[16]“1.2.1”项下方法制备大鼠的灌胃药液。
2.2 给药方案和血浆样品的采集
取雄性大鼠8 只,给药前称重,按照25 g·kg-1·d-1(以生药计)的剂量灌胃给药,灌胃体积为25 mL·kg-1,每天一次,连续给药14 d。最后一次给药前禁食不禁水12 h,于 给 药 后5 min、10 min、20 min、30 min、45 min、1 h、2 h、4 h、6 h、8 h、12 h由大鼠眼眶静脉丛取血约0.3 mL 至肝素化的1.5 mL EP 管中,5000 r·min-1离心10 min,分离上层血浆,于-20℃冰箱中保存待测。
2.3 色谱条件
色谱柱:ACQUITY UPLC® BEH C18(1.7 µm,2.1 × 100 mm);保护柱:ACQUITY UPLC® BEH C18(1.7µm,2.1×5 mm);柱温:40℃;流动相:乙腈-0.2%甲酸水溶液(75∶25);流速:0.25 mL/min;进样量:5µL。
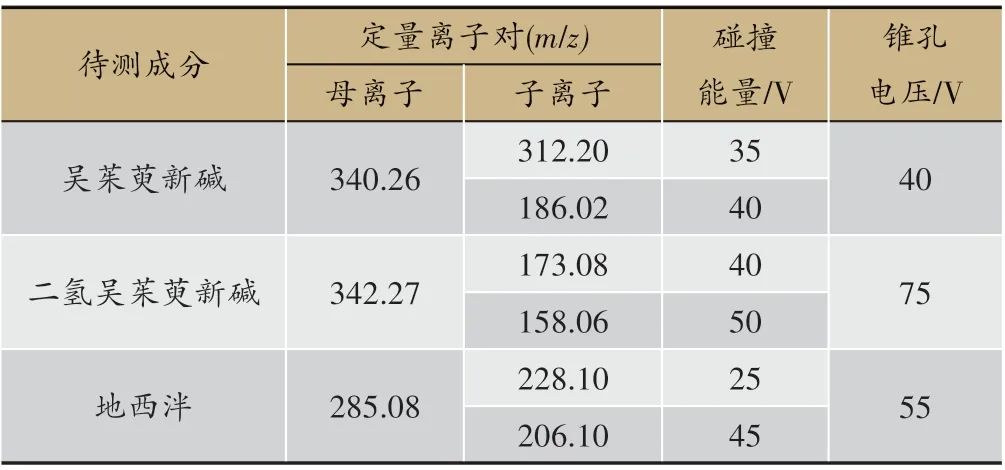
表1 待测成分的定量离子对和参数设置
2.4 质谱条件
离子化模式:大气压电喷雾正离子模式(ESI+);毛细管电压:3.0 kV;锥孔电压:55 V;源温度:350℃;雾化气温度:50℃;雾化气流速:650 L/h;锥孔气流速:50 L/h;采用多反应监测模式(MRM)扫描,待测成分的定量离子对及参数设置,见表1。
2.5 溶液的配制
2.5.1 系列混合标准溶液的配制
精密称取吴茱萸新碱和二氢吴茱萸新碱标准品适量,80%甲醇稀释成浓度为5µg/mL 的储备液备用,分别精密吸取吴茱萸新碱和二氢吴茱萸新碱储备液适量,用80%甲醇定量稀释成浓度为1 ng/mL、20 ng/mL、100 ng/mL、200 ng/mL、500 ng/mL、1000 ng/mL、2500 ng/mL的系列标准溶液,置冰箱4 ℃冷藏,备用。
2.5.2 质控标准溶液的配制
精密吸取吴茱萸新碱和二氢吴茱萸新碱储备液适量,用80%甲醇定量稀释成浓度分别为1 ng/mL、5 ng/mL、200 ng/mL、2000 ng/mL 的定量下限、低、中和高浓度质控标准溶液,置冰箱4℃冷藏,备用。
2.5.3 内标溶液的配制
精密称取地西泮适量,加适量甲醇溶解并稀释,配制成浓度为200 ng/mL 的内标储备液,置冰箱4℃冷藏,备用。
2.6 血浆样品预处理方法的考察
分别采用乙酸乙酯萃取法[17]、二氯甲烷萃取法、甲醇沉淀蛋白法进行血浆样品的预处理,比较不同预处理方法对吴茱萸新碱和二氢吴茱萸新碱提取回收率的影响。
(1)取10µL混标(500 ng/mL),40℃下氮气吹干溶剂,精密加入空白血浆100 µL,制得含混标50 ng/mL的血浆样本,加入10 µL 内标溶液,涡旋混合30 s,分别加入乙酸乙酯、二氯甲烷、甲醇各660µL,涡旋混合3 min,14000 r·min-1低温高速离心10 min,分别取乙酸乙酯和甲醇的上清液,取二氯甲烷的下层清液在40℃下氮气吹干。测定前向残渣中加入100µL 80%甲醇复溶,涡旋1 min,14000 r·min-1低温高速离心20 min,取上清进样分析。记录待测成分与内标的峰面积,计算二者峰面积之比,记为A。
(2)取10µL 内标液,40 ℃下氮气下吹干甲醇,精密加入100 µL 空白血浆,涡旋混合30 s,分别加入乙酸乙酯、二氯甲烷、甲醇各660 µL,涡旋混合3 min,14000 r·min-1低温高速离心10 min,分别取乙酸乙酯和甲醇的上清液,取二氯甲烷的下层清液在40 ℃下氮气吹干。再向残渣中加入100 µL 混合标准品溶液(50 ng/mL),涡旋混匀1 min,14000 r·min-1低温高速离心20 min,取上清进样分析,记录待测成分与内标的峰面积,计算二者峰面积之比,记为B。以A/B 计算提取回收率。
2.7 方法学验证
2.7.1 方法专属性试验
精密移取大鼠空白血浆100µL,按“2.6”(1)项下筛选得到的血浆预处理方法操作(不加混标和内标溶液),得空白血浆样品的色谱图;以筛选得到的血浆预处理方法按照“2.6”(1)项下的操作步骤操作,得模拟血浆样品色谱图;取大鼠灌胃给药0.5 h 后的血浆样品,加入内标溶液10µL,其余步骤按“2.6”(1)项下筛选得到的方法操作,得给药后血浆样品色谱图。对比上述色谱图,观察内源性物质和代谢物是否干扰血浆中吴茱萸新碱、二氢吴茱萸新碱、地西泮的测定。
2.7.2 线性关系考察与定量下限
精密移取系列混合标准溶液10 µL,40 ℃下氮气吹干溶剂,精密加入大鼠空白血浆100 µL,制成相当于吴茱萸新碱和二氢吴茱萸新碱0.1 ng/mL、2 ng/mL、10 ng/mL、20 ng/mL、50 ng/mL、100 ng/mL、250 ng/mL的模拟血浆标准样品,加入10 µL 内标溶液,涡旋混合30 s,其余按“2.6”(1)项下筛选得到的方法操作,进行UPLC-MS/MS 分析,记录待测成分及内标的峰面积,每一个浓度的标准品溶液分析三个样本。以待测成分浓度(ng/mL)为横坐标X,待测成分与内标的峰面积比值为纵坐标Y,绘制标准曲线,采用加权(w = 1/x2)最小二乘法进行回归运算,得到回归方程。以样品峰与基线的信噪比S/N = 10 时的样品浓度为定量下限(LOQ)。
2.7.3 准确度与精密度考察
精密移取质控标准溶液10 µL,40℃下氮气吹干溶剂,精密加入100 µL 大鼠空白血浆,加入10 µL 内标溶液,涡旋混合30 s,其余按“2.6”(1)项下筛选得到的方法操作,得定量下限、低、中和高浓度质控样品,浓度分别为0.1 ng/mL、0.5 ng/mL、20 ng/mL、200 ng/mL。每一浓度样品平行制备6 份并进行测定,分别计算日内与日间的准确度、精密度。
2.7.4 基质效应与提取回收率
精密吸取低、中、高浓度的质控标准溶液10 µL,分别加入内标液10µL,以80%甲醇稀释至100µL,混匀后进样分析,记录待测成分与内标的峰面积,二者峰面积比计为Al;取100 µL 大鼠空白血浆,按“2.6”(1)项下筛选得到的方法加入内标之后的步骤处理,测定前加入内标液10µL和低、中、高浓度的质控标准溶液10µL,以80%甲醇稀释至100µL,混匀后进样分析,每个浓度测定6份样品,记录待测成分与内标的峰面积,计算二者峰面积之比计为A2,以A2/A1计算基质效应。
取低、中、高浓度的质控标准溶液各6 份,每份10µL,加入10µL 内标液,氮气吹干溶剂,分别加入空白血浆100µL,按“2.6”(1)项下筛选得到的方法加入内标之后的步骤处理,进样分析,测定待测成分与内标的峰面积,二者峰面积比计为A3,以A3/A2计算回收率。
2.7.5 稳定性考察
室温稳定性考察:分别取大鼠空白血浆100 µL,分别加入内标液10µL和低、中、高浓度的质控标准溶液10µL,按“2.6”(1)项下筛选得到的方法加入内标之后的步骤处理,室温放置6 h,每一浓度进行6 样本分析,考察血浆样品室温放置6 h的稳定性。
冷冻稳定性考察:取低、中、高三个浓度质控标准溶液,每一浓度平行制备6 份,-20℃冻存7 d,考察血浆样品冻存7 d的稳定性。
三次冻融稳定性考察:取低、中、高三个浓度的质控标准溶液,每一浓度平行制备6 份,-20℃存放24 h,取出至室温放置使自然解冻,当溶解完全后,取样进行分析,然后再把样品放回冷冻状态保持24 h 以上,如此解冻-冷冻重复循环三次,考察血浆样品反复冻融三次后的稳定性。
表2 不同预处理方法提取回收率结果(±s,n = 3)

表2 不同预处理方法提取回收率结果(±s,n = 3)
处理方法乙酸乙酯萃取法二氯甲烷萃取法甲醇沉淀蛋白法提取回收率/%吴茱萸新碱91.78±4.32 79.63±5.87 58.81±7.24二氢吴茱萸新碱92.43±3.15 75.92±4.06 62.59±6.59
2.8 样品的测定及数据分析
将采集的大鼠血浆样品按“2.6”项下筛选出的血浆样品的预处理方法处理后,进行UPLC-MS/MS 分析测定。采用PK Solver 2.0 软件非房室模型法进行分析,并进行相应参数的估算。
3 结果
3.1 血浆样品预处理方法的考察
实验比较了乙酸乙酯萃取法、二氯甲烷萃取法、甲醇沉淀蛋白法对血浆样品的预处理情况。三种方法对吴茱萸新碱和二氢吴茱萸新碱提取回收率结果见表2。
研究结果表明,采用乙酸乙酯为萃取溶剂时,吴茱萸新碱和二氢吴茱萸新碱的回收率均在90%以上,显著高于二氯甲烷萃取法和甲醇沉淀蛋白法,故选取乙酸乙酯萃取法作为本实验中血浆样品的预处理方法。
3.2 分析方法学考察
3.2.1 方法专属性
在上述试验条件下,可见各待测成分离子化后产生的准分子离子峰[M+H]+,在2.379 min 时可见吴茱萸新碱的m/z 340.26 峰,在3.459 min 时可见二氢吴茱萸新碱的m/z 342.27 峰,在1.316 min 时可见内标地西泮的m/z 285.08 峰,各成分的质谱图和化学结构,如图1所示。图2 进一步比较了空白血浆样品、加入标准品和内标的模拟血浆样品以及给药0.5 h 后的血浆样品中吴茱萸新碱(WZYXJ)二氢吴茱萸新碱(EQWZYXJ)、地西泮(DXP)的多反应监测(MRM)离子色谱图。
结果表明:在实验所采用的色谱和质谱条件下,血浆中的内源性物质和代谢产物对吴茱萸新碱、二氢吴茱萸新碱、地西泮的测定无干扰,方法专属性良好。
3.2.2 标准曲线与定量限
测定血浆中吴茱萸新碱和二氢吴茱萸新碱的标准曲线回归方程、相关系数r以及定量下限见表3。
研究结果表明:血浆中两种成分在0.1 ~250 ng/mL 的浓度范围内线性关系良好,相关系数r 都大于0.99,符合2015 版药典关于生物样品测定的要求。吴茱萸新碱和二氢吴茱萸新碱定量下限在0.1 ng/mL 可被有效检测。
3.2.3 准确度与精密度考察
按“2.7.3”项下操作,定量下限、低、中和高浓度质控样品的日内和日间准确度、精密度结果见表4。
结果显示:两种成分的日内和日间准确度均在标示值的± 15%之内,精密度的RSD 值均小于15%,表明方法准确度和仪器精密度良好,方法稳定可行。
3.2.4 基质效应与提取回收率
吴茱萸新碱和二氢吴茱萸新碱的基质效应与提取回收率,如表5、表6所示,两种成分的基质效应和提取回收率均在80%~120%之间。
结果表明:本实验所采用的方法提取回收率较高,并且没有明显的基质效应,符合生物样品的分析要求。
3.2.5 稳定性考察
低、中、高三个浓度(0.5 ng/mL、20 ng/mL、200 ng/mL)的质控标准溶液在不同条件下的稳定性结果见表7。
结果显示,将血浆样品室温放置6 h,-20℃冷冻7 d,三次冻融操作后吴茱萸新碱和二氢吴茱萸新碱实测浓度的RSD 值均小于10%,表明两种成分在上述环境下的稳定性良好,应尽量减少冻融次数。
3.3 样品的测定及数据分析
采用已建立的UPLC-TQD-MS/MS 方法,测定各采血时间点的血药浓度,得到两种成分在大鼠血浆中的药时曲线(见图3)和主要的代谢动力学参数(见表8)。
结果表明:给大鼠灌胃吴茱萸50%乙醇提取物后,吴茱萸新碱和二氢吴茱萸新碱在体内被迅速吸收,血浆中的平均达峰时间分别为0.54±0.10 h、0.58±0.13 h,平均峰浓度分别为36.38±9.89 ng/mL、22.07±8.34 ng/mL,药时曲线下面积分别为119.8±29.8 ng/mL、67.25±21.12 ng/mL·h,平均滞留时间为4.68±0.98 h、4.80 ± 1.02 h,表 观 分 布 容 积 分 别 为0.313 L/kg、0.682 L/kg。二者的清除率分别为0.078 L/h/kg、0.136 L/h/kg,半 衰 期 分 别 为2.80 ± 0.61 h 和3.49 ±0.74 h,经过约4个半衰期,血中残留量大幅降低,说明在体内蓄积不明显。
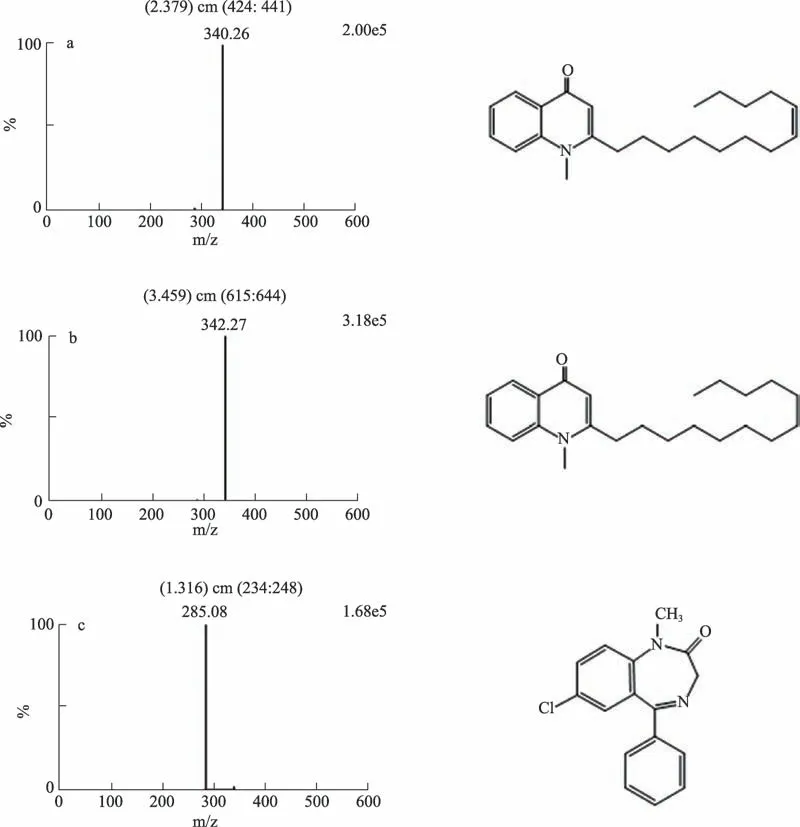
图1 吴茱萸新碱(a)、二氢吴茱萸新碱(b)和地西泮(c)的质谱图及化学结构图
4 讨论
有关吴茱萸新碱和二氢吴茱萸新碱药代动力学的研究报道较少,毒代动力学研究尚未见报道。1991年日本的Kano Y 等[18]在文献中称,静脉注射吴茱萸新碱后,其药代动力学呈单室模型。剂量在75 mg/kg时,吴茱萸新碱在血浆中可线性消除。吴茱萸新碱的总血浆清除率、分布容积和半衰期分别为60 mL/min/kg、3.2 L/kg 和0.6 h。在本研究中,为完全的考察在致肝毒性剂量下,吴茱萸中的两种潜在肝毒性成分吴茱萸新碱和二氢吴茱萸新碱的药动学特征,连续给大鼠灌胃吴茱萸50%乙醇提取物14 d 后,监测不同时间点大鼠血浆中吴茱萸新碱和二氢吴茱萸新碱的含量,采用PK Solver 软件计算两种成分的代谢动力学统计矩参数。结果表明,吴茱萸新碱的各参数与文献中静脉注射吴茱萸新碱单体的参数差距较大,提示不同给药方式及给药剂量,该成分的药动学性质发生了改变。
一般情况下,药物的达峰时间越短,吸收速度越快,则其峰浓度越高,毒性也越大。从药动学数据来看,两个目标化合物的药动学参数比较接近,吸收均较快,在给药后的30 min左右达到最大血药浓度,平均峰浓度分别为36.38±9.89 ng/mL、22.07±8.34 ng/mL,相对于给药剂量而言并不低,符合对吴茱萸为小毒中药的描述。二者的半衰期比较接近,在2.80 ~3.49 h范围内,说明两个成分的整体药代谢动力学行为相近,初步反映了吴茱萸肝毒性成分在大鼠体内的作用过程。表观分布容积和血浆清除率可评价重复给药其毒性在机体内是否有蓄积性,表观分布容积越小,血浆清除率越高,说明药物排泄越快,在体内滞留时间越短。吴茱萸新碱和二氢吴茱萸新碱的表观分布容积分别为0.313 L/kg、0.682 L/kg,清除率分别为0.078 L/h/kg、0.136 L/h/kg,可以认为在其14 d 的给药期内,大鼠血液中并无明显的蓄积情况发生。
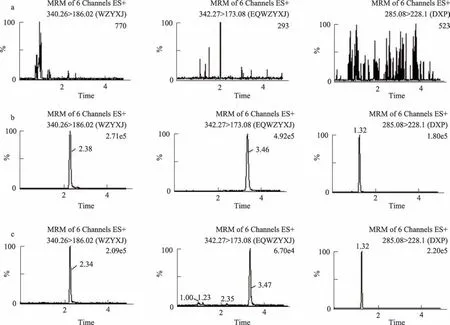
图2 空白血浆样品(a)、模拟血浆样品(b)和给予吴茱萸肝毒性部位0.5 h后的血浆样品(c)MRM离子色谱图
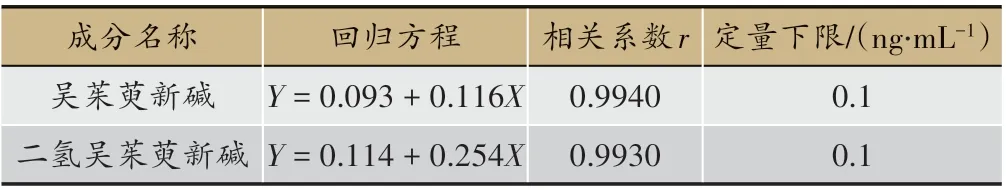
表3 两种成分的回归方程、相关系数r及定量下限
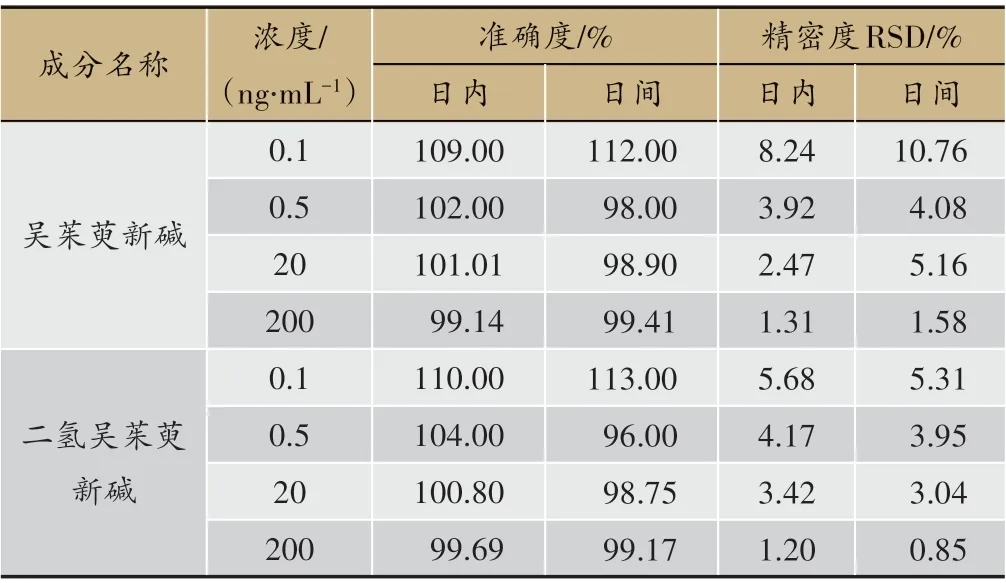
表4 QC样品的准确度、精密度测定结果(n = 6)

表5 吴茱萸新碱的基质效应和提取回收率(n = 6)
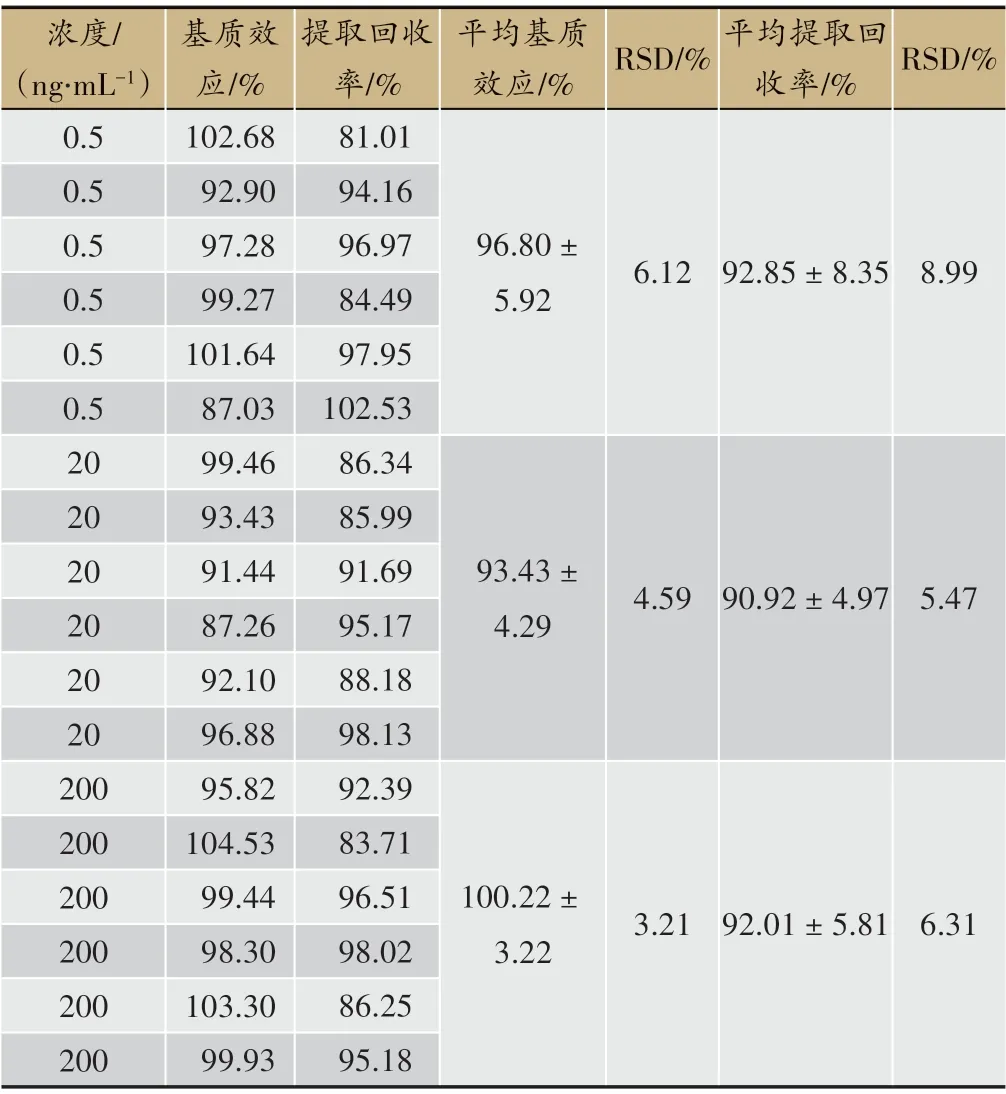
表6 二氢吴茱萸新碱的基质效应和提取回收率(n = 6)
表7 质控标准溶液稳定性测定结果(±s,n = 6)

表7 质控标准溶液稳定性测定结果(±s,n = 6)
条件室温6 h冷冻7 d冻融循环3次浓度/(ng⋅mL-1)0.5 20 200 0.5 20 200 0.5 20 200吴茱萸新碱实测浓度(ng⋅mL-1)0.49±0.03 19.87±0.48 197.96±1.88 0.50±0.02 19.85±0.64 199.23±2.45 0.47±0.03 19.16±1.50 197.93±3.05 RSD/%6.12 2.42 0.95 4.01 3.22 1.23 6.38 7.83 1.54二氢吴茱萸新碱实测浓度(ng⋅mL-1)0.49±0.02 19.80±0.65 198.02±2.43 0.48±0.02 19.49±0.62 199.45±1.31 0.47±0.02 18.97±1.82 196.34±5.11 RSD/%4.07 3.28 1.23 5.00 3.18 0.66 4.26 9.59 2.60

图3 口服吴茱萸肝毒性部位后大鼠体内的吴茱萸新碱、二氢吴茱萸新碱药时曲线(±s,n=8)
表8 吴茱萸新碱、二氢吴茱萸新碱的代谢动力学参数±s,n = 8)
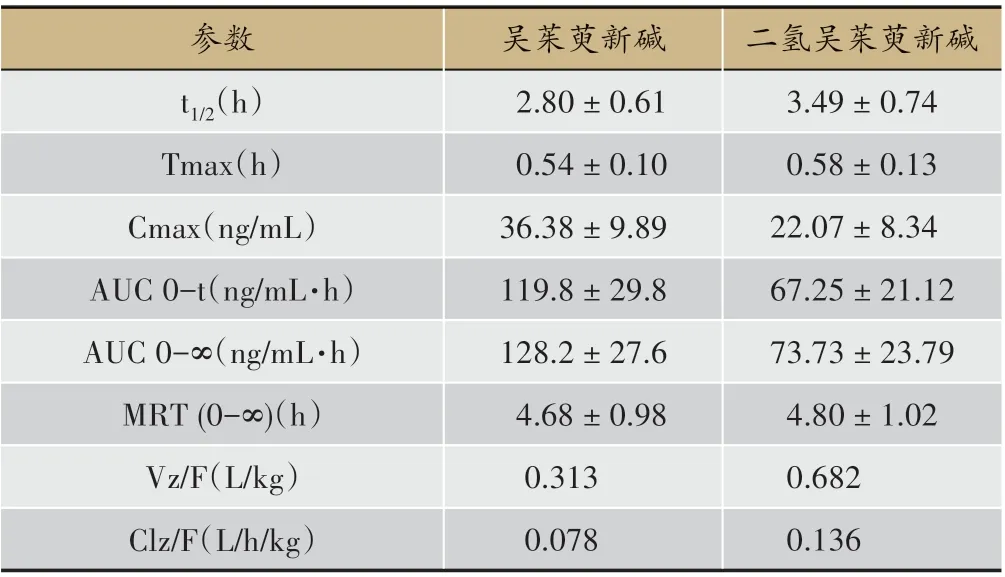
表8 吴茱萸新碱、二氢吴茱萸新碱的代谢动力学参数±s,n = 8)
参数t1/2(h)Tmax(h)Cmax(ng/mL)AUC 0-t(ng/mL·h)AUC 0-∞(ng/mL·h)MRT(0-∞)(h)Vz/F(L/kg)Clz/F(L/h/kg)吴茱萸新碱2.80±0.61 0.54±0.10 36.38±9.89 119.8±29.8 128.2±27.6 4.68±0.98 0.313 0.078二氢吴茱萸新碱3.49±0.74 0.58±0.13 22.07±8.34 67.25±21.12 73.73±23.79 4.80±1.02 0.682 0.136
5 结论
本课题组研究了大鼠口服吴茱萸致肝毒性后,两种喹诺酮类生物碱吴茱萸新碱和二氢吴茱萸新碱在大鼠体内的代谢动力学行为。首次建立了一个快速、准确、灵敏的UPLC-TQD/MS 分析方法,用以同时测定大鼠血浆中的吴茱萸新碱和二氢吴茱萸新碱,并进行了方法学验证。血浆中内源性物质及代谢物对这两种成分及内标的测定无干扰,且分析方法快速、灵敏,适用于血液生物样品中吴茱萸新碱和二氢吴茱萸新碱的测定。目标成分的药动学参数提示其具有一定的毒性,但并未在体内发生蓄积。
