基于Akt/ERK探讨丹蒌片对主动脉平滑肌细胞增殖、迁移和凋亡的影响*
2020-03-13司春婴孙文博刘俊呈陈玉善解金红关怀敏
司春婴,王 贺,孙文博,刘俊呈,陈玉善,解金红,关怀敏**
(1. 河南中医药大学第一临床医学院 郑州 450000;2. 河南中医药大学第一附属医院心脏中心 郑州 450000)
《中国心血管病报告2018》[1]数据显示,目前我国冠心病死亡率仍呈上升趋势,防治仍然刻不容缓。经皮冠脉介入治疗(percutaneous transluminal coronary intervention,PCI)是目前冠心病首要治疗方式,但术后仍有10%-30% 支架内再狭窄(in-stent re-stenosis,IRS)发生率,导致手术失败。其原因多与血栓形成、炎症反应、内皮受损、中膜平滑肌细胞过度增殖、内皮祖细胞的分化迁移、支架断裂或贴壁不良等[2-3]。其中冠脉血管平滑肌细胞(vascular smooth muscle cell,VSMC)的过度增殖、异常迁移和凋亡受阻引起大量细胞外基质(extracellular matrix,ECM)合成和血管壁脂质沉积是冠心病PCI 术后IRS 的首要原因[4]。因此,抑制VSMC 过度增殖、迁移,促进其凋亡,是预防IRS 的关键所在。目前,现代医学对IRS 的防治主要有支架治疗、基因治疗、血管内放射治疗和口服药物治疗等几个方面,但治疗效果不尽如人意,仍有部分病人反复发生IRS,使得现代医学对IRS的防治遇到瓶颈。中医药认为,PCI术后IRS仍属“胸痹”“真心痛”范畴,“本虚标实”仍为其基本病机,“痰瘀”仍为其主要证型,“化痰活血”为其主要治则。因此,本研究通过建立Hcy 诱导兔主动脉平滑肌细胞增殖的离体模型,观察“化痰活血”代表药物丹蒌片对兔主动脉平滑肌细胞增殖、迁移及其凋亡的作用,并探讨其可能的分子生物学机制,从而为临床防治冠心病PCI 术后IRS 提供理论依据及新的治疗思路。
1 材料与方法
1.1 细胞来源及药品试剂
本实验用大兔原代主动脉平滑肌细胞(RASMC),购置于武汉原生原代(PriCells)生物医药科技有限公司(货号:RAB-CELL-0011)。本研究所用药品为吉林康乃尔药业有限公司生产的丹蒌片原粉和阿斯利康制药有限公司生产的瑞舒伐他汀钙片(商品名:可定;批号:124862)。研究所需Cell Titer-GloTM购于美国Promega公司(批号:G7570),同型半胱氨酸(Hcy)购于Sigma 公司(批号:69453,纯度≥98%),p-Akt 抗体、p-ERK 抗体、β-actin 抗体及二抗均购于Cell Signaling Technology公司,研究用FBS、DMEM培养基、胰酶购于美 国GIBCO 公 司,Transwell 共 培 养 体 系(Corning公司)。
1.2 实验方法
1.2.1 细胞培养与传代
RASMC 由Pricell 公司提供,倒置相差显微镜观察,培养的细胞多数呈长梭形,核大,DAPI染色细胞核呈蓝色,细胞质呈现绿色,可见明显的肌丝纤维。经IHC 鉴定,胞浆内α-SMA 阳性表达率超过98%,可确定为RASMC。细胞培养箱参数设为37℃、5%CO2浓度,于该环境下孵育RASMC,每日生长情况于倒置显微镜下进行观察并及时换液,待RASMC 生长至70%-80%培养瓶底时进行传代,取第3-6 代细胞行后续实验。
1.2.2 含药血清制备
雄性健康新西兰大白兔12只(购置于山东鲁抗医药股份有限公司,批号SCXK 鲁20130001),体重3.0±0.5 kg,适应性喂养1 周后随机分4 组:空白组、丹蒌片组、瑞舒伐他汀(可定)组和丹蒌片联合瑞舒伐他汀(混合)组,每组3只。按人临床用药等效剂量,以体表面积换算公式进行换算,后三组分别灌胃丹蒌片原粉、可定及丹蒌片原粉联合可定,空白组灌胃等体积生理盐水,每天灌胃1次,连续5天,各组于末次灌胃3小时后腹主动脉采血,离心并灭活后置于-80℃冰箱冻存备用。
1.2.3 细胞分组及药物干预
取生长状态良好的RASMC 细胞胰酶消化,制备单细胞悬液,分别调整细胞浓度为1×104/mL,1×105/mL 和2 × 105/mL,分别种于96 孔板(每孔200 µL)、Transwell 上室(每孔200µL)和6 孔板(每孔1 mL)中,继续培养12 h 待所有细胞完全贴壁,无血清同步化24 h 后,将细胞分为空白组、Hcy 组、丹蒌片组、瑞舒伐他汀(可定)组、丹蒌片联合瑞舒伐他汀(混合)组。除空白组外,其余各组均加入浓度为10-4mol/L Hcy;同时,后三组分别加入相应含药血清,培养24 h 后收集细胞。
1.2.4 Cell Titer-Glo法测细胞增殖
从细胞培养箱中取出96孔板,吸取各组上层细胞培养液,每孔加入工作液50 µL,震荡1-2 min 使细胞完全裂解。于室温避光放置10 min,待光信号稳定后,上机读取并记录光信号强度。
1.2.5 Transwell法测细胞迁移
取孔径8 µm 的24 孔共培养迁移小室,按上述分组向各组小室加入200µL无血清DMEM 培养基,于细胞温箱中湿化2 h,弃上层培养基。胰酶消化后完全培养基重悬细胞,调整密度至1×105/mL,于小室上层加入单细胞悬液200µL/孔。空白组小室下层加正常兔血清培养基600µL,Hcy 组小室下层加含Hcy10-4mol/L 的等体积正常兔血清培养基,其余各组在Hcy10-4mol/L 基础上加等体积相应含药血清。于温箱中培养24 h,取上室弃上清,棉签擦去上室内侧细胞,保留下侧细胞,PBS 润洗3 次,于4%多聚甲醛中固定细胞20 min,PBS 润洗3 次,0.1%结晶紫溶液染色15 min,再用PBS 洗涤3 次后倒置显微镜下随机取5 个视野观察计数,取其平均值。
1.2.6 流式细胞仪测细胞凋亡率
各组细胞用PBS 洗涤,胰蛋白酶消化后转移至离心管,加培养液,混匀,1000 r/min离心,弃上清,加PBS重悬细胞,调整细胞浓度为106/mL,取0.5 mL 细胞悬液,1000 r/min 离心4 min,弃上清,加0.5 mL Binding Bufer,重悬细胞,加1µL 荧光标记的Annexin V 试剂,混匀,室温下避光孵育20 min,加入PI 5 µL,混匀后4℃下避光孵育5 min,加入Binding Bufer 500µL,用流式细胞仪检测各组细胞凋亡率。
1.2.7 Western blot测信号通路蛋白表达
提取各组处理后细胞的总蛋白质,用BCA 法检测蛋白浓度,以β-actin 作为内参,SDS-PAGE 电泳,转膜,将膜用TBS 缓冲盐水从下向上浸湿后,移至含有5%脱脂奶粉的封闭液器皿中,室温脱色摇床上摇动封闭1 h 后,加入1∶5 000 比例稀释的一抗,37℃孵育12 h,平盘中加入TBST 放在脱色摇床上洗3 次,每次10 min。同样,步骤加入二抗,避光、室温、缓摇床孵育50 min,洗涤后用化学发光成像仪显影,使用Image J分析条带灰度值。
1.3 统计学分析
采用SPSS19.0 统计软件分析,计量资料以均数±标准差(±s)表示,多组间比较时行方差齐性检验,若方差齐则以one-way ANOVA 的LSD 法检验;若方差不齐用Dunnet’T3 法检验。两组间比较采用成组t 检验。以P<0.01或P<0.05为差异有统计学意义。
2 结果
2.1 各组RASMC细胞增殖结果比较
与空白组比较,Hcy 组细胞明显增殖(P < 0.01);与Hcy 组比较,三个用药组细胞增殖显著下降(P <0.01),且混合组细胞增殖明显低于丹蒌片组和可定组(P < 0.01);较丹蒌片组,可定组增殖虽有所减少,但差异无统计学意义(P>0.05)(见表1、图1)。
2.2 各组RASMC细胞迁移结果比较
与空白组比较,Hcy 组RASMC 迁移数明显增加(P <0.01);与Hcy 组比较,三个用药组细胞迁移数显著减少(P < 0.01),且混合组细胞迁移数明显低于丹蒌片组和可定组(P<0.01);与丹蒌片组比较,可定组细胞迁移数明显减少(P<0.01)(见图2、图3)。
表1 各组RASMC细胞增殖活力比较(±s)

表1 各组RASMC细胞增殖活力比较(±s)
注:*与空白组比较,P < 0.01;#与Hcy 组比较,P < 0.01;▽与混合组比较,P<0.01
组别空白组Hcy组丹蒌片组可定组混合组发光强度(RLU)1249415.67±61902.3 1684822.00±59114.14*668649.33±73205.79#▽557238.33±18008.98#▽306976.33±38836.49#
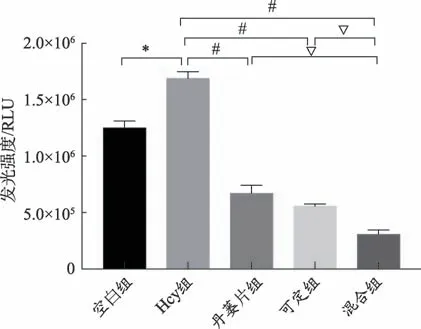
图1 各组RASMC细胞增殖活力比较
2.3 各组RASMC细胞凋亡率比较
细胞凋亡结果显示:与空白组比较,Hcy组细胞凋亡明显减少(P <0.01);与Hcy 组比较,三个用药组细胞凋亡明显增加(P < 0.01),且混合组细胞凋亡显著高于丹蒌片组和可定组(P<0.01);与丹蒌片组比较,可定组细胞凋亡明显增加(P<0.05)(见表2、图4)。
2.4 各组RASMC细胞信号通路蛋白表达量比较
结果显示:①各组非磷酸化Akt 蛋白和非磷酸化ERK 蛋白的表达均无明显变化(P > 0.05);②p-Akt:与空白组比较,Hcy 组p-Akt 蛋白表达显著上调(P <0.01);与Hcy组比较,三个用药组p-Akt蛋白表达明显下调(P<0.01),且混合组p-Akt显著低于丹蒌片组和可定组(P < 0.01);与丹蒌片组比较,可定组p-Akt 表达进一步减少,但差异无统计学意义(P>0.05);③p-ERK:与空白组比较,Hcy 组p-ERK 蛋白表达显著上调(P<0.01);与Hcy 组比较,三个用药组p-ERK 蛋白表达明显下调(P < 0.01),且混合组p-ERK 显著低于丹蒌片组和可定组(P<0.01);与丹蒌片组比较,可定组p-ERK 表达虽有所下调,但差异无统计学意义(P>0.05)(见图5)。

图2 各组RASMC Transwell小室迁移(×200)

图3 各组RASMC迁移数目比较
表2 各组VSMC细胞凋亡率比较(±s)

表2 各组VSMC细胞凋亡率比较(±s)
注:*与空白组比,P<0.01;#与Hcy 组比较,P<0.01;▽与混合组比较,P<0.01;♦与丹蒌片组比,P<0.05
凋亡率/%13.64±0.33 10.57±0.50*15.08±0.15#▽16.99±0.29#▽♦19.96±0.28#组别空白组Hcy组丹蒌片组可定组混合组
3 讨论
PCI是目前冠心病主流治疗手段,然而PCI术后仍有10%-30%IRS 发生率,这与中膜VSMC 过度增殖及迁移、血栓形成、炎症反应、内皮受损、内皮祖细胞的分化迁移、支架断裂或贴壁不良等多种机制有关[2-3],其中VSMC 的异常迁移、过度增殖和凋亡抑制所引起的大量ECM 合成和血管壁脂质沉积是包括PCI 术后再狭窄在内的所有阻塞性血管疾病首要原因[4-5]。PCI术后,支架作为异物,其置入处血管存在持续炎症反应,刺激平滑肌细胞由收缩型向分泌型表型转化,后者进一步释放大量IL-6、TNF-α等炎症因子及VEGF、SDF-1等细胞因子,引起VSMC 的过渡增殖、向内膜迁移,合成大量的细胞外基质并吞噬脂质形成肌源性泡沫细胞,加重局部炎症反应,促进支架内新生动脉粥样硬化(in stent neoatherosclerosis,ISNA)的发生,加速IRS 的发生和进展。因此,抑制VSMC 过度增殖、迁移,诱导其凋亡,是预防IRS的关键所在。目前现代医学对IRS的防治主要为支架治疗、基因治疗、血管内放射治疗和口服药物治疗等几个方面,但治疗效果不尽如人意,仍有部分病人反复发生IRS,使得现代医学对IRS 的防治遇到瓶颈。中医药理论认为,PCI 术后IRS仍属“胸痹”“真心痛”范畴,“本虚标实”为其基本病机,PCI治疗虽有“破血”功效,但支架作为异物加重血管炎症反应,血管机械损伤进一步加重,导致“瘀血阻滞,血脉不通,因此“痰瘀”仍为其主要证型,“化痰活血”为其主要治则[6]。

图4 各组RASMC凋亡率比较
高同型半胱氨酸血症(hyperhomocysteinemia,Hhcy)是AS 新的独立危险因素之一,同时也是急性冠脉综合症(ACS)的独立危险因子[7-10],作为一种反应性血管损伤氨基酸,Hcy 可促进AS 及血栓形成[11]。研究发现,在冠心病PCI 术后,Hcy 水平较术前无明显变化,术前Hcy 水平的高低决定PCI 术后早期并发症的发生率[12-13]。因此,PCI 治疗仅改变局部血液供应,Hhcy 导致的全身和支架局部高炎症反应状态并未得到纠正。通过本实验验证,经Hcy 诱导后,RASMC 过渡增殖、迁移,同时细胞凋亡率下降,凋亡受阻,这与前人研究结果相一致。
既往研究表明,Akt和ERK 信号通路在AS 病变中发挥了重要的作用,Akt 有丝/苏氨酸激酶活性,可被PI3K 激 活 生 成 磷 酸 化Akt(phosphorylated Akt,p-Akt),后者贯续激活其下游分子发挥生物学作用。PI3K/Akt 信号通路广泛参与包括AS 在内的多种心血管疾病形成过程,通过调控VSMC增殖和迁移、血管新生、炎症反应等过程,促进AS 发生、发展[14]。ERK/MAPK 信号转导通路广泛存在于多种细胞内,磷酸化激活后的p-ERK 调节细胞的增殖、分化、迁移等生物学行为[15]。通过本研究证实,在Hcy 诱导的RASMC 过渡增殖和迁移模型中,p-Akt 及p-ERK 蛋白表达量显著增加,提示p-Akt及p-ERK 可能在Hcy 诱导RASMC增殖、迁移时发挥重要作用。
丹蒌片是“化痰活血”代表药物,由薤白、瓜蒌皮、葛根、丹参、川芎、赤芍、泽泻、黄芪、郁金等构成,目前研究表明,其有降脂、抗炎、保护内皮功能、消退AS 斑块等作用[16-20],但这些研究多集中在探讨丹蒌片对内皮细胞功能调节和对血脂水平调节等方面,而对血管平滑肌细胞作用的研究较少,恰正如前所述后者是干预IRS的核心靶点。因此,通过本实验研究证实,丹蒌片能够明显抑制Hcy 诱导RASMC 增殖和迁移,增加RASMC凋亡率,下调p-Akt和p-ERK信号通路蛋白的表达水平,且与瑞舒伐他汀联合应用后,其作用进一步增强,提示丹蒌片具有抗RASMC 细胞增殖和迁移,诱导其凋亡的作用,该作用可能是通过下调p-Akt 和p-ERK 信号通路蛋白表达水平实现的。本研究不足之处在于未加入Akt 与ERK 信号通路阻断剂,需在后续实验中添加信号通路特异性阻断剂进一步验证丹蒌片抗血管平滑肌细胞增殖、迁移,诱导其凋亡的作用机制。
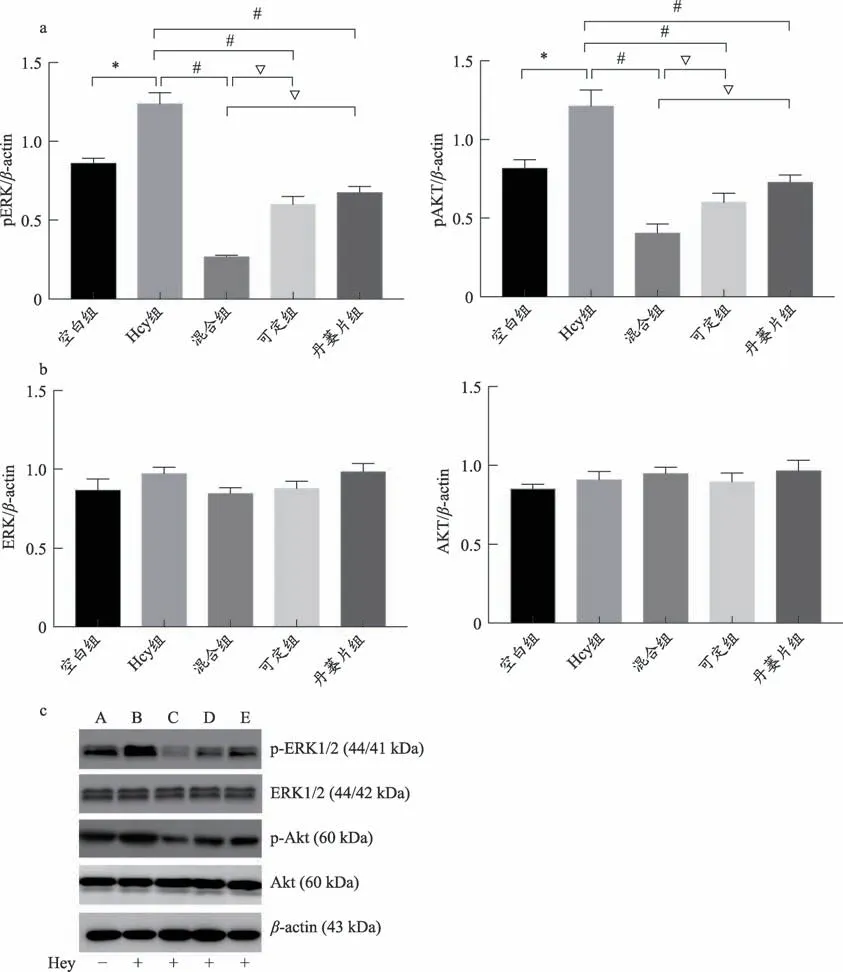
图5 Western Blot检测信号通路蛋白表达
