基于Ang/Tie-2信号通路研究补肾活血方导法调控大鼠种植窗期子宫组织血管生成的助孕机制*
2020-03-13夏宛廷黄金珠曾鹏飞
严 莉,郭 珮,周 航,夏宛廷,黄金珠,曾鹏飞,曾 倩
(成都中医药大学附属医院 成都 610072)
不孕症是妇科常见疑难杂病,中医学认为肾藏精、主生殖,“胞络者系于肾”“男精壮”“女经调”“氤氲时”“阴阳和”是孕育的基础。在总结前人经验后,《石室秘录·子嗣论》提出“女子不能生子有十病”,其中“胞宫寒”是首病。现代中医临床研究表明,“肾虚血瘀”是目前女性不孕的主要症型[1]。现代生殖医学认为,种植窗期是子宫内膜允许胚胎着床的关键时期,胚胎植入过程伴随子宫组织生成丰富的血管[2],为胚胎附着和着床提供了必要的物质,是确保胚胎种植成功的关键[3-5]。而血管生成是通过体内存在诸多互补和复杂的信号途径调节,其中血管内皮生长因子(VEGF)-血管内皮生长因子受体(VEGFR)、血管生成素(Ang)-Tie2 轴和Notch 信号通路在调节血管生成中发挥重要作用。已有研究表明,血管生成调控因子Ang-1、Ang-2、Tie-2、VEGF 在种植窗期子宫组织及早期胎盘中出现高表达[6-7]。亦有研究发现子宫内膜局部炎性反应有助于改善妊娠结局[8],这可能与炎症调节血管生成有关[9]。因此,研究中药对种植窗期子宫组织血管生成的影响对阐释中药的助孕机制具有重要意义。
本课题组结合导法(直肠灌注)给药能更接近“胞宫”,并能温通血脉和直接物理暖宫的特点,运用补肾活血方导法治疗肾虚血瘀型女性不孕症患者,能提高临床自然妊娠率[10]。前期研究已表明,补肾活血方导法治疗可提高肾虚血瘀型大鼠种植窗期子宫内膜组织的血液灌注[11]。本研究采用大鼠肾虚血瘀-胚胎着床障碍病证结合模型,从种植窗期子宫内膜形态学特征、螺旋动脉数量和血管生成相关因子的表达情况等方面,研究补肾活血方导法给药治疗不孕症,调控种植窗期子宫组织血管生成的助孕机制。
1 材料
1.1 实验动物
SPF 级健康成年雌性未孕SD 大鼠70 只,体重220±20 g,从中筛选动情周期规律的雌性大鼠60 只,SPF 级健康成年雄性SD 大鼠20 只,体重250±20 g,由成都达硕实验动物有限公司提供(合格证号:SCXK(川)2015-030),于成都中医药大学中医脏腑病证实验室动物房饲养。
1.2 实验药物
补肾活血方(原助孕Ⅰ号方)由大菟丝子、枸杞子、覆盆子、续断、丝瓜络、山楂、丹参和山药八味药组成。此方由四川省第三批名中医提供,专利名称:一种治疗或辅助治疗不孕症的药物组合物及其制备方法和用途,专利号:ZL201410390113.7;由四川省中医院中药制剂室提供,规格:50 mL/瓶,生产日期:20180811,成人日用量:0.73 g生药/kg。阿司匹林肠溶片:拜阿司匹林公司,规格:100 mg/片,生产批号:BJ38807,国准字号:J20171021,成人日用量:1.07 mg/Kg。羟基脲片:齐鲁制药有限公司,规格:500 mg/片,生产批号:8CO133D05,国准字号:H37021289。盐酸肾上腺素注射液:天津金药药业有限公司,规格:1 mL/支,生产批号:1710201,国准字号:H12020526。米非司酮片,华润紫竹药业有限公司,规格:25 mg/片,生产批号:431706061,国准字号:H10950003。
1.3 主要试剂
VEGF 兔抗鼠一抗(博士德生物公司,BA0407)、山羊抗小鼠荧光二抗(美国Abbkine 公司,A23227,A23210)、VEGF、FLK-1 ELISA 试剂盒(SHANGHAI WESTANG BIO-TECH CO.,LTD,批号分别为F17120、F17121)、PCR 引物(tsingke 公司)、Anti-Ang1 抗体(abcam 公司,ab102015)、Anti-Ang2抗体(abcam 公司,ab155106)、羊兔抗HRP(Jackson ImmunoResearch 公司 ,111-035-003)、Anti-TIE2(abcam 公 司 ,ab227219)、Trizol 试 剂(Invitrogen 公 司,182808)、SYBRGreenPCR试剂盒(Roche公司,1803058)。
2 方法
2.1 药物制备
阿司匹林用蒸馏水配制成浓度为1.35 mg/mL 的药液,6.75 mg/Kg·d。羟基脲用蒸馏水配制成浓度为96 mg/mL 的药液,450 mg/Kg·d。米非司酮用蒸馏水配制成浓度为2.2 mg/mL的药液,5.5 mg/Kg·只。
2.2 肾虚血瘀-胚胎着床障碍病证结合模型建立
参照齐宁等[12]建立的大鼠胚泡着床障碍动物模型、冯倩怡等[13]建立的肾虚血瘀-子宫内膜容受性不良模型及田滢舟等[14]建立的肾虚胚胎着床障碍小鼠病证结合模型,建立肾虚血瘀-胚胎着床障碍病证结合模型。除空白组,其余每组均予羟基脲450 mg/(kg·d)灌胃,每日一次,连续10 天,于第4 天开始加用肾上腺素0.3 mg/(kg·d)皮下注射7天造成肾虚血瘀模型;空白组予等量生理盐水灌胃10 天,第4 天开始加用等量生理盐水皮下注射7 天。于第11 天起,阴道涂片筛查各组动情期大鼠,每晚18:00按雌雄2∶1合笼,第二天早上7:00 观察阴栓或行阴道涂片观察精子,发现阴栓或精虫者为妊娠第1 天;除空白组其余各组均于妊娠第4天头颈部皮下注射米非司酮溶剂,5.5 mg/kg,造成着床障碍性不孕症模型,空白组则予等量芝麻油溶剂注射。
2.3 分组与给药
连续2 个动情周期阴道涂片观察,筛选动情周期规律的大鼠60 只,动情前期时入组,按随机数字表法分为空白组、模型组、对照组及补肾活血方高、低剂量组(分别简称“高剂量组”“低剂量组”),每组各12 只,于造模第1 天开始,每日10:00,低剂量组、高剂量组分别予补肾活血方浓缩液4.6 g/kg、9.2 g/kg灌肠,连续10天;空白组、模型组分别予生理盐水5 mL/kg 灌肠,连续10 天;对照组则于每日10:00 予阿司匹林肠溶片6.75 mg/Kg·d灌胃,连续10天。
2.4 处理及标本采集
于妊娠第5 天早上8:00,每组随机取6 只,予1%戊巴比妥钠40 mg/kg 麻醉后固定,剖腹行腹主动脉采血5 mL,采血后快速取出双侧子宫,分离周围脂肪组织,电子分析天平称量并记录各组大鼠子宫、卵巢湿重,计算各组大鼠子宫脏器指数。取同侧同部位1/4子宫放入EP管,4%多聚甲醛固定,4℃保存,用于光镜下观察;取同侧同部位1/4 子宫放入EP 管,4%多聚甲醛固定,用于切片观察和免疫组化法检测;取同侧同部位1/4 子宫放入RNA later 保存液中,-80℃保存,用于Real-Time PCR 检测;取同侧同部位1/4子宫直接放入冻存管,-80℃保存,用于Western-Blot 检测。所有器械都经DEPC水清洗后再使用。
2.5 采用酶联免疫法(ELISA)检测大鼠血浆VEGF、FLK-1表达水平
制备标准溶液:取8个1.5 mL离心管,第一管加标本稀释液900µL,第二至第八管加入标本稀释液500µL。在第一管中加入10µg/mL 的标准品溶液100µL置于漩涡混合器上混匀后用加样器吸出500µL,移至第二管。如此反复作对倍稀释,从第七管中吸出500µL 弃去。第八管为空白对照。用1∶20 双蒸水稀释,100µL 待测血浆加入每孔,混匀,37℃40 min,洗涤4-6 次,滤纸上干燥,除空白每孔添加50µL 双蒸水和一抗,混匀,37℃20 min,洗板,添加100 µL 酶标抗体,37℃10 min,洗板,加入100 µL 底物工作液,暗光中37℃15 min,添加100µL 停止溶液混匀,并在30 分钟内用微板读数仪测量450 nm 处的吸光度。以标准品1000 ng/mL、500 ng/mL、250 ng/mL、125 ng/mL、62.5 ng/mL、31.2 ng/mL、15.6 ng/mL、0 ng/mL 为横坐标,OD 值为纵坐标,使用软件作图,画出标准曲线。根据样品OD值计算出相应VEGF、FLK-1含量。
2.6 采用免疫组化法(IHC)检测大鼠子宫内膜VEGF表达水平及螺旋动脉数量
将1/4 大鼠子宫置于4%多聚甲醛固定48 小时后取出,逐级酒精脱水,经二甲苯透明、浸蜡,石蜡包埋后切片,将白片在60℃烤箱内烤4-6 h,37℃孵箱过夜,二甲苯脱蜡2 次,每次10 min,酒精梯度复水,每次3 min,去离子水震荡洗涤2 次,每次5 min,抗原修复,室温冷却,3%H2O2 室温避光浸泡10 min,PBS 洗涤3次,每次5 min;滴加封闭血清,室温孵育15 min,滴加一抗,4℃过夜;复温15 min,PBS 洗涤3次,每次5 min;滴加二抗,常温孵育30 min,PBS洗涤3次,每次5 min,滴加二抗,常温孵育20 min,PBS洗涤3次,每次5 min,DAB显色,苏木素复染,酒精梯度脱水,二甲苯2次,每次10 min,中性树胶封片,检测VEGF的表达水平。

表1 Ang-1、Ang-2、Tie-2基因引物序列
2.7 Real-Time PCR 检 测 大 鼠 子 宫Ang-1、Ang-2、Tie-2mRNA表达水平
组织冰上解冻后,倒出保存液,在EP 管中加入1 mL Trizol 提取子宫组织中DNA,并进行核酸品质确认,反转录,加入90 µL RNAfree 水稀释,加入相应引物,用GAPDH 作内参,退火温度54℃。扩增条件:94℃变性3 min,30 个循环;72℃延伸10 min。SYBR green 法检测Ang-1、Ang-2、Tie-2mRNA 表达水平。引物序列参见表1。
2.8 Western-Blot 检测大鼠子宫Ang-1、Ang-2、Tie-2蛋白相对表达水平
子宫组织匀浆后加入适量RIPA 裂解液,制备蛋白并测定蛋白含量,配胶,电泳,转膜,加入一抗、二抗,用ECL 法显色,覆盖在PVDF 膜反应1min,保鲜膜包裹,去残液,放入X 光片夹曝光、显影定影。扫描图像,使用Image-J 图像分析软件条带积分值,检测大鼠子宫Ang-1、Ang-2、Tie-2蛋白表达水平。
2.9 统计学方法
所有数据均采用SPSS 25.0统计分析软件处理,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析(One.Way ANOVA)。方差齐,采用单因素方差分析中的LSD(Least-significant diffrerence)方法进行多重比较检验;方差不齐,采用Tamhane' S T2进行多重较检验,P<0.05为差异有统计学意义。
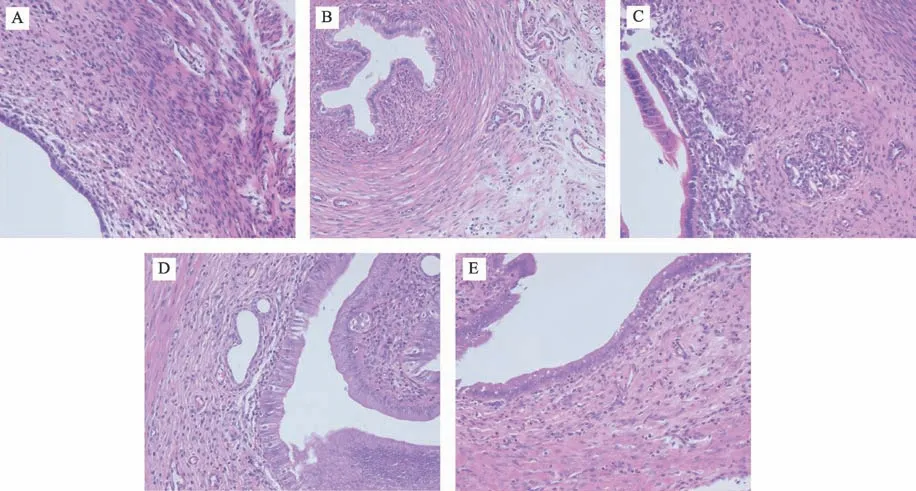
图1 各组大鼠种植窗期子宫内膜形态学变化(HE×200)
3 结果
3.1 肾虚血瘀-胚胎着床障碍病证结合模型大鼠子宫内膜形态学变化
模型组大鼠子宫内膜发育较差,螺旋动脉少,位于基层,内膜腺体小而直,细胞呈梭形,部分间质致密,呈增生期改变;部分间质疏松、水肿,呈分泌期改变,间质发育不同步(见图1-A)。空白组、阿司匹林组与给药组大鼠子宫内膜发育较好,螺旋小动脉增生,接近功能层,腺体数量多,分布均匀,腺体弯曲,腺上皮多呈单层高柱状上皮细胞,并夹杂有透亮细胞,少数出现顶浆分泌,腺腔明显增大,内有分泌物,间质疏松水肿,部分间质中见梭形细胞(见图1-B,图1-C,图1-D,图1-E,图1-F)。表明补肾活血方能改善模型大鼠子宫内膜组织形态,使内膜增厚且松软,利于胚胎着床。
3.2 补肾活血方导法对模型大鼠种植窗期子宫组织VEGF、FLK-1的表达影响
各组大鼠子宫内膜经IHC 染色后,200 倍光镜下观察VEGF 的表达情况,阳性染色为胞浆内棕黄色颗粒状或细丝状。由图2可见,VEGF在各组大鼠子宫内膜上皮及间质均有表达,模型组大鼠VEGF 表达呈黄色、浅黄色,分布稀疏,面积较小(见图2-A);空白组大鼠VEGF表达呈棕黄色、黄色,分布密集,面积较广(见图2-B);给药组及阿司匹林组较模型组VEGF 表达均有不同程度增加,呈棕黄色、黄色,分布较密集,面积较广(见图2-C,图2-D,图2-E)。表明补肾活血方能促进模型大鼠子宫内膜VEGF表达。
由表2 可见,模型组大鼠子宫内膜VEGF、FLK-1表达量较空白组明显降低(P < 0.05),螺旋动脉数量也显著降低(P < 0.01);给药高剂量组大鼠VEGF、FLK-1 表达量和螺旋动脉数量均显著高于模型组(P < 0.01);给药低剂量组大鼠螺旋动脉数量较模型组显著升高(P<0.01),VEGF、FLK-1表达量也高于模型组。结果表明,补肾活血方高剂量给药能提高模型大鼠血浆中VEGF、FLK-1 表达水平及促进子宫内膜螺旋动脉增生,而低剂量组血浆中VEGF、FLK-1 表达量升高未见统计学差异,推测可能与其血药浓度有关。
3.3 补肾活血导法对各组大鼠子宫湿重及脏器指数的影响
由表3 可知,模型组大鼠子宫湿重和子宫脏器指数均较空白组低(P<0.05);给药高剂量组、低剂量组和阿司匹林组大鼠子宫湿重及子宫脏器指数均高于模型组(P < 0.05),且给药高剂量组与空白组之间无统计学差异(P > 0.05)。研究结果表明,补肾活血方导法给药可增加模型大鼠子宫湿重及子宫脏器指数,具有修复子宫受损的作用。

图2 各组大鼠种植窗期子宫内膜VEGF表达变化(VEGF染色×200)
表2 补肾活血导法对各组别VEGF表达及螺旋动脉数量变化(±s)
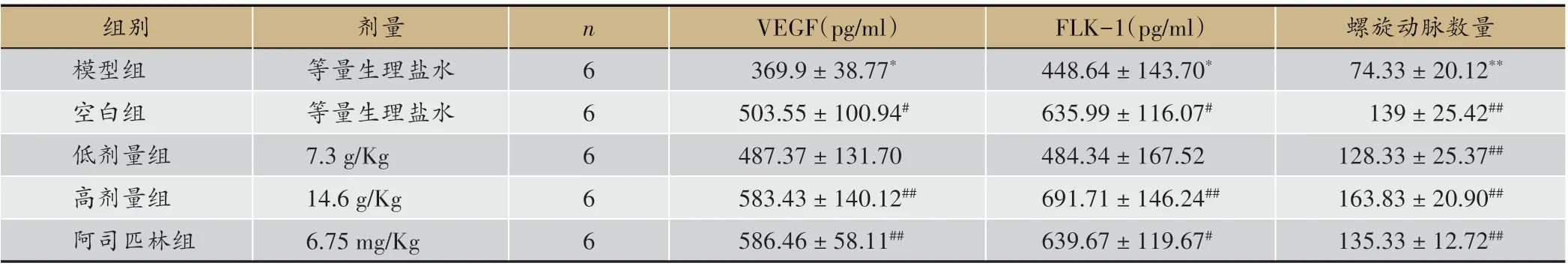
表2 补肾活血导法对各组别VEGF表达及螺旋动脉数量变化(±s)
注:与空白组比较*P<0.05,**P<0.01;与模型组比较#P<0.05,##P<0.01
螺旋动脉数量74.33±20.12**139±25.42##模型组空白组等量生理盐水等量生理盐水6 6 369.9±38.77*503.55±100.94#448.64±143.70*635.99±116.07#128.33±25.37##163.83±20.90##135.33±12.72##组别低剂量组高剂量组阿司匹林组剂量7.3 g/Kg 14.6 g/Kg 6.75 mg/Kg n 6 6 6 VEGF(pg/ml)487.37±131.70 583.43±140.12##586.46±58.11##FLK-1(pg/ml)484.34±167.52 691.71±146.24##639.67±119.67#
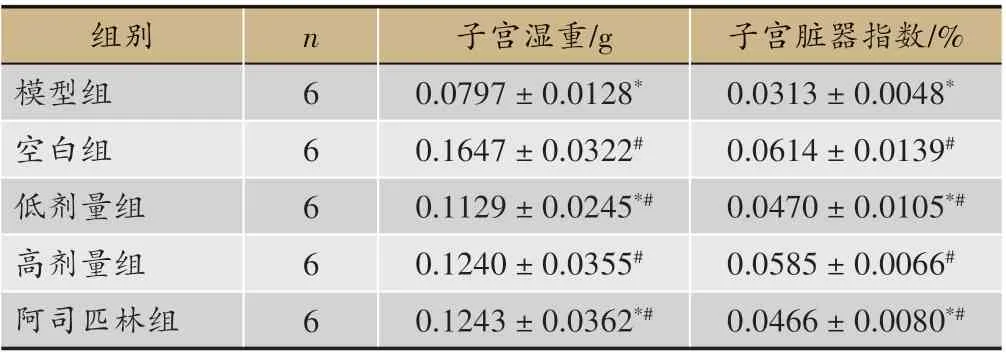
表3 各组大鼠子宫湿重及脏器指数
3.4 补肾活血导法对各组大鼠子宫组织Ang-1、Ang-2、Tie-2的蛋白表达影响
由图3、表4可见,模型组与空白组比较,大鼠Tie-2 表达显著降低(P < 0.01);给药低剂量组Tie-2 表达较模型组高(P < 0.05);给药高剂量组和阿司匹林组大鼠Ang-1、Tie-2 表达量较模型组均显著升高(P <0.01);Ang-2 表达在各实验组间没有统计学差异,但给药组有增高的趋势。研究结果表明,补肾活血方主要影响大鼠子宫Ang-1、Tie-2 蛋白表达,并能提高模型大鼠子宫组织Ang-1、Tie-2蛋白表达水平。
表4 各组干预后Ang-1、Ang-2、Tie-2蛋白相对表达水平(±s)
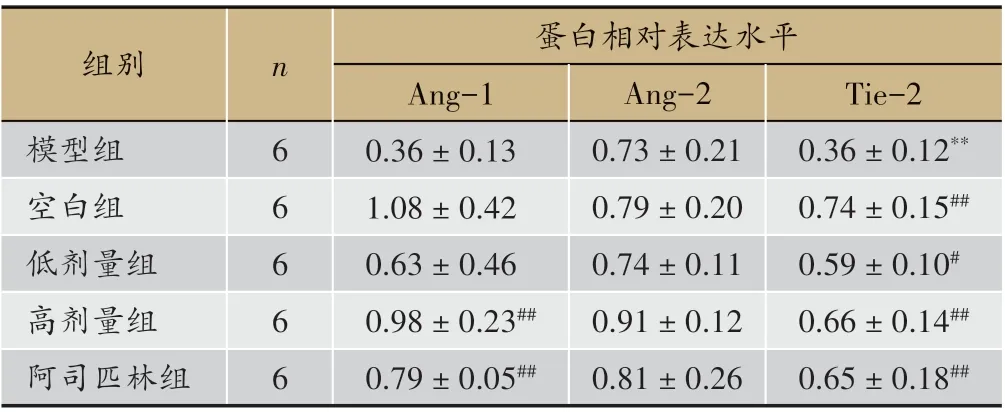
表4 各组干预后Ang-1、Ang-2、Tie-2蛋白相对表达水平(±s)
注:与空白组比较:*表示P<0.05,**表示P<0.01;与模型组比较:#表示P<0.05,##表示P<0.01
组别模型组空白组低剂量组高剂量组阿司匹林组n 6 6 6 6 6蛋白相对表达水平Ang-1 0.36±0.13 1.08±0.42 0.63±0.46 0.98±0.23##0.79±0.05##Ang-2 0.73±0.21 0.79±0.20 0.74±0.11 0.91±0.12 0.81±0.26 Tie-2 0.36±0.12**0.74±0.15##0.59±0.10#0.66±0.14##0.65±0.18##
3.5 补肾活血导法对各组大鼠子宫组织Ang-1、Ang-2、Tie-2mRNA的表达影响
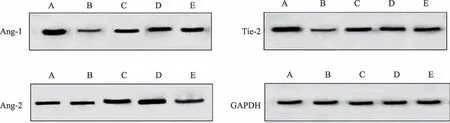
图3 各组干预后Ang-1、Ang-2、Tie-2 Western Blot分析结果
图4 Ang-1、Ang-2、Tie-2荧光定量PCR扩增曲线、溶解曲线图
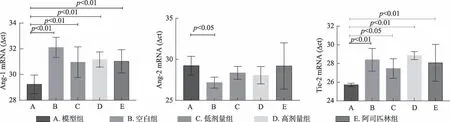
图5 各组干预后Ang-1、Ang-2、Tie-2mRNA表达
由图4、图5 和表5 可见,模型组大鼠Ang-1、Tie-2 mRNA 表达水平均较空白组显著降低(P < 0.01),Ang-2 mRNA 表达也较高(P < 0.05);给药高、低剂量组和阿司匹林组大鼠Ang-1、Tie-2 mRNA 表达水平较模型组均显著升高(P < 0.01),且给药高剂量组Ang-1、Tie-2 mRNA 表达水平与空白组间无统计学差异(P > 0.05)。研究结果表明,补肾活血方能提高模型大鼠子宫组织Ang-1、Tie-2 mRNA表达水平。
3.6 Ang/Tie-2 通路与VEGF、螺旋动脉数量相关性分析
从表6 可见,Ang-1、Tie-2 表达与VEGF 表达呈正相关,r>0.5(P<0.01);Ang-1、Tie-2 表达与螺旋动脉数量呈正相关,r>0.5(P<0.01)。
表5 各组干预后Ang-1、Ang-2、Tie-2mRNA表达(Realtime PCR,±s)
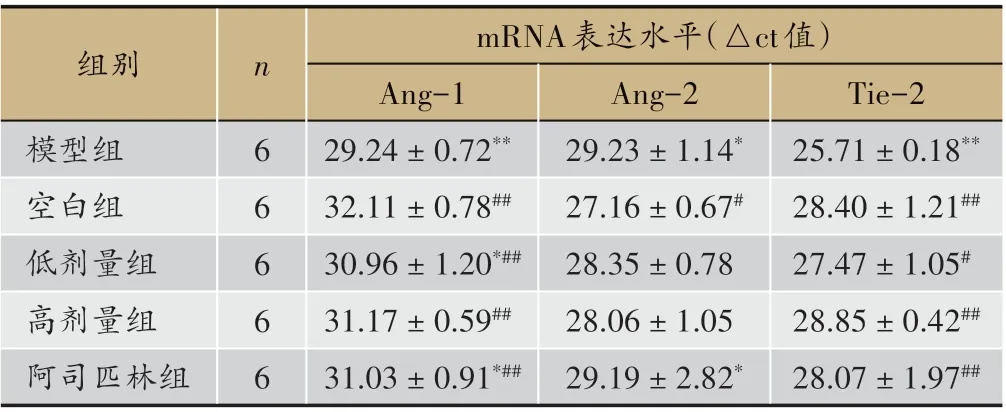
表5 各组干预后Ang-1、Ang-2、Tie-2mRNA表达(Realtime PCR,±s)
注:与空白组比较*P<0.05,**P<0.01;与模型组比较#P<0.05,##P<0.01
组别模型组空白组低剂量组高剂量组阿司匹林组n 6 6 6 6 6 mRNA表达水平(△ct值)Ang-1 29.24±0.72**32.11±0.78##30.96±1.20*##31.17±0.59##31.03±0.91*##Tie-2 25.71±0.18**28.40±1.21##27.47±1.05#28.85±0.42##28.07±1.97##Ang-2 29.23±1.14*27.16±0.67#28.35±0.78 28.06±1.05 29.19±2.82*
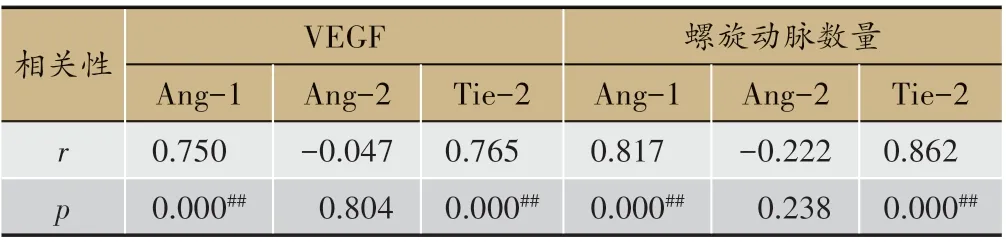
表6 Ang/Tie-2通路与VEGF、螺旋动脉数量相关性分析
4 讨论
中医学认为,“肾”在生殖中发挥着重要的作用,肾精是卵子生长发育和成熟的物质基础。如《素问·上古天真论》就谓:“肾气盛……天癸至,任脉通,太冲脉盛,月事以时下,故有子。”肾阳亏虚,不能鼓舞肾阴的生化和滋长,同样也无法使卵子发育成熟。“女子以血为本”,肾气亏虚,无力推动血液运行,则气虚血瘀;若肾阳亏虚,血脉失于温煦,则寒凝血瘀;肾阴不足,虚热内生,煎灼津液,则热灼血瘀。血瘀既是肾虚病理产物,同时又可导致或加重肾虚,二者互为因果。可见,肾虚为本,血瘀为标,肾虚血瘀是不孕症主要发病机制。
导法是将药物经肛门塞入或肠道灌入以治疗疾病的一种传统给药方法,在不孕症治疗中有其独特优势。首先,胞宫(子宫和附件)位置与直肠相邻,导法给药可使药物直接作用于胞宫和冲任;其次,药物温热不烫时使用可起到温通血脉的作用;同时“肺与大肠相表里”,药物可经“肺朝百脉”的作用输布于全身[15]。另外,现代研究表明,直肠周围有丰富的动静脉和淋巴丛,药物经直肠粘膜吸收,可迅速到达盆腔,进入体循环,避免肝脏“首过消除效应”,药物吸收和利用度高[16]。据此,曾倩教授针对肾虚血瘀证是女性不孕症的主要临床症型,自拟补肾活血方经导法给药治疗肾虚血瘀型不孕症,临床疗效较好[8]。补肾活血方由大菟丝子、枸杞子、覆盆子、续断、丝瓜络、山楂、丹参、山药八味药组成。菟丝子阴阳并补,温而不燥,补而不滞,绕于豆根之间,吸取它物之精华以自养,取类比象,与胚胎居于母体,吸取母体之精华而存活相类似;植物的种子具有繁殖的特性,故取枸杞子补益肝肾,平调气血阴阳,滋阴助阳;覆盆子甘平入肾,滋养肾中真阴,益精气而坚肾气;续断补肝肾、调冲任,通行百脉,续血脉而调气血;丹参行血破淤而生新;丝瓜络通经活络、山楂行气散瘀、山药平补三阴,三者皆可入胃,而冲脉隶属于阳明,有从阳明治冲任之意,且傅青主认为山药可专补任脉之虚。诸药合用,共奏补肾活血之功效。
本实验结果表明,补肾活血方导法给药,可改善肾虚血瘀-胚胎着床障碍模型大鼠种植窗期子宫内膜形态组织学特征,促进螺旋小动脉增生、腺体数量增多,以及增加大鼠子宫湿重和子宫脏器指数,促进其VEGF、FLK-1 表达,并提高其子宫组织Ang-1、Tie-2 mRNA 及蛋白表达水平,并有上调Ang-2 表达水平的趋势。现代生殖医学研究表明,种植窗期是子宫内膜允许胚胎着床的关键时期,胚胎植入过程伴随子宫丰富血管组织的生成[2],血管组织为胚胎附着和着床提供必需的物质,是确保胚胎种植成功的关键[3,15-16]。而Ang/Tie-2 信号通路是血管生成的主要通路之一,在Ang/Tie-2 信号通路中,Ang-1 促进血管出芽及分支并维持新生血管完整和稳定,Ang-2降低血管稳定性,增加血管可塑性,二者竞争性结合受体Tie-2 发挥其作用。当VEGF 存在时,Ang-2 的表达使激活的内皮细胞在VEGF作用下增殖、侵袭、迁移,形成新生血管;当VEGF 不存在时,Ang-2 的表达使血管发生退行性变,甚至坏死[19]。
因此,补肾活血方经导法给药治疗肾虚血瘀型不孕症的助孕机制,可能是通过提高子宫组织VEGF、FLK-1、Ang-1、Tie-2 表达水平,维持Ang-2 正常表达水平,从而促进子宫组织血管新生,并维持新生血管稳定,促进新生血管成熟,促进子宫内膜螺旋动脉增生,增加子宫组织血液灌注,以及促进子宫内膜正常发育,提高子宫内膜容受性,促进胚胎着床。
