蹄叶橐吾萃取物通过NF-κB通路降低细胞炎症反应*
2020-03-13张春艳刘万全吕艳欣
张春艳,刘万全,吕艳欣,陈 萍,董 静,王 玉,李 涛
(齐齐哈尔医学院 黑龙江 161006)
炎症是由激活的巨噬细胞释放一系列炎症因子所产生的一种以防御为主的免疫反应[1-2],但是炎症因子的持续刺激会对组织产生损害,使机体功能丧失、引发肿瘤,严重的甚至导致死亡[3]。因此,开发一种新型、高效、无副作用的天然抗炎药物具有深远意义。
蹄 叶 橐 吾(Ligularia fischeri,LF)为 菊 科(compasitae)蹄叶橐吾属(Ligularia)多年生草本植物,又名肾叶橐吾、马蹄叶、葫芦七等[4]。该植物性温,味辛、苦。其根和根茎收入吉林省药材标准,名山紫菀,具有温肺下气、理气活血、止痛、止血、利尿、镇咳祛痰等功效,用于治疗慢性支气管炎、咽喉炎症、肺痈咳血、跌打损伤等疾病。全草用于治疗丹毒性炎症和关节脓肿,地上部分外敷用于捻挫伤,水煎服可治疗痔疾[5-7]。,随着LF 的药理活性被逐渐阐明,发现除了其根和根茎具有镇咳祛痰等药理活性外,其叶片提取物中的倍半萜类及异蜂斗菜酮等化学成分[8-10]在抗炎免疫,抗肿瘤、抗氧化等方面显示出潜在的药用价值[11-13]。目前国内外学者已发现LF 叶片提取物可通过多条信号通路发挥抗炎作用,例如:抑制LPS 刺激RAW264.7 细胞产生一氧化氮和前列腺素-2[11]、通过c-Jun 氨基末端激酶(c-jun N-terminal kinase,JNK)和丝裂原活化蛋白激酶p38(Mitogen-activated protein kinases p38,p38MAPK通路下调炎性蛋白JNK、环氧酶(cyclooxygenase-2,COX-2)的表达,同时降低JNK 的磷酸化水平[12-13]。然而目前对于LF 叶片提取物的抗炎作用机制研究相对较少,深入的机制还有待于进一步挖掘。
细胞核内因子κB(nuclear factor-κB,NF-κB)是一种介导炎症反应的重要转录调控因子,能够与p38MAPK、JNK 和胞外信号调节激酶(extracellular signal regulated kinase,ERK)等通路共同作用,调节下游靶基因的转录和表达。NF-κB 主要由NF-κB 1(p105/p50)、NF-κB 2(p100/p52)、RelA(p65)、RelB 和c-Rel组成,其中p65在调节炎症反应中发挥了重要的作用[14]。细胞在静息状态下,NF-κB 的核定位序列被其阻遏蛋白(inhibitor of NF-κB,IκB)封闭,以无活性的形式存在于细胞浆中[15]。传统观点认为,当细胞受到LPS 刺激时,IκB 发生磷酸化,与NF-κB 解离,进而暴露NF-κB 的核定位序列,使NF-κB 被激活,从细胞浆易位至细胞核,介导各种炎性因子的转录和表达[16]。除此以外,大量的实验数据表明,NF-κB的亚基p65可以被细胞内的激酶磷酸化,这种磷酸化修饰可以反式激活NF-κB,从而增强NF-κB 的转录活性[15]。NF-κB抑制剂PDTC 能够抑制NF-κB 的激活,从而阻止NFκB入核,达到抗炎作用[17]。虽然研究已表明EEOLF具有显著的抗炎活性,但其能否通过NF-κB 信号通路达到抗炎作用尚不明确。本研究以LPS诱导的小鼠巨噬细胞RAW264.7 为炎症模型,通过此模型,初步探讨NF-κB通路介导的EEOLF抗炎作用机制,以期为开发EEOLF天然抗炎药物提供有力依据。
1 材料和方法
1.1 材料与试剂
1.1.1 细胞
小鼠巨噬细胞RAW264.7购于北京协和医学院。
1.1.2 药品
LF为李涛教授在延边市安图县采摘,EEOLF在齐齐哈尔大学制备,制备过程为干燥的LF 叶片8.5 kg,粉碎后,室温下,每次用95%无水乙醇15 L 浸泡3 天后加热回流,重复3 次,合并醇提液,减压浓缩至小体积(约1.0 L),真空干燥,加水1.5 L,得醇提取物用水混悬,用乙酸乙酯萃取3 次,每次用乙酸乙酯1.5 L,合并乙酸乙酯层浓缩至恒重,得率为0.61%[15]。每克相当于10 g生药,使用时DMSO 溶解后用PBS稀释,滤过除菌,并分装储存。
1.1.3 试剂
FBS胎牛血清(美国Hyclone公司),乙二胺四乙酸(EDTA,美国Sigma 公司),四甲基二乙胺(TEMED,美国Sigma 公司),DMEM 培养基干粉(美国Gibco 公司),NF-κB抗体(美国Cell Signal Technology 公司)、NF-κB磷酸化抗体(美国Cell Signal Technology 公司)、β-actin(美国Cell Signal Technology 公司),山羊抗小鼠lgG/辣根酶标记二抗(美国Cell Signal Technology 公司),LPS(美国Sigma 公司),NF-κB 抑制剂PDTC(上海谱振生物科技有限公司),L-1β及TNF-α ELISA试剂盒(博士德生物科技有限公司)。
1.2 仪器
DY5000X 倒置显微镜(重庆澳浦光电技术有限公司),BIO-RAD 680 全自动酶标仪(美国BIO-RAD 公司),超低温冰箱(美国Thermo Fisher Scientific 公司),3111 型二氧化碳培养箱(美国Thermo Fisher Scientific公司),VS-1300L-U 净化工作台(苏州净化设备有限公司),Tanon 5200 化学发光成像系统(上海天能科技有限公司)。
1.3 试验方法
1.3.1 细胞培养及处理
取RAW264.7 巨噬细胞在DMEM 培养基(含10%胎牛血清)培养2 天、处于对数生长期、生长状态良好的RAW264.7 细胞,经1 × PBS 清洗两次,每次3 m L,用刮刀刮取细胞,并用细胞培养液吹打混匀,于细胞计数板上计数,加培养液稀释至浓度为5×104个/mL,接种于96孔板中,每孔100µL,继续培养,待巨噬细胞处于对数生长期且形成致密融合单层后分组处理。先前研究采用噻唑蓝比色法(MTT 法)测得EEOLF 作用于密度为5×104个/mL的RAW264.7细胞24 h后,药物对细胞的无毒浓度为5 µg·mL-1[12]。本研究取对数期细胞6 瓶,分别进行6 种处理。空白对照组,加入不含血清培养基培养24 h;EEOLF 处理组,加入EEOLF(终浓度为5µg·mL-1)培养24 h;LPS 刺激组,加入LPS(终浓度为0.1 mg·L-1)培养24 h;LPS+PDTC 组,加入PDTC(终浓度为10 ng·µL-1)培养1 h 后,再加入LPS(终浓度为0.1 mg·L-1)培养24 h;LPS + EEOLF 组,加入EEOLF(终浓度为5 µg·mL-1)培养1 h 后,再加入LPS(终浓度为0.1 mg·L-1)培养24 h;LPS + PDTC +EEOLF 组,加入PDTC(终浓度为10 ng·µL-1)培养1 h后,再加入EEOLF(终浓度为5µg·mL-1)培养1 h,最后加入LPS(终浓度为0.1 mg·L-1)培养24 h。
1.3.2 免疫印迹法分析蛋白表达
取RAW264.7 巨噬细胞在DMEM 培养基(含10%胎牛血清)培养2 d、处于对数生长期、生长状态良好的RAW264.7 细胞,经1 × PBS 清洗两次,每次3 m L,用刮刀刮取细胞,并用细胞培养液吹打混匀,于细胞计数板上计数,加培养液稀释至浓度为5×104个/mL,接种于96孔板中,每孔100µL,继续培养,待巨噬细胞处于对数生长期且形成致密融合单层后按照1.3.2 的方法分组处理。提取细胞核总蛋白,并测定各组的总蛋白浓度,95 ℃将蛋白变性,取30 µg 蛋白样品进行电泳,将蛋白转移到硝酸纤维素膜(0.45µm),用脱脂牛奶室温封闭2 h,TBST 洗3 次。分别加入一抗NF-κB p65、p-p65 和β-actin 抗体,抗体稀释度为1:1000,4 ℃孵育过夜;TBST 洗3 次,加入辣根酶标记山羊抗小鼠二抗,抗体稀释度为1∶5000,室温孵育1 h,TBS 洗涤2 次,再次TBST 洗涤后反应信号经ECL 底物化学发光检测,结果扫描后,以β-actin 为内参,用ImagePro 分析每个目的蛋白特异灰度值并计算相对灰度值。以上实验重复3次。
1.3.3 细胞因子检测
取RAW264.7 巨噬细胞在DMEM 培养基(含10%胎牛血清)培养2 d、处于对数生长期、生长状态良好的RAW264.7 细胞,经1 × PBS 清洗两次,每次3 m L,用刮刀刮取细胞,并用细胞培养液吹打混匀,于细胞计数板上计数,加培养液稀释至浓度为5×104个/mL,接种于96孔板中,每孔100µL,继续培养,待巨噬细胞处于对数生长期且形成致密融合单层后按照1.3.2 的方法分组处理。用ELISA 试剂盒检测上清肿瘤坏死因子TNF-α 和白介素IL-1β 分泌情况。将8 pg·mL-1、400 pg·mL-1、200 pg·mL-1、100 pg·mL-1、50 pg·mL-1L、25 pg·mL-1L、12.5 pg·mL-1的标准品各100 uL 依次加入孔中,另取1孔只加细胞培养上清作为阴性对照,每个浓度设置三个复孔;酶标板加上封板膜,37 ℃反应90分钟;依次加入生物素抗小鼠IL-1β抗体100 uL;酶标板加上封板膜,37 ℃反应60 分钟;洗涤缓冲液洗涤3 次,每次浸泡1 分钟左右(每孔洗液至少300 uL);将准备好的ABC 工作液按每孔100 uL 依次加入;酶标板加上封板膜,37 ℃反应30分钟;洗涤缓冲液洗涤5 次,每次浸泡1-2 min 左右(每孔洗液至少300 uL)。分别加入显色剂A 和B,轻轻震荡混匀,37 ℃避光显色10 min;加终止液,采用酶标仪测量各孔的吸光度A450nm。
1.4 统计学分析
炎症因子释放数据采用GraphPad Prism 5 软件分析,Western blot 数据采用ImagePro 软件分析,数据以±SD表示,P<0.05为差异具有统计学意义。
2 结果与分析
2.1 RAW264.7巨噬细胞形态学观察
RAW264.7 巨噬细胞在DMEM 培养基(含10%胎牛血清)培养2天,待巨噬细胞处于对数生长期且形成致密融合单层后分组处理,用以观察比较EEOLF 及PDTC 作用后细胞的形态变化。各组RAW264.7 细胞如图1 所示,正常RAW264.7 细胞形态以类圆形为主,边缘明亮,含有1~2 个细胞核,偶有细长触角,是一类胞体体积较小的细胞(图1A)。单独加入EEOLF 生长24 h 后,细胞无明显变化,细胞核清楚,状态良好(图1B)。加入LPS 诱导24 h 后,细胞模糊不清,细胞内有空泡(图1C)。用PDTC 或者EEOLF 单独作用于LPS诱导的RAW264.7 细胞后,细胞内空泡减少(图1D 和1E),用PDTC 和EEOLF 同 时 作 用 于LPS 诱 导 的RAW264.7 细胞后,细胞核变得清晰,细胞内空泡减少(图1F),说明EEOLF 和NF-κB 抑制剂PDTC 效果相似。
2.2 EEOLF降低LPS诱导的RAW264.7巨噬细胞NFκB p65表达及其磷酸化
NF-κB p65 在正常情况下位于细胞浆中,当发生炎症反应时,将会从细胞浆易位至细胞核内[16]。本研究通过构建LPS 诱导的RAW264.7 细胞炎症模型,Western 法检测细胞核内NF-κB p65 蛋白表达水平及其磷酸化水平,间接检测药物是否可以通过NF-κB 信号通路达到抗炎作用。研究结果显示,与空白对照组相比,LPS 组NF-κB p65 和p-p65 蛋白表达量显著升高(###P<0.001),说明LPS诱导的RAW264.7细胞发生了炎症反应。加入PDTC 或者EEOLF,分别作用于LPS 诱导的RAW264.7 细胞,发现NF-κB p65 和p-p65蛋白表达量明显低于LPS 组(***P < 0.001),表明EEOLF 与PDTC 一样,可以降低LPS 诱导的RAW264.7巨噬细胞NF-κB p65 和p-p65 蛋白表达。当PDTC 与EEOLF 共同作用于LPS 诱导的RAW264.7 细胞后,NF-κB p65 和p-p65 蛋白表达量低于PDTC 或EEOLF单独作用(△△△P < 0.001 或△P < 0.05),说明在NF-κB抑制剂PDTC 与EEOLF 的共同作用下,对细胞核内NF-κB p65 和p-p65 蛋白表达的抑制作用进一步加强(***P<0.001)(图2)。

图1 不同因素处理后的RAW264.7的细胞形态

图2 EEOLF对RAW264.7细胞NF-κB p65和p-p65蛋白表达的影响
2.3 EEOLF 降低LPS 诱导的RAW264.7 巨噬细胞炎症因子的分泌
NF-κB 信号转导通路被激活后,会介导下游各种炎性因子的表达,如:TNF-α、IL-1 等,因此炎性因子分泌量的多少反应了炎症的严重程度。本研究结果显示,与空白对照组相比,LPS 组TNF-α 和IL-1β 的分泌 量 显 著 升 高(###P < 0.001),说 明LPS 诱 导 的RAW264.7 细胞发生了炎症反应。加入PDTC 或者EEOLF,分别作用于LPS 诱导的RAW264.7 细胞后,发现TNF-α 和IL-1β 的分泌量明显减少(***P < 0.001),表明EEOLF 与PDTC 均能降低炎症细胞中TNF-α 和IL-1β 的释放。当PDTC 与EEOLF 共同作用于LPS 诱导的RAW264.7 细胞后,TNF-α 和IL-1β 的分泌量更低(△△△P<0.001),表明PDTC与EEOLF共同作用后对炎症因子TNF-α和IL-1β释放的抑制作用进一步加强(***P<0.001)(图3)。
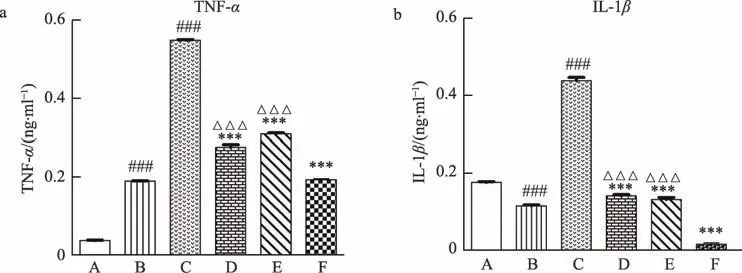
图3 不同因素处理后的RAW264.7细胞炎性因子的表达
3 讨论
炎症是一类极其复杂的病理生理过程,是机体对损伤性刺激最原始的保护性反应,在一定程度内起到保护机体的作用,但长期剧烈的炎症反应会加速疾病进程,使得机体出现中毒性休克,多器官功能衰竭等症状[18-19]。
LF 为我国传统中药,始载于《神农本草经》,又称山紫菀,李时珍说:“其根色紫而柔宛故名”。主要分布在东北长白山、内蒙古、朝鲜、日本、前苏联等,因其药理作用广泛、廉价易采摘等优势而具有很大的开发价值[20]。近年来研究发现除了其根和根茎具有镇咳祛痰等药理活性外,LF地上部分乙醇提取物对降低炎症组织中的PGE2 的含量、抑制小鼠单核巨噬细胞吞噬功能、抑制组胺、5-羟色胺、缓激肤等炎症介质的合成或释放及增强体液免疫功能有关。但具体作用机制尚不十分清楚[21]。本研究以RAW264.7 细胞作为载体,采用LPS 建立体外细胞炎症模型,探讨EEOLF 对LPS 诱导的RAW264.7 细胞功能的调控作用,以丰富EEOLF 的抗炎作用机制,为LF 的临床应用提供理论基础。
本研究在显微镜下观察到LPS 刺激RAW264.7 细胞24 h 后细胞边缘模糊不清,细胞内出现空泡(图1C)。用PDTC 或者EEOLF 单独作用于LPS 诱导的RAW264.7细胞后,细胞内空泡减少(图1D 和1E)。用PDTC 和EEOLF 同时作用于LPS 诱导的RAW264.7 细胞后,细胞核变得清晰,细胞内空泡减少(图1F),提示EEOLF 与NF-κB 抑制剂PDTC 功能相似,均可使LPS诱导的RAW264.7细胞发生凋亡。
LPS 是革兰氏阴性菌细胞壁的成分,能够作为炎症诱导剂,与细胞膜表面受体(Toll-like receptor 4,TLR4)结合[22-24],刺激巨噬细胞等免疫细胞的活化,引起全身的炎症反应。LPS诱导的炎症反应主要是通过激活NF-κB等信号通路实现的,NF-κB 被激活后进入细胞核,与特异性的基因转录起始区结合,启动炎症基因的转录,介导TNF-α、IL-1 等炎症因子的释放[15]。炎症因子的分泌量是检测炎症严重程度的量化指标,炎症标志因子TNF-α 在炎症网络中具有关键作用,是全身炎性反应的始动介质,是炎症反应发生的经典检测指标,TNF-α 释放量的多少直接反应炎症的轻重[25-26]。而IL-1 一般产生于炎症早期,具有介导炎症产生的作用[3]。NF-κB 的活化对于TNF-α、IL-1 等炎症因子的的表达是必需的[27],因此抑制NF-κB 的活化很可能是治疗炎症的有效方法。
本研究结果显示,EEOLF 作用于LPS 诱导的RAW264.7 细胞后,可下调NF-κB p65 的蛋白表达及磷酸化水平,同时减少TNF-α、IL-1 等炎症因子的产生。而使用阳性对照药PDTC 后,NF-κB p65 的蛋白表达及磷酸化水平同样受到抑制,相应地,TNF-α、IL-1 等炎症因子的分泌也受到抑制。进一步揭示了EEOLF 可通过抑制NF-κB 的激活,抑制LPS 诱导的炎症反应。因此,以NF-κB 信号通路为切入点,研究EEOLF 作用于LPS 诱导的巨噬细胞后该通路的活性,能够为开发抗炎、抗免疫作用的药物提供有力的理论基础,为慢性免疫炎症性疾病患者带来福音。
另外,本研究还发现当EEOLF 单独作用于RAW264.7 细胞后,NF-κB 表达水平升高,这可能是因为药物作用于细胞后,细胞发生了应激反应。因为当细胞受到各种理化及生物性刺激时,将出现一系列适应代偿性反应,这些反应包括一系列非特异性反应,统称为细胞应激。而研究报道称NF-κB 是几种细胞应激信号核转导因子之一,细胞在受到外界刺激后,可通过经典途径或旁路途径激活NF-κB[28]。也就是说当细胞受到药物刺激后,发生了应激反应,激活了NF-κB,从而导致NF-κB 表达量有所升高,TNF-α 表达量有所升高可能也与NF-κB激活有关[29]。
综上所述,EEOLF 能减弱LPS 诱导的RAW264.7细胞炎症,其机制可能与EEOLF 能够调控NF-κB 通路有关,进而抑制TNF-α 和IL-1β 的释放。但抗炎是一个综合而复杂的过程,是多条信号通路共同作用的结果,具体作用机制还需进一步研究。
