蚯蚓堆制花生壳的微生物群落结构特征研究
2020-03-13陈玉香赵婷婷杜召振徐立新
陈玉香 姚 月 赵婷婷 杜召振 徐立新
(1.吉林大学生物与农业工程学院, 长春 130022; 2.吉林大学生命科学学院, 长春 130012)
0 引言
世界各地广泛种植花生,年产量约为4 600万t[1]。中国是世界上最大的花生生产国,每年生产大约1 300万t花生,占世界总产量的28.3%。花生产量的增加导致生产地区积累了大量花生壳。据统计,每生产1 kg花生可产生230~300 g花生壳[2],全世界每年生产大约1 370万t花生壳[1]。目前,研究者正努力寻求回收利用这种农业残余物的有效途径。例如,用花生壳制作发酵产氢的辅助底物[3]、生物活性低聚糖[4]、土壤改良剂[5]。花生壳粉末可用于增强环氧复合材料的机械性能和热性能[6],花生壳也用作固体燃料[7]或者饲料[4]。但只有少部分花生壳用于燃料等用途,其余几乎全部作为废弃物处理[8]。丢弃的花生壳易发生微生物腐败,造成严重环境污染。因此,合理利用花生壳不仅有利于保护环境,还可以开发农业废弃物资源化的新途径。
花生壳主要由多糖和木质素组成,与其他农业残余物不同,花生壳中木质素质量分数通常高于40%[4],增大了降解难度,严重限制了其应用。作为分解和利用有机废弃物的环境友好方式,堆肥受到越来越多的关注[9]。与无机肥相比,堆肥具有促进腐殖质(土壤有机质的主体部分)形成、改善植物生长并有效抑制植物病原体等优点[10-11]。由于花生壳具有高木质素含量,难于被降解,通过传统堆肥方式降解稳定花生壳不容易实现。蚯蚓堆制是一种广泛使用的降解稳定有机废弃物的方法,得到的堆制物氮、磷和腐殖酸含量适合用于土壤改良剂[12]。堆制过程涉及到微生物和蚯蚓的共同作用。微生物在有机废弃物的分解和稳定中起主要作用,蚯蚓具有促进作用。蚯蚓堆制成功用于各种木质纤维素类废弃物,如甘蔗渣[13]、落叶[14]和中药渣[15]等。迄今为止,关于蚯蚓堆制花生壳的研究很少。据报道,大多数蚯蚓不喜食富含木质素的有机废弃物,在无其他食物情况下,蚯蚓被迫取食富含木质素的物质,严重时会导致蚯蚓体重下降甚至死亡[16]。
本文探索蚯蚓堆制花生壳的可行性,揭示蚯蚓堆制花生壳过程中的微生物群落结构特征。
1 材料和方法
1.1 底物和蚯蚓物种
花生壳收集自山东省菏泽市某农场,并经400Y型多功能粉碎机粉碎处理。牛粪从吉林大学农学部养殖场收集。将物料风干至含水率为15%,然后储存在干燥的塑料容器中。物料的化学特征如表1所示。供试蚯蚓为赤子爱胜蚓(Eiseniafetida),购自当地市场。选择成年蚯蚓进行试验研究。将蚯蚓置于含有牛粪、粉碎的花生壳混合底物中,25℃,15 d,使其适应底物。

表1 初始底物的化学特征Tab.1 Chemical characteristics of initial substrates
注:数据为平均值±标准差,试验次数为3次。
1.2 蚯蚓堆制体系和取样方法
在开始堆制时向花生壳中添加牛粪,以降低花生壳的碳氮比,使其适于蚯蚓堆制。将粉碎的花生壳与牛粪以60∶40的比例混合(基于干质量)。蚯蚓堆制在塑料花盆(上口内径为18 cm,下口内径为10 cm,盆高为22 cm)中进行。每个花盆中放入1 000 g混合物料。分为两种处理:对照组(CK),为不接种蚯蚓的混合底物;接种蚯蚓处理组(T),每个花盆接种120条赤子爱胜蚓成蚓(平均体质量为0.3 g),每个处理3个重复。在接种蚯蚓之前,将盛有底物的塑料花盆室温(25℃)下放置15 d,隔天喷水以进行预堆制。初始混合底物标记为T0。所有花盆都用纱网覆盖并放置实验室中,室温保持约25℃。通过定期喷洒足量的无菌水,使基质含水率保持在55%~65%[15]。试验持续时间为48 d。将蚯蚓接种于底物后,每隔12 d取样一次(保证取样前后各花盆中蚯蚓接种率不变)。CK1、CK2、CK3、CK4和T1、T2、T3、T4均分别表示在第12、24、36、48天取样。在每个采样日,对成年蚯蚓(成蚓)、幼蚯蚓(幼蚓)和蚓茧进行人工分选并记录数量。将堆制底物样品在-70℃下冷冻保存,以进行化学成分和微生物群落结构分析。
1.3 化学成分分析
采用重铬酸钾和浓硫酸氧化法测定总有机碳(TOC)含量[17]。总氮(TN)含量采用半微量凯氏定氮法测定[18]。用对应的TOC和TN计算各采样日期的碳氮比。使用数字pH计测定pH值。将堆制物以1∶10(质量比)的比例置于双蒸水中,振荡20 min,定性滤纸过滤,收集滤液用于测定pH值[19]。纤维素、半纤维素和木质素的含量通过Van Soest方法测定[20]。
1.4 微生物群落结构分析
采用E.Z.N.A. DNA提取试剂盒(OMEGA Biotek.,美国),按照说明书步骤,分离提取DNA。从0.2 g样品中提取基因组DNA,设置3个平行试验,采用1%琼脂糖凝胶电泳鉴定DNA纯度,用于后续微生物群落分析。细菌引物序列为V338F(5′-ACTCCTACGGGAGGCAGCA-3′)和V806R(5′-ATGCAGGGACTACHVGGGTWTCTAAT-3′),扩增细菌16S rRNA基因的V3~V4区[21]。真菌引物序列为ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′),扩增真菌18S rRNA基因的ITS序列[22]。所有PCR反应均按文献[23]进行。纯化的PCR产物用于高通量测序,由上海美吉生物医药科技有限公司完成。采用微生物生态学定量分析方法[24]进行序列分析。使用SILVA数据库进行物种注释,按照序列一致性为97%将序列聚类成操作分类单元(OTUs)[25],计算丰度和多样性指数(ACE、Chao 1和Shannon-Wiener)。
1.5 统计分析
使用SPSS 16.0进行数据分析。两因素方差分析用于确定采样日期和蚯蚓接种对底物碳氮比变化的影响。单因素方差分析用于分析采样日期对成年蚯蚓、幼蚯蚓和蚓茧数量的影响。采用T检验比较细菌和真菌组成在属水平上的差异。所有结果表示为平均值±标准差。当p<0.05时,认为结果具有统计学意义。
2 结果与分析
2.1 蚯蚓堆制过程中TOC、TN含量和碳氮比的变化
蚯蚓堆制过程中TOC、TN含量的变化如表2所示。初始物料TOC质量比为412.69 g/kg。在蚯蚓堆制结束时,蚯蚓处理组和对照组的TOC质量比分别为328.63、359.81 g/kg。在整个蚯蚓堆制过程中TOC含量呈下降趋势,同一处理组不同时间的样品间有显著性差异(p<0.05)。蚯蚓处理组与对照组之间也存在显著差异(p<0.05)。蚯蚓处理组TOC含量下降速度明显快于对照组。许多研究也报道了堆制过程中TOC含量的减少情况[26-27],这主要是由于有机碳在分解过程中以CO2的形式释放,一方面是蚯蚓以及微生物呼吸作用;另一方面是因为TOC的矿化作用。TN含量在蚯蚓堆制过程中呈上升趋势。最初底物的TN质量比为10.92 g/kg。堆制结束时,蚯蚓堆制组和对照组的TN质量比分别为24.77、15.54 g/kg。在初始阶段,蚯蚓处理组与对照组之间的TN含量没有显著差异。从第36天开始,蚯蚓处理组与对照组的TN含量存在显著差异(p<0.05)。ARUMUGAM等[26]报道,TN含量的增加可能与蚯蚓分泌粘液、含氮排泄物质、促生长激素和酶有关。在蚯蚓处理组观察到更高的TN含量,这与ARUMUGAM等观点一致。在整个堆制过程中碳氮比呈下降趋势(图1)。初始底物的碳氮比约为37.00。第12天CK和T处理的碳氮比分别为34.12和31.91。第36天,CK和T处理的碳氮比分别为25.01和19.77。第48天,相应的值分别为23.17和13.28。碳氮比降低是由于在蚯蚓堆制过程中TOC含量的降低和TN含量的增加[26],碳氮比降低也归因于有机氮的矿化速率低于有机碳的矿化速率[28]。接种蚯蚓显著降低碳氮比(F(1,20)=409.795,p<0.001)。此外,蚯蚓的作用与采样时间有关(F(4,20)=1.271×103,p<0.001),蚯蚓处理与采样时间之间存在显著的交互作用(F(4,20)=85.210,p<0.001)。可以用碳氮比表征堆制物料的成熟度。对于堆制物,碳氮比低于20是可接受的[29]。第36天时,蚯蚓堆制物料的碳氮比低于20.00。然而在对照组中该比率大于20.00,表明堆制物料不稳定。第48天,蚯蚓处理组的碳氮比小于15.00,而对照组中则为23.17。堆制物碳氮比为15或更低,则适合于农业生产[30]。本结果表明,蚯蚓对花生壳的降解稳定具有促进作用。

表2 堆制过程中TOC、TN含量的变化Tab.2 Changes in TOC and TN during vermicomposting g/kg
注: 同一列不同小字字母表示差异显著(p<0.05),下同。

图1 蚯蚓堆制过程中底物的碳氮比变化曲线Fig.1 C/N ratios of substrates during vermicomposting
2.2 蚯蚓堆制过程中蚯蚓数量的变化
在堆制期间每次取样时,将蚓茧和幼蚓取出并置于另外的容器中培养。在每个采样日记录成蚓、幼蚓和蚓茧的数量(表3)。在堆制过程中,发现有蚯蚓死亡,到蚯蚓堆制结束时,死亡率为19%。一般来说,堆制系统中,蚯蚓的存活主要取决于其所能获得底物化学成分[31]。此外,有机物的分解产物如氨、氮氧化物、二氧化碳、有机酸和其他中间化合物也可能导致蚯蚓死亡[32]。除了上述原因外,花生壳中高含量木质素也可能导致蚯蚓死亡。木质素含量对蚯蚓存活的不利影响已被报道[16]。尽管有少量蚯蚓死亡,蚯蚓处理组中花生壳的分解速率仍比对照组快得多。在蚯蚓堆制过程中,蚓茧和幼蚓的出现表明该蚯蚓品种对花生壳类底物具有一定适应性,可以采用蚯蚓堆制降解稳定花生壳。

表3 蚯蚓堆制期间成蚓、幼蚓和蚓茧的数量Tab.3 Number of adult earthworms, juvenile earthworms and cocoons during vermicomposting
2.3 微生物群落的丰富性和多样性
每个处理组的细菌和真菌稀释曲线表明,样本量足以表征两种处理方式下微生物多样性的差异(图2)。为分析样品微生物群落的丰富性和多样性,设置97%相似度水平下,每种处理的OTUs数量如表4所示。在初始混合底物中,细菌和真菌的OTUs数量分别为1 154和111。在第12天采集的样本中,对照组和蚯蚓堆制组中细菌的OTUs数量分别为1 354和1 382,真菌的OTUs数量分别为104和165。这表明与对照组相比,蚯蚓处理组的OTUs数量增加。在第2次采集样品中,蚯蚓处理组真菌的OTUs数量远高于对照组。然而,蚯蚓处理组中细菌的OTUs数量略低于对照组。这与MOODY等[33]的观点不同:MOODY等认为,蚯蚓可以选择性地以某些真菌为食,从而导致堆制物中真菌多样性有一定下降。在蚯蚓堆制过程中,ACE指数和Chao 1指数的变化趋势与OTUs数量变化趋势一致(表4)。对于细菌,Shannon-Wiener指数在堆制期间随时间没有显著变化,该值约为5。然而对于真菌,蚯蚓处理组的Shannon-Wiener指数远高于相应对照组。初始底物中真菌的Shannon-Wiener指数为1.33,在第1次采样时,蚯蚓处理组的Shannon-Wiener指数为2.56,对照组中为1.42。在堆制结束时,蚯蚓处理组和对照组的Shannon-Wiener指数分别为2.59和1.66。这表明蚯蚓的存在增加了真菌的多样性。本研究结果与中药渣蚯蚓堆制获得的结果不同[34],文献[34]中蚯蚓堆制物料的细菌Shannon-Wiener指数高于6。然而,在本研究中,观察到细菌活性受到些许抑制,这可能是由于所使用的底物不同。

图2 细菌16S rRNA和真菌18S rRNA序列的稀释曲线Fig.2 Rarefaction curves of sequences of bacterial 16S rRNA and fungal 18S rRNA depicting effect of 3% dissimilarity on number of OTUs identified in samplings
2.4 微生物群落的相似性
采用聚类分析可更好地了解每种处理组微生物群落结构的相似性(图3)。在树状图中分离出2个分支,第1个分支代表蚯蚓处理组的细菌或真菌群落,第2个分支是对照组和初始混合底物中的细菌或真菌群落。蚯蚓处理的细菌相似度为82%(图3a),初始底物的细菌组成更接近于对照组。对于真菌(图3b),初始底物与对照组相似度达到88%,蚯蚓处理组为87%。该结果表明初始底物的微生物组成与对照组的微生物组成更为相似,蚯蚓在改变微生物的组成中起重要作用。
非度量多维尺度(NMDS)分析表明,蚯蚓堆制组的微生物群落结构与初始底物、对照组不同(图4)。细菌(图4a)和真菌(图4b)均分为两组,一个是蚯蚓处理组,另一个是对照组与初始底物。NMDS1显示蚯蚓处理组微生物群落与对照组和初始底物的不同。此外,对照组中的NMDS2比蚯蚓处理组的变异性更大。图4a中,蚯蚓堆制组中的T1远离T2、T3和T4,这一现象表明,蚯蚓堆制初期与后期的细菌组成有差异,这也说明了蚯蚓对花生壳分解的促进作用与时间有关。这些发现进一步证实了树状图所显示的结果。

表4 97%相似水平下16S rRNA和18S rRNA基因文库的操作分类单元数及群落丰富度和多样性指数的比较Tab.4 Comparison of operational taxonomic units (OTUs) richness and diversity indices of 16S rRNA and 18S rRNA gene libraries for clustering at 97% identity
注:括号中的数据表示置信区间。
2.5 微生物群落的组成
表5显示了门分类水平的微生物组成。对于细菌,在两种处理组优势微生物门类是Proteobacteria、Actinobacteria、Bacteroidetes、Firmicutes和Chloroflexi,占细菌总量的88%~95%。其中以Proteobacteria最多,其次为Actinobacteria。在其他堆制体系中,Proteobacteria、Actinobacteria、Bacteroidetes和Firmicutes也经常作为优势微生物出现[35-36]。PARTANEN等[37]认为在堆制过程中占主导地位的细菌通常是Chloroflexi。Actinobacteria是成熟堆制物的一类代表性细菌[38],并且被认为是重要的木质纤维素降解物[39]。在本研究蚯蚓处理组中,Actinobacteria的相对丰度随着时间的推进而增加,蚯蚓处理组底物的降解速度快于对照组,并且在堆制过程结束时达到峰值,这表明堆制物成熟。Bacteroidetes能够降解包括纤维素和几丁质在内的大分子[40]。在许多研究中证明了Proteobacteria、Actinobacteria和Bacteroidetes在有机物的降解,硫、氮和碳循环中也起到了重要作用[41]。但是PENG等[42]证实,Bacteroidetes不利于好氧堆肥,因为它可以将木质纤维素转化为小分子脂肪酸链,从而降低堆肥的pH值。与对照组相比,Firmicutes的丰度在蚯蚓处理组呈现增加趋势。据报道,Firmicutes可产生纤维素酶、脂肪酶、蛋白酶和其他胞外酶,并代谢多种底物,包括蛋白质、脂质、木质素、纤维素、糖和氨基酸[43]。值得注意的是,与对照组相比,堆制初期蚯蚓处理组Saccharibacteria的相对丰度迅速增加。AWASTHI等[44]在堆制明胶工业污泥过程中添加高剂量生物炭发现Saccharibacteria的存在,认为生物炭与初始堆制底物混合,可以确保有效的孔隙率和通风状况,提高微生物活性。在本研究中,蚯蚓在堆制物料内的爬行改善了氧的通透性,其作用类似于生物炭的添加。因此,蚯蚓处理组Saccharibacteria的相对丰度迅速增加。对于真菌,在蚯蚓处理组和对照组中,Ascomycota和unclassfied_k_Fungi是主要的微生物门类。这些结果与AWASTHI等[44]研究结果一致。据报道,Ascomycota在好氧堆制过程中普遍存在[45]。Ascomycota的丰度随着时间的推进而减少,而unclassfied _k_Fungi呈现出增加的趋势。

图3 细菌和真菌测序结果的聚类分析Fig.3 Cluster analysis based on sequencing taxonomy of bacteria and fungi
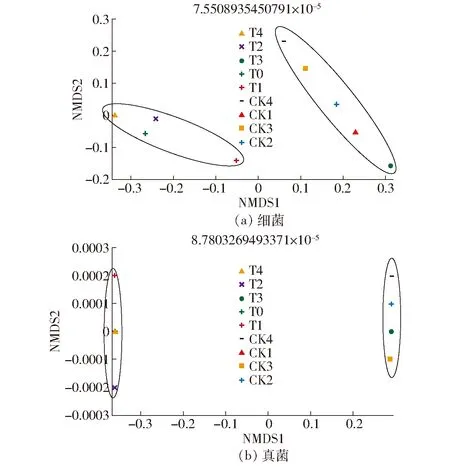
图4 细菌和真菌测序结果的NMDS维度分析Fig.4 NMDS dimension analysis based on sequencing taxonomy of bacteria and fungi
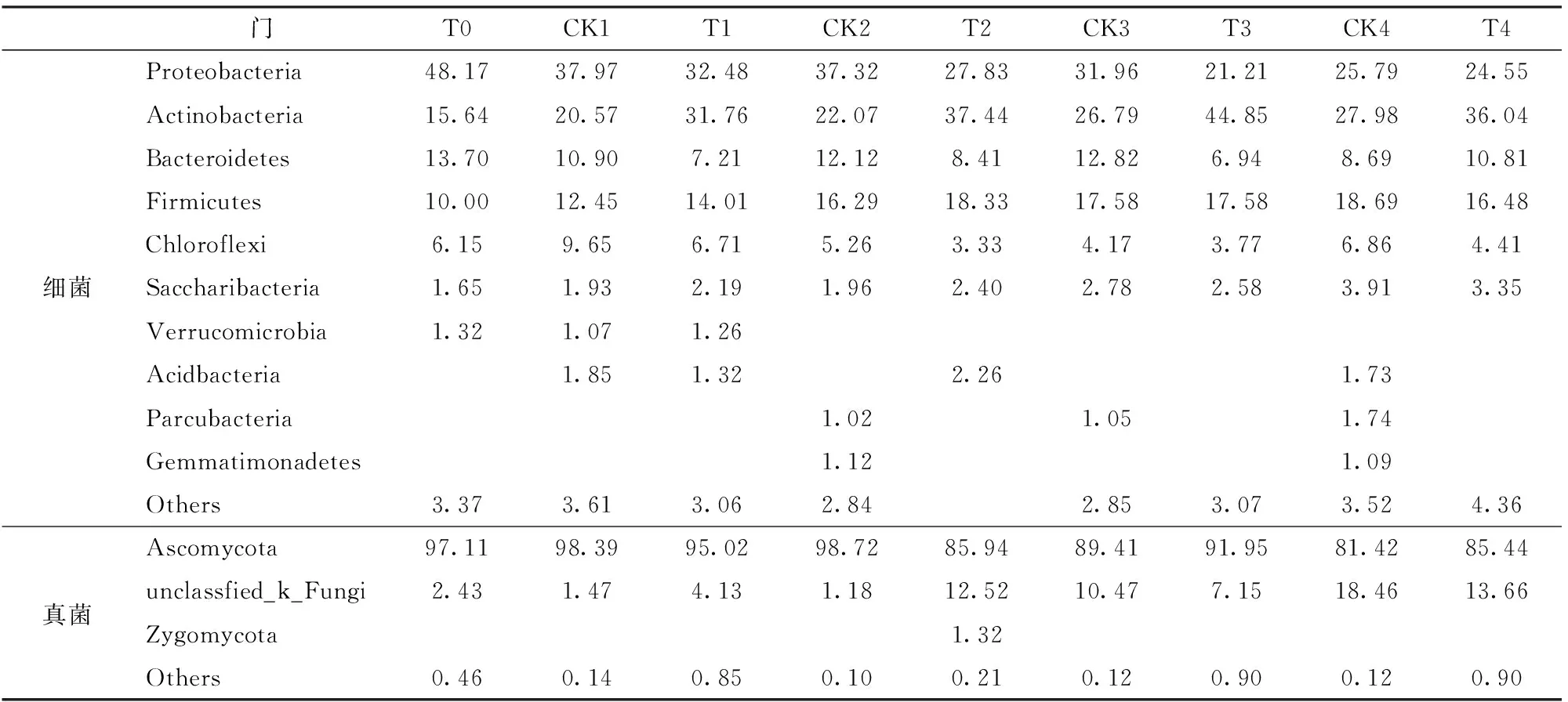
表5 门分类水平微生物相对丰度Tab.5 Relative abundance of microbes at phylum level %
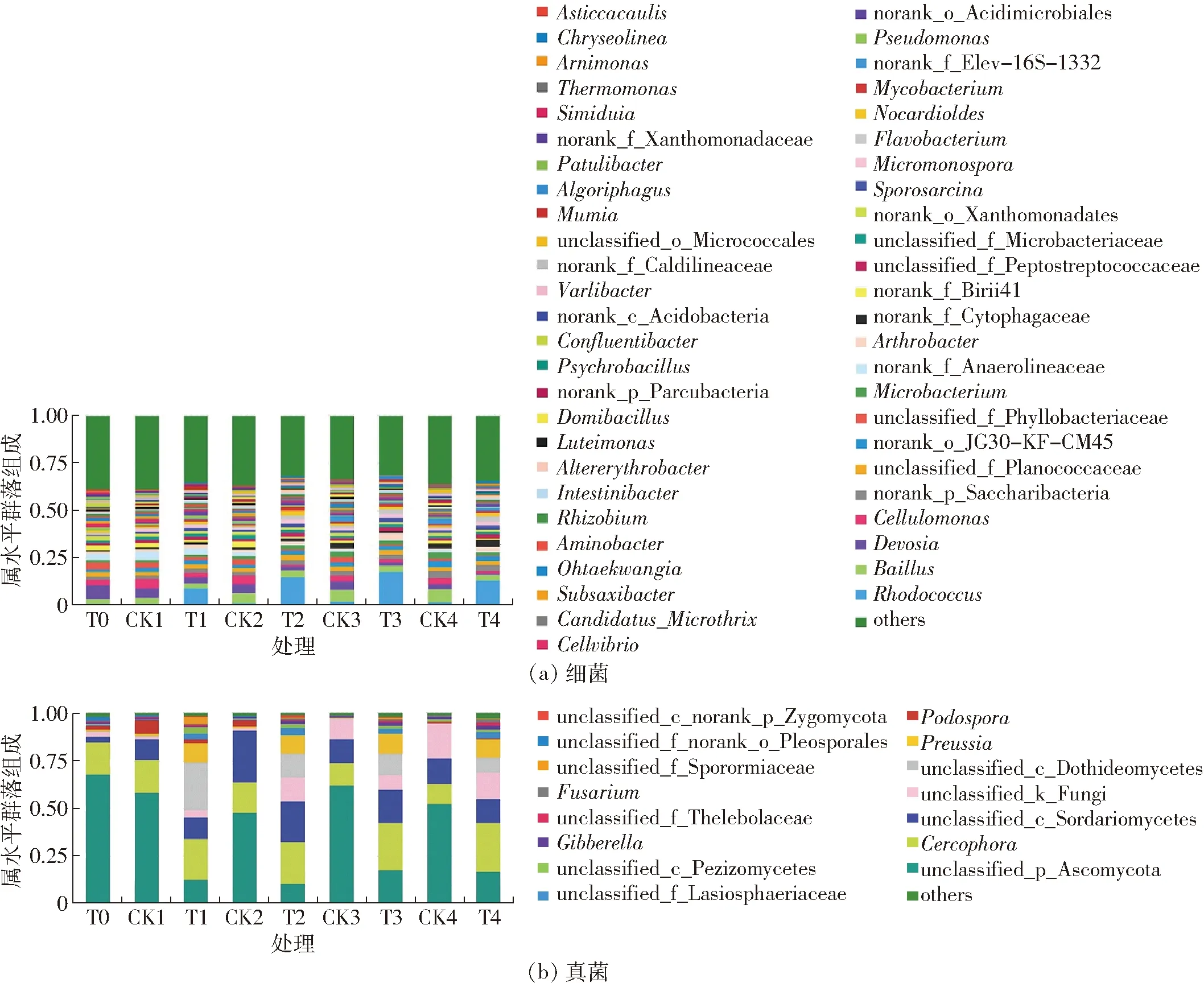
图5 细菌和真菌属的组成Fig.5 Composition of bacterial and fungal communities at genus level
图5显示了属分类水平的微生物组成。在初始混合底物中,优势细菌是Devosia、unclassified_f_Phy11obacteriaceae、norank_o_Anaerolineaceae、norank_f_BIrii41、Cellulomonas和Bacillus,其相对丰度分别为7.50%、3.94%、3.56%、3.08%、3.01%和2.52%。Devosia被认为是有机废弃物堆肥过程中早期阶段的可能生物标志物[46]。优势真菌为unclassified_p_Ascomycota、Cercophora和unclassified_c_Sordariomycetes,相对丰度分别为68.06%、16.67%和3.26%。接种蚯蚓改变了细菌的组成。在蚯蚓堆制组第12天采集的样品中,优势菌属是Rhodococcus、Devosia、norank_f_Anaerolineaceae、Bacillus、Cellulomonas、Arthrobacter和norank_p_Saccharibacteria,这些属的相对丰度分别为9.03%、3.67%、3.17%、2.44%、2.33%、2.30%和2.17%。对照组中,优势菌属是Devosia、norank_f_ Anaerolineaceae、Cellulomonas和Bacillus,其相对丰度分别为5.07%、4.79%、4.70%和3.34%。堆肥过程中,Cellulomonas可以加速有机物的降解,接种蚯蚓增加了堆肥早期Cellulomonas的相对丰度。在对照组未观察到Rhodococcus。在蚯蚓堆制组初期阶段,Rhodococcus的相对丰度呈增加趋势,在后期开始出现减少现象,在第24、36、48天时相对丰度分别为15.13%、17.76%和13.42%。蚯蚓堆制组第24天采集的样品中,优势细菌是Rhodococcus、Bacillus、unclassified_f_Planococcaceae和norank_p_Saccharibacteria。对照组中,优势细菌是Bacillus、Cellulomona、Devosia和norank_f_BIrii41。Bacillus的相对丰度在堆制初期增加,证明Bacillus具有较强的分解复杂有机物作用。使用T检验进行蚯蚓处理组和对照组中微生物组成的比较。图6a(图中***、**、*分别表示处理间在0.001、0.01、0.05水平上差异显著)显示了两种处理之间细菌组成的差异。在蚯蚓处理组中观察到Rhodococcus的相对丰度显著增加(p<0.001),Arthrobacter、unclassified_f_Peptostreptococcaceae和Sporosarcina的相对丰度也显著增加。微生物的组成与分解速率直接相关。结果表明,接种蚯蚓可能促进堆肥过程中有机物的分解和改变细菌群落的组成。据报道,一些Rhodococcus属的微生物有转化某些木质纤维素或芳香烃的潜力[47]。Rhodococcus在蚯蚓处理组显著增加可能是花生壳分解更快的一个原因。在蚯蚓堆制橄榄油加工废弃物的过程中也观察到了Rhodococcus[38]。该属在蚯蚓堆制过程中并不常见,其存在可能与底物的化学组成有关。一些种类的Bacillus和Cellulomonas因其分解纤维素和半纤维素活性而众所周知[48]。据报道,节杆菌可降解单环芳香族化合物,其在降解由真菌产生的小分子量中间产物中起重要作用[39]。对于真菌,蚯蚓处理组第12天采集的样本中,优势属是Cercophora、unclassified_c_Dothideomycetes、unclassified_p_Ascomycota、unclassified_c_Sordariomycetes和Preussia,其相对丰度分别为24.94%、21.50%、12.58%、10.94%和10.45%。在对照组,优势属是unclassified_p_Ascomycota、Cercophora、unclassified_c_Sordariomycetes和Podospora,相对丰度分别为58.31%、17.32%、10.81%和7.32%。这表明蚯蚓的存在影响了真菌的组成。在对照组未观察到unclassified_c_Dothideomycetes。据报道,Dothideomycetes和Sordariomycetes具有分解木质纤维素的能力[49]。Cercophora的大多数种类也是木质纤维素分解者,能够产生各种木质纤维素分解酶[50]。Preussia一些种类可以在植物残枝或牛粪上生长[51]。在蚯蚓处理组第24天采集的样品中,优势真菌属是Cercophora、unclassified_c_Sordariomycetes、unclassified_k_Fungi、unclassified_c_Dothideomycetes、unclassified_p_Ascomycota和Preussia,其相对丰度分别为21.85%、21.45%、12.54%、12.48%、10.52%和9.64%。同期对照组的优势属为unclassified_c_Ascomycota、unclassified_c_Sordariomycetes和Cercophora,相对丰度分别为47.71%、27.52%和16.04%。这表明在堆制过程中蚯蚓的存在增加了真菌多样性。在第36天和第48天采集的样品的优势属和第24天的优势属相似。在堆制后期,对照组的优势菌属相对丰度减小,认为是底物逐渐耗尽导致。与对照组相比,蚯蚓堆制组的优势真菌相对丰度在堆制后期变化较小,可能是由于蚯蚓的分泌粘液和排泄物以及死亡的蚯蚓提供了养分维持微生物生长。图6b 显示了蚯蚓处理组和对照组之间的真菌组成的差异。在蚯蚓处理组,Cercophora、unclassified_c_Dothideomycetes、Preussia和unclassified_f_Lasiosphaeriaceae相对丰度显著增加。结果表明,蚯蚓的存在和堆制时间均对堆制底物的群落组成有一定的影响。

图6 细菌和真菌组成的T检验Fig.6 T-test for bacterial and fungal composition at genus level
3 结束语
将花生壳与牛粪混合后,利用接种赤子爱胜蚓进行堆制。在蚯蚓堆制过程中观察到蚓茧和幼蚓,在堆制结束时,赤子爱胜蚓的死亡率为19%,表明蚯蚓在一定程度上适应了高木质素含量的花生壳类底物。堆制结束时,蚯蚓处理组的碳氮比小于15.00,表明蚯蚓降低了有机碳含量,提高了全氮含量,从而降低了碳氮比,促进了花生壳的稳定降解。蚯蚓处理组中Rhodococcus、Arthrobacter、unclassified_f_Peptostreptococcaceae、Sporosarcina、Cercophora、unclassified_c_Dothideomycetes、Preussia和unclassified_f_Lasiosphaeriaceae的相对丰度显著增加,表明蚯蚓能够改变堆制底物微生物群落结构,加快矿化、腐殖化过程和有机质的分解。蚯蚓堆制可以作为一种利用花生壳的生物学方法,且能够提高堆制终产物的真菌多样性。
