大花铁线莲单重被花的转录组差异分析
2020-03-13熊阳阳罗琳莉赵士豪周安龙
熊阳阳 罗琳莉 赵士豪 周安龙 王 锦
(西南林业大学园林学院,昆明 650224)
被誉为“攀援植物皇后”的铁线莲隶属毛茛科(Ranunculaceae)铁线莲属(Clematis),因铁线莲无花瓣,其显示出的花瓣实际是由萼片发育出来,故形态学中将其不同形态的花瓣称之为花被。大花铁线莲花型由于萼瓣数的不同及雌雄蕊不同程度的瓣化显现出单瓣、半重瓣及重瓣3种不同的形态。观赏植物的花朵重瓣程度高低对其观赏效果有极大的影响,而重瓣花也随其应用价值提升近年来成为观赏植物育种的重点对象。近年来研究成果中发现,与植物花发育相关的基因并且参与花发育调控网络的转录因子大部分都属于MADS-box基因家族[1],在ABCDE模型相关的基因中现已被报道出对植物重瓣花性状起到调控作用的基因亚家族主要有AP1、AP3[2~3]、PI[3~4]、AGAMOUS[5~6]、FRUITFULL[7]、TM6-like[8]、SEP[9]等。影响花器官形成的条件有光照、温度、水分、肥料及生长调节物质[10]。开花诱导是开花发育的关键,也是植物生殖生长的启动阶段,受光周期促进、自发促进、春化作用、开花抑制、赤霉素诱导以及年龄途径等多条途径控制[11]。重瓣花性状的形成是外界条件及内在多类基因表达共同作用的结果。之前通过石蜡切片的试验了解到大花铁线莲重被花的形态起源方式为雌雄蕊不同程度的瓣化,但铁线莲重瓣化形成的分子调控机理仍然未知。典型的铁线莲重被品种“薇安”(C.patens‘Vyvyan Pennell’)在不同季节表现为重被与单被的特性是探究重被花形成机制较好的研究素材。本次研究采用高通量测序技术对铁线莲“薇安”同一株上出现的3种不同花型(单被、半重被、重被)进行测序并分析相关生物学信息。应用转录组测序技术能在减少成本的同时获取大量 EST,发掘功能基因成为一种非常高效可靠且高输出的重要手段,适合缺乏基因组信息的非模式物种开展生物信息学相关研究[12]。通过转录本的丰富情况反映出3个样本中各差异基因的表达水平,并采用RT-qPCR技术进一步验证,初步筛选出可能参与铁线莲单重被花性状调控的关键基因,为后续在分子水平上继续发掘铁线莲重瓣化的调控基因及具体的克隆、分离与表达等研究提供基础的理论依据。
1 材料与方法
1.1 试验材料
该试验材料选取引进的早花大花型线莲中典型的重被品种“薇安”(C.patens‘Vyvyan Pennell’)同一株上同一时期3种不同花型的完整花瓣(图1)进行转录组测序。该品种由于雄蕊瓣化程度不同进而外观上产生即可开单瓣又可开半重瓣及重瓣的性状。材料取下后放入液氮中速冻,之后保存在超低温冰箱中备用。

图1 供试材料“薇安”Fig.1 Test materials C.patens‘Vyvyan Pennell’
1.2 样品检测及cDNA文库的构建
将铁线莲“薇安”的3个样品(A:单被花;B:半重被;C:重被)送往北京诺禾致源科技生物公司。先使用Qubit2.0和Agilent 2100检测RNA的浓度和完整度,再使用Q-PCR方法对文库的有效浓度进行准确定量。RNA浓度检验合格后通过PCR富集得到cDNA文库,Clean reads采用Trinity v2.4.0软件拼接成为transcripts[13]。
1.3 序列拼接、功能注释及生物学通路分析
使用blast软件将unigene序列分别与KOG、NR、NT、Swiss-Prot、KEGG、GO和Pfam数据库进行比对统计功能注释信息[14]。利用diamond软件获得NR、KOG及Swiss-Prot库的基因功能注释信息后,采用blast2go软件获取unigenes的GO注释信息,再用KAAS软件将unigenes与KEGG数据库进行比对[15]。利用GOseq R和KOBAS软件包进行差异表达基因GO和KEGG富集分析[16]。
1.4 差异基因筛选及荧光定量PCR验证
先采用TMM对read count数据进行标准化处理,再用DEGseq进行差异分析,筛选阈值为Q-value<0.05且|log2FoldChange|>1,且Q-value越小基因表达量差异越显著[17]。在3个样品中共存的差异表达基因中筛选出与铁线莲花芽分化的相关关键基因进行荧光定量PCR验证。用肌动蛋白(actin>Cluster-24019.26582[Sedum alfredii])作为内参基因,用primer5.0设计PCR引物序列,各基因设3次PCR重复检测,利用2^-△△Ct分析基因的相对表达量[18],用超微量核酸蛋白测定仪(scandrop100)检测RNA OD值,A260/A280比值计算RNA纯度。样品RNA检测结果见表1,设定引物序列(5′—3′)见表2。

表1 样品RNA检测结果

表2 荧光定量PCR引物设定

图2 差异基因维恩图Fig.2 Differential gene venn diagram
2 结果与分析2.1 数据组装拼接
通过转录组测序,共获取3个样品(A:单被花;B:半重被;C:重被)的转录组文库,产生13.8GB原始数据。3个样本Phred数值大于30比例(%)均超过87.44%。对组装结果进行统计,共产生转录组序列146 036个,基因99 652个。序列长度分布在201~14 638 bp,平均长度977 bp。N50分别为1 679及1 825 bp,拼接效果较好。
2.2 基因功能分类
将组装得到的99 652条All-unigenes分别与7个公共数据库NR、NT、Swiss-Prot、KEGG、GO、Pfam和KOG比对,结果有9 133条(9.16%)unigenes在以上7个数据库中均注释成功。在转录本中,能够被注释到GO分类的Unigene有47 346条(47.51%),有16 484条Unigene注释到KOG数据库,占总基因数的16.54%。KEGG通路分析共有23 555个基因参与了19个代谢通路,占总unigene的23.64%。通过与Nr库进行比对注释获取到与铁线莲基因序列最近缘的物种是莲(Nelumbonucifera)[19]。
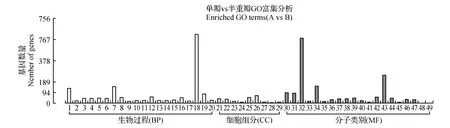
图3 单被薇安与半重被薇安差异基因GO富集柱状图 横坐标为GO三个大类的下一层级的GO term,纵坐标为注释到该term下(包括该term的子term)的差异基因个数 1.碳水化合物代谢过程;2.对生长素的反应;3.细胞葡聚糖代谢过程;4.葡聚糖代谢过程;5.多糖代谢过程;6.细胞多糖代谢过程;7.氧化还原过程;8.细胞碳水化合物代谢过程;9.细胞壁修饰;10.激素反应;11.对内生刺激的反应;12.脂类生物合成的过程;13.脂肪酸生物合成过程;14.对有机物的反应;15.脂肪酸代谢过程;16.化学反应;17. 细胞壁组织;18.代谢过程;19.脂质代谢过程;20.细胞壁组织或生物发生;21.外部封装结构;22.细胞壁;23.质外体;24.脂肪酸合成酶复合物;25.细胞外围;26.胞外区;27.胞质部分;28.BB若干;29.细胞胞质;30.水解酶活性,作用于糖基键;31.水解酶活性,水解邻糖基化合物;32.催化活性;33.木葡聚糖:木葡糖苷转移酶活性;34.氧化还原酶活性;35.果胶酯酶活性;36.酶抑制剂的活性;37.血红素结合;38.四吡咯粘合物;39.转移酶活性,转移己糖基;40.羧酸酯水解酶活性;41. 3-氧基酰基载体蛋白质合成酶活性;42.转移酶活性,转移糖基;43.水解酶活性;44.转移酶活性,转移酰基;45.脂肪酸合酶活性;46.转移酶活性,转移氨基酰基以外的酰基;47.铁离子结合;48.腺苷同型半膀氨酸酶活动;49.水解酶活性,作用于醚键Fig.3 Single and semidouble flower C.patens‘Vyvyan Pennell’ GO enriched terms 1.Carbohydrate metabolic process; 2.Response to auxin; 3.Cellular glucan metabolic process; 4.Glucan metabolic process; 5.Polysaccharide metabolic process; 6.Cellular polysaccharide metabolic process; 7.Oxidation-reduction process; 8.Cellular carbohydrate metabolic process; 9.Cell wall modification; 10.Response to hormone; 11.Response to endogenous stimulus; 12.Lipid biosynthetic process; 13.Fatty acid biosynthetic process; 14.Response to organic substance; 15.Fatty acid metabolic process; 16.Response to chemical; 17.Cell wall organization; 18.Metabolic process; 19.Lipid metabolic process; 20.Cell wall organization or biogenesis; 21.External encapsulating structure organization; 22.Cell wall; 23.Apoplast; 24.Fatty acid synthase complex; 25.Cell periphery; 26.Extracellular region; 27.Cytosolic part; 28.BBSome; 29.Cytosol; 30.Hydrolase activity,acting on glycosyl bonds; 31.Hydrolase activity,hydrolyzing O-glycosyl compounds; 32.Catalytic activity; 33.Xyloglucan:xyloglucosyl transferase activity; 34.Oxidoreductase activity; 35.Pectinesterase activity; 36.Enzyme inhibitor activity; 37.Heme binding; 38.Tetrapyrrole binding; 39.Transferase activity, transferring hexosyl groups; 40.Carboxylic ester hydrolase activity; 41. 3-oxoacyl-[acyl-carrier-protein] synthase activity; 42.Transferase activity,transferring glycosyl groups; 43.Transferase activity,transfer sugar-based; 44.Hydroase activity; 45.Fatty acid synthase activity transferase activityl; 46.Transferase activity,transferring acyl groups other than amino-acyl groups; 47.Adenosylhomocysteinase activity; 48.Iron ion binding; 49.Hydrolase activity,acting on ether bonds

图4 单被薇安与重被薇安差异基因GO富集柱状图 1.碳水化合物代谢过程;2.细胞葡聚糖代谢过程;3.葡聚糖代谢过程;4.细胞多糖代谢过程;5.多糖代谢过程;6.细胞碳水化合物代谢过程;7.氧化还原过程;8.防御反应;9.蔗糖代谢过程;10.淀粉代谢过程;11.二糖代谢过程;12.细胞壁组织或生物发生;13.单个有机体代谢过程;14.胺生物合成的过程;15.细胞生物胺生物合成工艺;16.Wnt信号通路负调控;17.酪氨酸代谢过程;18.逆境反应;19.细胞壁修饰;20.细胞壁组织;21.细胞壁;22.外部封装结构;23.质外体;24.胞外区;25.细胞外围;26.水解酶活性,水解邻糖基化合物;27.水解酶活性,作用于糖基键;28.氧化还原酶活性;29.血红素结合;30.木葡聚糖:木葡糖苷转移酶活性;31.四吡咯粘合物;32.催化活性;33.转移酶活性,转移糖基;34.酶抑制剂的活性;35.转移酶活性,转移己糖基;36.碳氧裂解酶的活动;37.聚半乳糖醛酶活性;38.果胶酯酶活性;39.抗氧化活性;40.过氧化物酶活性;41.氧化还原酶活性,作用于过氧化氢作为受体;42.色氨酸合成酶活性;43.铁离子结合;44.羧酸酯水解酶活性;45.裂合酶活性Fig.4 Single and double flower C.patens‘Vyvyan Pennell’ GO enriched term 1.Carbohydrate metabolic process; 2.Cellular glucan metabolic process; 3.Glucan metabolic process; 4.Cellular polysaccharide metabolic process; 5.Polysaccharide metabolic process; 6.Cellular carbohydrate metabolic process; 7.Oxidation-reduction process; 8.Defense response; 9.Sucrose metabolic process; 10.Starch metabolic process; 11.Disaccharide metabolic process; 12.Cell wall organization or biogenesis; 13.Single-organism metabolic process; 14.Amine biosynthetic process; 15.Cellular biogenic amine biosynthetic process; 16.Negative regulation of Wnt signaling pathway; 17.Tyrosine metabolic process; 18.Response to stress; 19.Cell wall modification; 20.Cell wall organization; 21.Cell wall; 22.External encapsulating structure; 23.Apoplast; 24.Extracellular region part; 25.Cell periphery; 26.Hydrolase activity,hydrolyzing O-glycosyl compounds; 27.Hydrolase activity,acting on glycosyl bonds; 28.Oxidoreductase activity; 29.Heme binding; 30.Xyloglucan:xyloglucosyl transferase activity; 31.Tetrapyrrole binding; 32.Catalytic activity; 33.Transferase activity,transferring glycosyl groups; 34.Enzyme inhibitor activity; 35.Transferase activity,transferring hexosyl groups; 36.Carbon-oxygen lyase activity; 37.Polygalacturonase activity; 38.Pectinesterase activity; 39.Antioxidant activity; 40.Peroxidase activity; 41.Oxidoreductase activity,acting on peroxide as acceptor; 42.Tryptophan synthase activity; 43.Iron ion binding; 44.Carboxylic ester hydrolase activity; 45.Lyase activity

图5 半重被薇安与重被薇安差异基因GO富集柱状图 1.碳水化合物代谢过程;2.多糖代谢过程;3.细胞葡聚糖代谢过程;4.葡聚糖代谢过程;5.细胞多糖代谢过程;6.细胞碳水化合物代谢过程;7.单细胞碳水化合物代谢过程;8.单个有机体代谢过程;9.二糖代谢过程;10.蔗糖代谢过程;11.淀粉代谢过程;12.核糖体生物合成;13.寡糖代谢过程;14.氧化还原过程;15.细胞壁修饰;16.核糖核蛋白复杂生物起源;17.细胞壁组织或生物起源;18.含吲哚的复合生物合成过程;19.外部封装结构组织;20.细胞壁组织;21.外部封装结构;22.细胞壁;23.质外体;24.细胞外围;25.核糖体;26.病毒基因组;27.β-半乳糖苷酶复合体;28.胞外区;29.细胞外基质;30.膜的固有成分;31.膜的积分分量;32.蛋白质的细胞外基质;33.光系统Ⅰ;34.精母细胞5-精母细胞6复合体;35.细胞内核糖核蛋白复合体;36.核糖核蛋白复合体;37.核糖体的结构成分;38.木葡聚糖:木葡糖苷转移酶的活性;39.结构分子活性;40.水解酶活性,水解邻糖基化合物;41.酶抑制剂的活性;42.氧化还原酶活性;43.水解酶活性,作用于糖基键;44.转移酶活性,转移糖基;45.羧酸酯水解酶活性;46.催化活性;47.果胶酯酶活性;48.转移酶活性,转移己糖基;49.聚半乳糖醛酶活性;50.色氨酸合成酶活性;51.β-半乳糖苷酶活性;52.DNA-3甲基腺嘌呤糖基化酶的活性;53.DNA-3甲基碱糖基化酶的活性;54.碳氧裂解酶活性,作用于多糖;55.半乳糖苷酶活性;56.裂合酶活性Fig.5 Simidouble and double flower C.patens‘Vyvyan Pennell’GO enriched term 1.Carbohydrate metabolic process; 2.Polysaccharide metabolic process; 3.Cellular glucan metabolic process; 4.Glucan metabolic process; 5.Cellular polysaccharide metabolic process; 6.Cellular carbohydrate metabolic process; 7.Single-organism carbohydrate metabolic process; 8.Single-organism metabolic process; 9.Disaccharide metabolic process; 10.Sucrose metabolic process; 11.Starch metabolic process; 12.Ribosome biogenesis; 13.Oligosaccharide metabolic process; 14.Oxidation-reduction process; 15.Cell wall modification; 16.Ribonucleoprotein complex biogenesis; 17.Cell wall organization or biogenesis; 18.Indole-containing compound biosynthetic process; 19.External encapsulating structure organization; 20.Cell wall organization; 21.External encapsulating structure; 22.Cell wall; 23.Apoplast; 24.Cell periphery; 25.Ribosome; 26.Viral genome; 27.Beta-galactosidase complex; 28.Extracellular region; 29.Extracellular matrix; 30.Intrinsic component of thylakoid membrane; 31.Integral component of membrane; 32.Proteinaceous extracellular matrix; 33.Photosystem Ⅰ; 34.Smc5-Smc6 complex; 35.Intracellular ribonucleoprotein complex; 36.Ribonucleoprotein complex; 37.Structural constituent of ribosome; 38.Xyloglucan:xyloglucosyl transferase activity; 39.Structural molecule activity; 40.Hydrolase activity,hydrolyzing O-glycosyl compounds; 41.Enzyme inhibitor activity; 42.Oxidoreductase activity; 43.Hydrolase activity,acting on glycosyl bonds; 44.Transferase activity,transferring glycosyl groups; 45.Carboxylic ester hydrolase activity; 46.Catalytic activity; 47.Pectinesterase activity; 48.Transferase activity,transferring hexosyl groups; 49.Polygalacturonase activity; 50.Tryptophan synthase activity; 51.Beta-galactosidase activity; 52.DNA-3-methyladenine glycosylase activity; 53.DNA-3-methylbase glycosylase activity; 54.Carbon-oxygen lyase activity,acting on polysaccharides; 55.Galactosidase activity; 56.Lyase activity

图6 单被vs半重被差异基因KEGG富集散点图Fig.6 A vs B DEG enriched KEGG pathway

图7 单被vs重被差异基因KEGG富集散点图Fig.7 A vs C DEG enriched KEGG pathway
2.3 “薇安”不同花被中的差异基因分析
通过对试验材料“薇安”同一时期同一植株上的3个不同花型的转录本两两对比进行差异基因表达分析,共获得3 075条差异表达基因(DEG),其中单被花与半重被样本对比(A vs B)包括649条上调DEG,605条下调DEG;半重被花与重被花对比(B vs C)包括上调DEG 1 046条和下调DEG 721条;单被花与重被花对比(A vs C)有上调DEG 1 129条和下调DEG 859条。将各组合比较得到的差异基因个数进行统计画成维恩图可直观展现出各差异比较组合之间共有与特有的差异基因数目,对3个两两比较的组合筛选的差异基因数目绘制维恩图结果见图2。
2.3.1 差异表达基因的GO富集分析
对“薇安”3种花型两两比较组合的差异基因根据上调或下调分开分别进行富集分析,差异表达基因分属于生物过程(BP)、细胞组分(CC)及分子类别(MF)三大类。如图3,单被“薇安”与半重被“薇安”(A vs B)对比注释到2 220条Unigene,在49个二级节点中,差异基因数目分布最多的是代谢生物过程(614个,64.97%)、细胞外区域细胞成分(68个,7.2%)、催化活性分子功能(580个,61.38%);如图4,单被“薇安”与重被“薇安”(A vs C)对比注释到2 592条Unigene,在45个二级节点中,差异基因数目分布最多的是碳水化合物代谢过程(172个,11.67%)、胞外区(94个,6.38%)、催化活性(839个,56.92%);如图5,半重被“薇安”与重被“薇安”(B vs C)对比注释到2 507条Unigene,在56个二级节点中,差异基因数目分布最多的是单个有机体代谢过程(422个,31.87%)、膜的固有成分(200个,15.11%)、催化活性(753个,56.87 %)。
2.3.2 差异表达基因的KEGG富集分析
差异基因KEGG富集散点图是KEGG富集分析结果的图形化展示方式,KEGG富集程度通过Rich factor、qvalue和富集到此通路上的基因个数来衡量[20]。在3个样本两两对比中挑选出富集最显著的20条pathway条目展示在图中。如图6,单被与半重被“薇安”差异表达基因对比共参与93条代谢通路,其中富集程度较多的是3(淀粉和蔗糖的代谢,55个)、6(苯丙素的生物合成,50个)以及14(氰氨基酸代谢,38个)。单被与重被“薇安”差异对比共参与96条代谢通路,富集程度较多的是3(淀粉和蔗糖的代谢,66个)、4(苯丙素的生物合成,53个)、14(氰氨基酸代谢,35个)(图7)。半重被与重被“薇安”差异对比共参与98条代谢通路,其中富集程度较多的是3(核糖体,54个)、2(淀粉和蔗糖的代谢,36个)、9(戊糖和葡萄糖醛酸结合,28个)(图8)。
2.3.3 铁线莲单重被花性状相关基因的筛选
根据差异筛选的阈值及基因功能注释,在所有的DEG中共挑选出25条可能与铁线莲重瓣化性状相关的基因(表3)。25条差异基因的FPKM值进行表达水平聚类分析用于计算3个样本中相对表达量的高低情况[21](图9)。Log2FC为表达量差异倍数的对数值,值为正数代表该基因上调,值为负数代表基因下调。综合图表可知在单瓣花中表达量较高的基因有MADS域蛋白中的PMADS1、AP3、FRUITFULL基因,促进顶端分生组织蛋白及主要在雌蕊柱中表达的1-氨基环丙烷1-羧酸合成酶;生长素类有吲哚乙酸和脱落酸;在半重瓣中表达量较高的有MADS转录调节蛋白FLC下游蛋白,以及激活甲基化反应的S-腺苷-L-高半胱氨酸水解酶、参与细胞壁构建的果胶甲酯酶及木葡聚糖内转糖苷酶等,生长素类有吲哚乙酸和脱落酸;在重瓣花中表达量较高的基因是参与冷胁迫的几丁质酶、CHY锌指结构及生长素输入载体蛋白。
2.4 10条候选基因的荧光定量PCR验证
在3个样本中共存的134条差异表达基因中根据各基因代谢通路及功能选出10个readcount值较大、序列较长且可能与花发育有关的基因进行荧光定量PCR验证(图10~19)。综合转录组数据及荧光定量PCR验证结果对比可知:10个基因中转录组结果与PCR结果对比在三类花型中差异情况完全一致的有4个,部分差异一致的基因有5个,仅1个ATP酶亚基类基因结果存在差异。其中在单瓣中表达量数值最高的基因类型有cluster-24019.21952硝酸还原酶,最低的有cluster-24019.21011生长素反应蛋白IAA9、cluster-24019.24487ATP酶亚基、 cluster-24019.26193ABC转运体、cluster-24019.26426柚苷配基,2氧化戊二酸3加双氧酶。在重瓣花中差异表达量最高的基因有cluster-24019.29079、cluster-24019.21011生长素反应蛋白IAA9;表达量最低的有cluster-24019.25875木葡聚糖内转糖苷酶、cluster-24019.48125脱落酸 8′羟化酶、cluster-24019.23933MADS转录调节FLC下游蛋白。

图8 半重被vs重被差异基因KEGG富集散点图Fig.8 B vs C DEG enriched KEGG pathway

表3 25个关键基因的名称、功能及表达模式

图10 生长素反应蛋白IAA9表达量差异Fig.10 Expression difference of auxin-responsive protein IAA9

图11 硝酸还原酶表达量差异Fig.11 Expression difference of nitrate reductase[NADH]

图12 MADS转录调节FLC下游蛋白表达量差异Fig.12 Expression difference of protein downstream of FLC
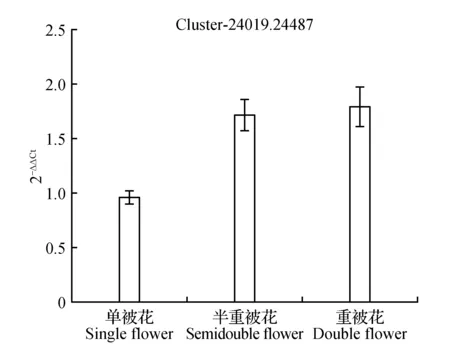
图13 ATP酶亚基表达量差异Fig.13 Expression difference of ATPase subunit

图14 木葡聚糖内转糖苷酶表达量差异Fig.14 Expression difference of xyloglucan endotransglucosylase

图15 ABC转运体表达量差异Fig.15 Expression difference of ABC transporter B family

图16 生长素载体蛋白表达量差异Fig.16 Expression difference of auxin carrier protein

图17 柚苷配基,2氧化戊二酸3加双氧酶表达量差异Fig.17 Expression difference of naringenin,2-oxoglutarate 3-dioxygenase

图18 S-腺苷-L-高半胱氨酸水解酶表达量差异Fig.18 Expression difference of S-adenosyl-L-homocysteine hydrolase

图19 脱落酸8′羟化酶表达量差异Fig.19 Expression difference of Abscisic acid 8′-hydroxylase
图10显示生长素反应蛋白IAA9在重被花中表达量最高且差异显著,在单被中表达量最低,PCR结果与转录组数据结果基本一致;图11中硝酸还原酶在单被花中表达量最高,在半重被及重被中表达量差别不大,与转录组数据基本一致;图12中MADS转录调节FLC下游蛋白在半重被中表达量较高,单重被的表达量差别不大,这与转录组结果完全一致;图13中ATP酶亚基PCR显示在单被中表达量最低,但转录组数据中重被的表达量最低,三者间表达量值差别不大;图14中木葡聚糖内转糖苷酶在半重被中表达量最高,单重被花中的表达量差别不大,这与转录组结果完全吻合;图15中ABC转运体基因在单被中表达量最低,PCR显示在重被中表达量显著较高,结果与转录组数据部分一致;图16中生长素载体蛋白在转录组与PCR结果中均显示表达量在重被中显著较高;图17中柚苷配基,2氧化戊二酸3加双氧酶在转录组与PCR数据中均显示表达量在单被中表达量显著较低,PCR显示在重被中表达量显著较高;图18中S-腺苷-L-高半胱氨酸水解酶在三类花瓣中的表达量数值相近,PCR显示在重被中的差异表达量较高;图19中脱落酸8′羟化酶在转录组与PCR验证中均显示差异表达量在重被中显著下调,二者结果对比差异情况完全一致。
3 讨论
根据植物对环境条件的反应及自身的生物学特性,可以将植物成花类型分成光周期成花、春化作用成花和基因控制的植物成花3个类型[22]。重瓣花形成的分子机理可能是与 MADS-box功能基因突变或互作有关,这其中很可能是C-function基因突变及对下游调控因子的影响造成重瓣花形成,近年来调控重瓣花发育的许多同源异形基因被分离鉴定[23]。在筛取差异基因的过程中发现与MADS-box相关的基因约60个,但在单被和重被样本对比中存在样本对比差异的基因只有5个,说明在铁线莲重瓣化的过程中的行使调控功能作用的不仅仅由开花相关类基因调控。在铁线莲单被向重被转化过程中表达量存在显著差异的基因类型主要与生长素类、ABCDE模型基因、低温、生长发育中与细胞结构及DNA甲基化反应相关。在单被与重被样本对比中筛到的MADS-BOX类基因有PMADS1、AP3、FRUITFULL及参与MADS调控的FLC下游蛋白,且都在单被中表达量较高,重被中表达量较低。由此可推测这几类开花基因在花瓣中的低表达影响了铁线莲由单被向重被的转化。半重被是铁线莲萼片由单被逐渐瓣化为重被的过程形态,它们行使的功能与生长发育、内源物质及与生长素类有关的基因IAA9、生长素载体蛋白在重被中表达量显著最高,而脱落酸 8′羟化酶在单被中表达量较高。综合转录组数据及荧光定量PCR验证结果对比:在三类花型中共存的10个差异基因中转录组结果与PCR结果对比差异情况完全或基本一致的有9个,说明本次试验数据可靠且具有一定的说服性。
4 结论
将铁线莲“薇安”同一时期同一株上的3种花型的转录本两两比较,在GO富集分析中,3个对比数据中差异基因数目分布最多的共同二级类别是催化活性,KEGG富集分析中差异基因数目分布较多的共同通路是淀粉和蔗糖的代谢。在几类内源激素中主要参与了重瓣化的调控激素是吲哚乙酸和脱落酸,且相同条件下IAA在重被中表达量较高,ABA在单被中表达量较高。在铁线莲单被向重被转化的过程中,特定开花基因的调控、低温、内源激素含量变化均起到了不可忽略的主导作用。综合数据结果初步筛选出可能调控铁线莲重被化的部基因主要有MADS-BOX类基因PMADS1、AP3、FRUITFULL、FLC;生长素反应蛋白IAA9、生长素输入载体、吲哚乙酸诱导蛋白、ARG7脱落酸 8′羟化酶。这些基因表达量显著上调或下调都有可能使铁线莲重瓣性状产生。本次试验步筛选出部分可能参与铁线莲重瓣性状调控的关键基因,为探究铁线莲重瓣化形成分子机制提供了基础数据和理论依据,后续可对这些候选基因进一步功能验证及深入研究。
