模拟氮沉降对夏蜡梅幼苗生长及非结构性碳水化合物的影响
2020-03-13金则新
赵 喆 金则新
(1.三峡库区生态环境教育部重点实验室,重庆 400715; 2.重庆市三峡库区植物生态与资源重点实验室,重庆 400715; 3.西南大学生命科学学院,重庆 400715; 4.台州学院生态研究所,台州 318000; 5.浙江省植物进化生态学与保护重点实验室,台州 318000)
20世纪中叶以来,随着化肥的过量生产、化石燃料燃烧、大力发展工业和畜牧业等人类活动的干扰导致活性氮产量显著增加,氮沉降增加导致土壤氮素含量增加而带来了一系列的生态环境问题,目前越来越多的学者广泛关注氮沉降对陆地植物的影响[1~3]。氮是植物生长的必需元素,为植物生长最主要的限制因子之一。随着氮沉降的增加,土壤中可利用的氮以及植物体内氮的积累增加,进而影响到植物生长发育及各项生命活动[4]。不仅如此,氮沉降还对森林生态系统的物种组成、种间竞争、凋落物分解和生态系统功能等有重要影响[5]。模拟氮沉降对植物的影响已有较多研究,但多数集中在氮沉降严重的欧州和北美温带森林以及亚热带常绿阔叶林的优势种或建群种,对濒危植物的研究较为少见。
夏蜡梅(Sinocalycanthuschinensis)属蜡梅科(Calycanthaceae)夏蜡梅属(Sinocalycanthus)的落叶灌木。是我国特有的第三纪孑遗物种,目前,主要分布于浙江省临安市西部、天台县大雷山和安徽省绩溪县龙须山[6],现存资源极少,已列为2级重点保护植物[7]。目前已对夏蜡梅进行了较多的研究,内容涉及群落生态学、开花物候、光合生理和遗传多样性等多个领域[8],对其濒危机制有了一定的认识。为了解夏蜡梅对未来大气氮沉降的适应能力以及生长动态,本实验室已初步报道了夏蜡梅光合生理以及抗氧化系统对模拟氮沉降的响应[9],发现不同氮处理提高了夏蜡梅的光合作用能力,其中以中氮处理最为明显,高氮处理的夏蜡梅叶片光合速率增幅下降。碳水化合物是植物光合作用的主要产物,分为结构性碳水化合物(SC)和非结构性碳水化合物(NSC)。NSC主要包括淀粉、可溶性糖等,是植物生长、代谢等一系列生理活动的能源物质,它在植物体内的储存对于植物的代谢、生长、防御、抗寒性的形成以及推迟或防止植物死亡有很重要的作用[10]。然而,对于不同物种氮添加引起NSC含量变化的效应不同。氮添加可增加水曲柳(Fraxinusmandshurica)叶片可溶性糖和淀粉含量[11],而降低大针茅(Stipagrandis)和羊草(Leymuschinensis)叶片可溶性糖和NSC含量[12]。随着施氮量的增加,杨树(Populusspp.)幼苗、云杉(Piceaasperata)叶片淀粉含量下降,而可溶性糖含量无显著差异[13~14]。这可能与物种的敏感性以及具体的施氮水平有关。有关氮沉降对夏蜡梅NSC影响的研究未见报道。
目前,我国许多森林生态系统有很高的氮沉降水平[15]。而夏蜡梅作为濒危物种势必会受到影响。为了更好地认识夏蜡梅对氮沉降的响应,本文以夏蜡梅幼苗为研究对象,通过模拟氮沉降实验,从生长、生物量和非结构性碳水化合物的变化来探讨夏蜡梅对氮沉降增加的适应性,阐明夏蜡梅在全球变化尤其在氮沉降增加的背景下夏蜡梅的生存和发展趋势,为夏蜡梅在全球气候变化中的繁衍和保护提供理论依据。
1 材料与方法
1.1 实验材料
2015年10月上旬,采集浙江省天台县大雷山自然生长的夏蜡梅当年所产的种子,风干后备用。2016年3月上旬挑选形态饱满、无虫蛀的种子播于土壤中进行育苗生长,用遮阳网遮阴。8月下旬将植株大小基本一致的夏蜡梅幼苗移栽到上口径23.60 cm,下口径13.80 cm,高16.20 cm的花盆中,每盆放干土3.00 kg,花盆底部置托盘,每盆栽植1株,浇足水分,放在透光率为37%的玻璃温室内培养。栽培土壤由泥炭土∶水稻土∶河沙=6∶6∶1(体积比)混合而成,其基本理化性质为pH5.87,有机质含量46.33 mg·g-1,全氮含量5.02 mg·g-1,全磷0.81 mg·g-1,全钾含量11.93 mg·g-1。9月15日将株高15 cm、基径0.40 cm左右,生长状况基本一致的夏蜡梅幼苗分成4组,每组10个重复,喷淋NH4NO3溶液。参考国内外同类研究的设计方案[16],确定本研究的施氮量,折成氮沉降量分别为0、2、8、32 g N·m-2·a-1(不包括大气氮沉降量)[9,17],分别用对照(CK)、低氮(N1)、中氮(N2)和高氮(N3)表示,每月喷施2次(月中和月底各一次),经过12个月的施氮处理,期间适当补水,至2017年9月中旬结束。由于夏蜡梅是阴生植物,野外多分布在常绿阔叶林的灌木层,群落郁闭度在60%~70%。因此,本实验在透光率为37%左右的玻璃温室内完成,环境年平均温度17.1℃,最高温度37℃,最低温度0℃,年平均相对湿度为80%左右。于2017年9月15日开始进行材料的处理和各项指标的测定。
1.2 测定方法
1.2.1 形态参数测定
用直尺和游标卡尺测量株高、基径,每株取生长部位基本相同的功能叶3片,每个处理10个重复,参照Green[18]等方法,用蒸馏水洗净后,用扫描仪(Epson 1680)与WinFolia叶片分析系统分析叶片图像,获得叶周长、叶面积、叶长、叶宽并计算得到叶平均周长、叶平均面积、叶平均长度、叶平均宽度、叶宽长比=叶平均宽/叶平均长,比叶面积=叶平均面积/叶片平均生物量[19]。
1.2.2 生物量测定
将植株的根、茎、叶分开,于105℃杀青30 min,之后在75℃下烘至恒重,称取各器官生物量,即叶生物量、茎生物量、根生物量,并计算得到:冠层生物量=叶生物量+茎生物量、总生物量=冠层生物量+根生物量以及叶生物量比(叶生物量/总生物量)、茎生物量比(茎生物量/总生物量)、根生物量比(根生物量/总生物量)、根冠比(根生物量/冠层生物量[20]。
1.2.3 非结构性碳水化合物的测定
将同一株植物的叶、茎、根样品分别混合后带回实验室杀青烘干后,进行研磨、过筛,用于化学分析。本研究将NSC定义为可溶性糖(葡萄糖、蔗糖、果糖等)和淀粉的总和[21]。将植株分为根、茎、叶三部分,采用蒽酮法测定可溶性糖和淀粉含量[22],每个氮浓度取10株植物进行测定,即10个重复。
2 结果与分析
2.1 氮沉降对夏蜡梅幼苗生长和叶片形态的影响
2.1.1 氮沉降对夏蜡梅幼苗生长的影响
随着氮浓度的升高,株高、基径呈现先升高后降低的趋势(图1)。虽然低氮(N1)处理的株高、基径比对照(CK)有所增加,但它们均差异不显著。中氮(N2)处理对夏蜡梅幼苗株高、基径的影响最大,分别比CK显著增加了32.40%、11.35%。高氮(N3)处理的株高、基径均大于CK,但增幅有所下降,株高与CK无显著性差异,基径比CK显著增加了9.01%。
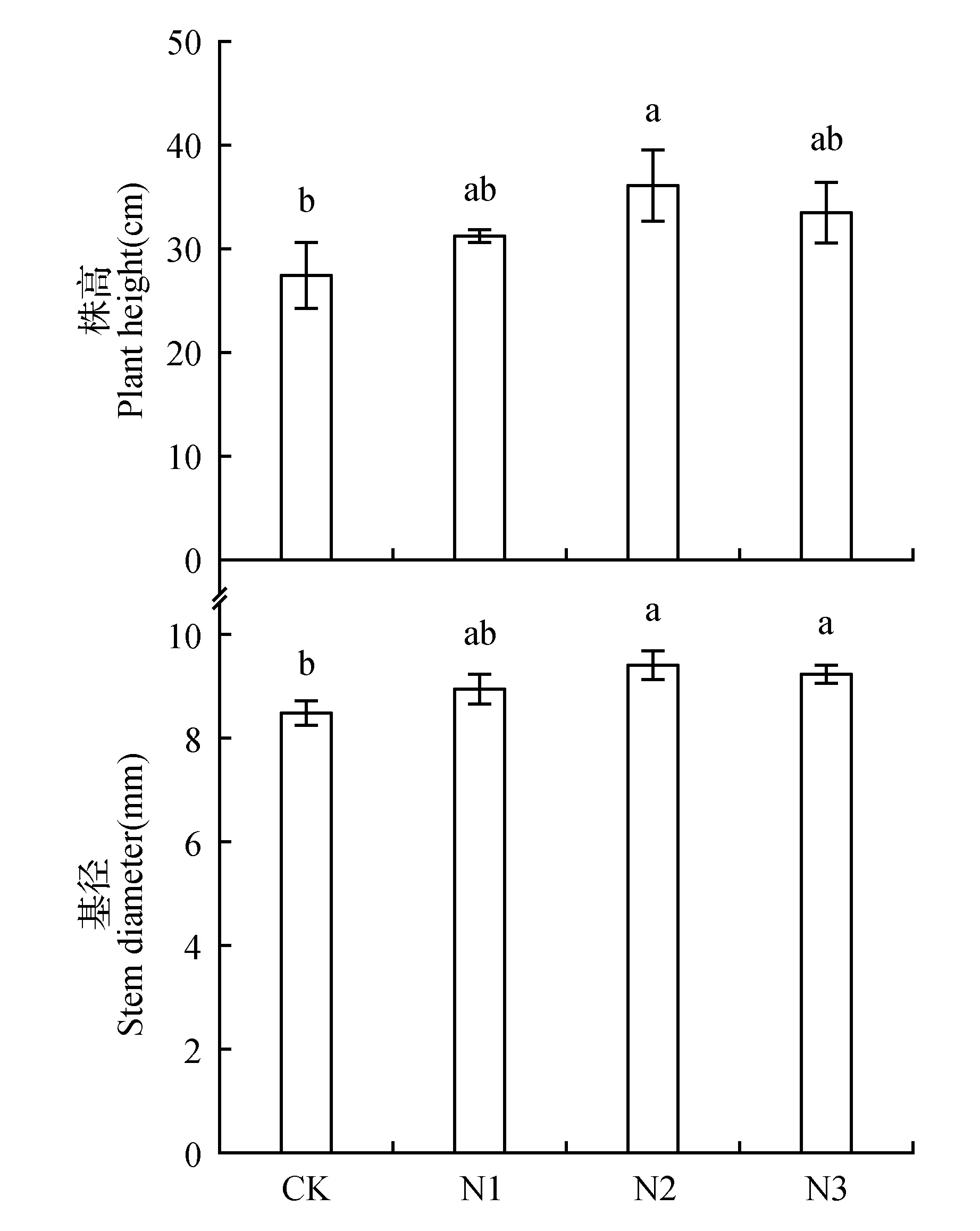
图1 不同氮浓度处理下对夏蜡梅幼苗株高、基径的影响 不同小写字母表示不同处理间差异显著(P<0.05),下同。Fig.1 Effects of nitrogen deposition on S.chinensis seedling height and base diameter Different lowercase letters mean significant difference among treatments at 0.05 level.The same as below.
2.1.2 氮沉降对夏蜡梅幼苗生物量及分配的影响
不同浓度的氮沉降均能促进夏蜡梅幼苗各器官及总生物量的增加,但N1处理下的茎、根、叶、冠层生物量以及总生物量与对照均无显著性差异(表1)。叶、冠层生物量随着氮浓度的升高而呈现出逐渐升高的趋势,它们均以N3处理最高,分别比CK显著增加了28.57%、33.60%,也显著高于N1;N2处理次之,分别比CK显著增加了18.83%、30.30%,冠层生物量也显著高于N1。茎、根以及总生物量则表现出先升高后降低的趋势,它们均以N2处理最高,分别比CK显著增加了43.27%、66.40%、41.16%,也均显著高于N1;N2处理的根生物量显著高于N3。N3处理的茎、总生物量次之,分别比CK显著增加了39.42%、29.62%;N3处理下的茎生物量显著高于N1。
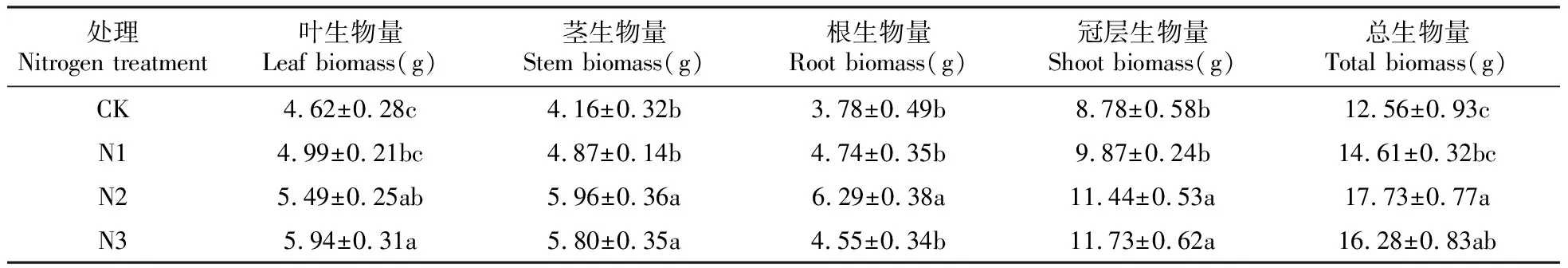
表1 不同氮浓度处理对夏蜡梅幼苗生物量的影响

图2 不同氮浓度处理下夏蜡梅幼苗生物量的分配Fig.2 Effects of nitrogen deposition on S.chinensis seedling biomass allocation
叶生物量比随着氮浓度的升高呈现先降低后升高的趋势,根生物量比和根冠比则呈现先升高后降低的趋势,与叶生物量比的变化趋势相反(图2)。在叶生物量比中,N2处理分别比CK、N3显著降低了16.41%、14.83%。N2处理的根生物量比分别比CK、N3显著增加了19.71%、26.91%。夏蜡梅幼苗的根冠比最大的是N2处理,最小的是N3处理,N2处理分别比CK、N3显著增加27.67%、41.66%。不同氮浓度处理之间的茎生物量比差异不显著。
2.1.3 氮沉降处理对夏蜡梅幼苗叶片形态的影响
叶平均周长、叶平均面积和叶平均长度随着氮浓度的增加呈现先升高后降低的趋势,它们均以N2处理最大(图3)。在N2处理下,叶平均周长、叶平均长度显著高于其他处理,叶平均周长分别比CK、N1、N3增加了9.41%、10.33%、6.96%;叶平均长度分别比CK、N1、N3增加了17.55%、14.78%、21.19%。N2处理下的叶平均面积分别比CK、N1显著增加了18.58%、21.44%。各种氮浓度处理之间叶平均宽度无显著差异。宽长比以N3处理最大,分别比CK、N1、N2显著增加了15.87%、21.65%、33.16%。比叶面积随着氮浓度的增加呈现逐渐降低的趋势,CK分别比N2、N3高6.27%、9.63%,均差异显著。
2.2 氮沉降对夏蜡梅幼苗非结构性碳水化合物的影响
不同氮浓度处理下,叶、茎、根等3个器官中的可溶性糖含量无明显变化(图4)。3个器官中可溶性糖含量均以叶最高,为茎、根中的3~4倍。叶中的淀粉含量在N1处理时最低,分别比CK、N2、N3降低了45.29%、52.96%、32.44%,均差异显著;N2处理显著高于N3。茎中的淀粉含量在N3浓度下显著低于CK、N1、N2,分别降低了80.68%、80.55%、80.61%。根中的淀粉含量以N3最低,比N2显著降低了19.70%。叶的中NSC含量以N2处理最高,分别比N1、N3显著增加了18.45%、13.99%。茎中的NSC含量以N3处理最低,分别比CK、N1、N2显著降低了58.19%、56.96%、58.11%。根中的NSC含量以N2处理最高,比N3显著增加了13.35%。叶中的NSC含量要明显高于茎和根中的含量。夏蜡梅叶片的可溶性糖含量占NSC的65.63%~78.76%,淀粉含量为21.21%~34.37%,而茎和根表现出相反的趋势,这表明夏蜡梅幼苗叶中可溶性糖是NSC的主要组分,在茎和根中淀粉是NSC的主要组分。

图4 氮沉降对夏蜡梅幼苗叶、茎、根的可溶性糖含量、淀粉含量和NSC含量的影响Fig.4 Effects of nitrogen deposition on S.chinensis soluble sugar content, starch content and NSC content of seedling leaves, stems and roots
3 讨论
3.1 氮沉降对夏蜡梅幼苗生长和叶片形态的影响
生物量、基径和株高等形态指标与植物的生长发育有紧密联系,对环境的变化敏感且可塑性强是评价植物对环境改变响应的重要指标[23]。本研究可看出,无论基径、株高还是总生物量,不同浓度氮处理均有所增加,但是低氮处理由于氮含量低而增加不明显。中氮处理的株高、基径和总生物量均显著高于对照,对夏蜡梅生长促进作用最明显。与中氮处理相比,高氮处理对夏蜡梅的生长促进作用有所下降,表明中氮比高氮对植物生长有利,这与刘双娥等[24]、李德军等[25]的相关研究结果类似。虽然栽培土壤中氮含量较高,但还未达到饱和状态,氮沉降的增加会促进植物的生长。因为氮沉降使土壤可利用氮增加,施入的氮被植物吸收利用后,提高了夏蜡梅的日均净光合速率、最大净光合速率和相对叶绿素含量[9],提高植物的生产力,促进植物的生长。氮的输入对于植物的生长促进作用是有一定的范围的,而超过这个范围,植物的生长就不再受到氮输入的正面影响,甚至出现抑制生长的现象。这是由于高氮量会导致土壤酸化、营养元素不平衡,幼苗的生长速率下降甚至抑制幼苗的生长[26~27]。
氮沉降明显影响植物生物量的积累。随着氮浓度的增大,夏蜡梅幼苗的叶生物量呈现逐渐升高的趋势。叶片作为植物的光合作用器官,是植物获取地上资源的主要构件,氮沉降处理水平的增加,有利于促进植株个体光合产物的转化,随之也增加生物量在叶片中的积累。说明在植物所需营养过量的情况下,植物将更多的生物量分配到获得外部资源的构件中,这样有利于植物的繁衍和扩张[26]。中氮、高氮处理的茎生物量明显高于对照,可能原因是氮沉降使植物养分运输能力加强,进而表现为茎部的显著增加。根生物量在中氮处理时显著增加,而在高氮处理时与对照差异不明显。这说明适量的氮浓度下,不会限制根的生长;只有当浓度过高时,植物向根系分配的碳量减少,根的生长受到了抑制。
氮素营养的改变还影响植物体内的碳分配格局[28]。根生物量比、茎生物量比、叶生物量比和根冠比等反映了生物量在植株各部分的分配比例,是衡量植物生长状况的重要指标。夏蜡梅的叶生物量比随着氮浓度的升高呈现先降低后升高的趋势,表明随着施氮水平的提高,对地上部分的生长有促进作用,但对分配给根系的光合产物是否增加一直存在争议。根冠比反映了生物量在地上和地下部分之间分配的情况。李德军等[29]发现,木荷(Schimasuperba)、黄果厚壳桂(Cryptocaryaconcinna)的根生物量比、根冠比均以对照样方最高,说明氮处理抑制了根的生长,分配到根部分的生物量下降。同样,施氮使枫香(Liquidambarformosana)、秃瓣杜英(Elaeocapusglabripetalus)、木荷和青冈(Cyclobalanopsisglauca)根生物量比和根冠比均显著下降[26]。而王小荣等[30]发现氮沉降使得短柄枹栎的根冠比显著增加,反映了植物应对氮沉降响应存在一定的差异。夏蜡梅幼苗的根生物量比、根冠比在中氮水平显著升高,而在高氮水平则下降至对照水平。通常认为,氮素缺乏时,植物将大量的碳优先分配于根系生长,以加强对限制性养分的吸收,当氮素较充足时,植物向根系分配的碳量减少,从而改变地上/地下碳分配格局[31]。
叶片是植物获取能量的主要物质,其功能性状能反映出植物对环境的响应与适应策略。叶面积的大小影响植物捕获光资源和碳获取的能力[32]。不同浓度氮处理,对夏蜡梅叶片形状产生一定的影响,但以中氮处理最明显。与对照相比,中氮处理的叶片长度显著增加,从而导致叶周长和叶面积的增加。叶面积的增大在一定程度上反映出捕获光资源和碳获取的能力增强。通常比叶面积随叶干物质含量的增大而减少[33],叶干物质含量是反映植物获取和利用资源有效性的稳定指标[34],叶干物质含量高的植物,代表其叶片含水量低,适应干旱环境的能力强。较低比叶面积的植物物种趋向于较为保守的资源利用策略[35]。夏蜡梅幼苗随着氮浓度的增加,叶面积增大的同时叶干物质含量也逐渐增加,表现在比叶面积比对照明显降低,说明抵御不良环境能力不断增大,在未来氮沉降的情景下,夏蜡梅倾向于采取资源保守型策略。
3.2 氮沉降对夏蜡梅幼苗NSC的影响
非结构性碳水化合物(NSC)能够为植物的生长提供能量[36],它在植物库器官之间的流动反映了碳吸收(源)和碳消耗(汇)的平衡关系[37]。可溶性糖是植物体内碳水化合物运输的主要形式,淀粉是植物碳的主要储存物质,两者在一定条件下可以相互转换以维持正常的生理活动[38]。夏蜡梅幼苗各器官非结构性碳水化合物(NSC)含量高低表现为:叶>根>茎。因为叶是NSC的合成器官,根是NSC的主要贮存器官,NSC合成后首先满足叶的需要,然后多余的NSC通过茎运输至根贮存,同时一部分NSC也会贮存在茎中。不同浓度氮处理对夏蜡梅幼苗叶、茎、根等三个器官的可溶性糖含量的影响不明显,而对淀粉、NSC的影响较大,叶中的淀粉、NSC含量均以中氮处理最高,因为NSC主要由叶来合成,适量的氮沉降,会提高光合作用能力,合成和积累的有机物增加。而茎、根中淀粉、NSC含量均以高氮处理最低,由于夏蜡梅淀粉、NSC的积累主要取决于茎、根,表明高氮水平下不利于淀粉、NSC的积累,进而影响其生长和固碳能力。在不同氮浓度中的NSC及其组分在植物器官中的分配格局体现了植物对其生活环境条件的适应[39]。
4 结论
不同浓度氮处理均能增加夏蜡梅幼苗的基径、株高以及总生物量,但中氮处理的增加最明显,与中氮处理相比高氮处理的增幅有所下降。随着氮浓度的升高,夏蜡梅幼苗的叶、冠层生物量呈现出逐渐升高的趋势,而茎、根生物量则表现出先升高后降低的趋势。夏蜡梅幼苗的叶生物量比随着氮浓度的升高呈现先降低后升高的趋势,而根生物量比、根冠比在中氮处理下最高,而在高氮处理下降低至对照水平。叶平均周长、叶平均长度、叶平均面积均以中氮处理最大,中氮、高氮处理的比叶面积明显低于对照。叶中的淀粉、非结构性碳水化合物(NSC)含量均以中氮处理最高,茎、根中的淀粉、NSC含量以高氮处理最低。总之,不同浓度氮沉降均促进了夏蜡梅的生长,中氮处理促进作用最明显,表明适量的氮添加会增加土壤有效氮,对植物生长有促进作用,但过量的氮输入反而会降低植物的初级生产力。
