转基因玉米T25数字PCR方法的建立与验证
2020-03-13李夏莹武玉花李俊肖晓琳张飞燕梁晋刚王顥潜张旭冬张秀杰
李夏莹, 武玉花, 李俊, 肖晓琳, 张飞燕,梁晋刚, 王顥潜, 张旭冬, 张秀杰*
(1.农业农村部科技发展中心, 北京 100176; 2.中国农业科学院油料作物研究所, 武汉 430062)
随着生物技术产业的迅速发展,转基因产品已进入食物链,并摆上了餐桌,但其安全问题一直受到各国政府和广大消费者的关注,并引发了一系列的争议[1]。为了保障生物技术产业的健康发展,保护消费者的知情权,各国政府均对转基因产品实施标识管理[2-3]。实施转基因生物安全管理和标识,一方面要建立转基因检测方法,另一方面要研制转基因检测标准物质。基体标准物质是指与被测样品具有相同或相近基体的实物标准,是给被测物质赋值的最有效的一类标准物质。应用可靠的标准物质可有效提高转基因检测结果的可比性、有效性和溯源性,是得到高质量分析测定数据的保证[4-5]。但现阶段,我国转基因检测标准物质研制已经严重滞后于转基因生物安全监管工作的实际需求。为了对转基因产品进行有效的安全监管,原则上,每种批准商业化的转化体都必须研制对应的标准物质,保障转基因产品的检测、监测和溯源。
转基因玉米T25为拜耳作物科学公司研发,通过聚乙二醇(PEG)介导法将PAT基因表达盒P35S-PAT-T-35S导入非转基因玉米中培育而成,是一种耐除草剂的转基因玉米品种。PAT基因来源于杆菌Bacillusamyloliquefaciens草丁膦乙酰转移酶基因,它能使草丁膦中游离氨基乙酰化而失活[6]。PAT与已知的120多种人体蛋白无同源性[7]。目前,T25已经在中国、美国、澳大利亚、加拿大、阿根廷、日本等国家被批准进口用作加工原料。目前,我国没有转基因玉米T25的标准物质,也没有建立T25精确定量的检测方法,故本研究研制的转基因玉米T25标准物质,可用于对转基因玉米T25及其加工产品的定性和定量检测,有效加强我国转基因生物安全管理和标识制度。
本研究参照农业部(现为农业农村部)1782号公告-8-2012《转基因植物及其产品成分检测基体标准物质制备技术规范》的要求,研制了T25纯品基体标准物质,参考欧盟网络实验室2013年发布方法[8],自主建立了数字PCR方法(转基因玉米T25转化体特异性和玉米内标准基因特异性定量PCR),采用多家单位协同定值方式对研制的T25基体标准物质进行定值,为转基因成分定量检测提供物质基础和技术保证。
1 材料与方法
1.1 试验材料
1.1.1转基因玉米T25及其受体材料 转基因玉米T25及其受体材料由农业农村部科技发展中心提供;转基因玉米T25基体标准物质由中国农业科学院油料作物研究所研制。
1.1.2特异性引物和探针 序列参考欧盟联合实验室公开发布的转基因玉米T25转化体特异性方法验证报告[8-10]进行设计,引物探针均由上海生工生物工程有限公司合成,其中探针5′端采用荧光标记基团FAM进行标记,3′端采用荧光淬灭基团TAMRA进行标记。序列信息见表1。

表1 数字PCR引物和探针序列信息
1.2 试验方法
1.2.1样品DNA的提取 采用植物基因组提取试剂盒(德国Qiagen公司)对样品的基因组DNA进行提取,操作过程见试剂盒说明书。
1.2.2紫外分光光度计检测DNA浓度 采用Q5000紫外分光光度计(美国Quawell)用超纯水做空白,测定提取DNA溶液的A260、A280和A320紫外吸收值,计算DNA浓度。
1.2.3数字PCR扩增 以提取的植物基因组DNA为模板,用微滴数字PCR试剂盒(美国伯乐公司)进行数字PCR扩增,每个反应重复4次。反应体系为20 μL,包含10 μL 2×ddPCR Master Mix、10 μmol·L-1正向引物和反向引物各0.8 μL、探针0.4 μL、DNA模板2 μL。反应程序为:94 ℃变性10 min;95 ℃变性15 s,57.7 ℃退火延伸1 min,40个循环;98 ℃变性10 min;4 ℃保存。扩增结束后,将96 孔板置入Bio-Rad QX200微滴读取仪中读取信号,并使用软件QuantaSoft V1.3.2.0 分析试验数据,获得绝对定量结果。
1.2.4数字PCR的特异性测试 为了考察T25/Adh1二重数字PCR的扩增特异性,分别以转基因玉米T25、MON863、MON810、NK603、MIR604、TC1507、非转基因玉米NTC(阴性对照)的基因组DNA和ddH2O(空白对照)为模板,参照1.2.3进行二重数字PCR扩增。
1.2.5数字PCR方法动力学范围的确定 为了测试二重数字PCR系统的动力学范围,使用去离子水将T25基因组DNA进行梯度稀释,将DNA浓度分别稀释至1.8×105、3.6×104、7.2×103、1.44×103、2.8×102、5.7×101和11.52 拷贝数·μL-1,之后参照1.2.3方法进行数字PCR扩增。
1.2.6多家实验室协同定值 采用微滴数字PCR系统(Bio-rad和QuantStudio 3D Digital PCR System)进行标准物质的定值。选择1号:农业部转基因植物用微生物环境安全监督检验测试中心(北京)(中国农业科学院生物技术研究所)、2号:农业部转基因植物环境安全监督检验测试中心(武汉)(中国农业科学院油料作物研究所)、3号:上海市计量测试技术研究院、4号:上海市农业科学院生物技术研究所、5号:农业部转基因生物产品成分监督检验测试中心(上海交通大学)、6号:中国检验检疫科学研究院、7号:上海出入境检验检疫局、8号:中国动物疾病预防控制中心(北京)共8家有资质单位进行联合定值,每个单位重复8次。
为了保证数字PCR定值结果的准确,在进行正式定值之前,定值组织单位进行了如下工作:①参加定值实验室均配备数字PCR设备,有熟练操作数字PCR设备的技术人员,能够对数字PCR的检测过程进行有效地质量控制。②对参加定值实验室组织数字PCR定值能力评估,证明定值实验室具备利用数字PCR进行测量的能力。③对定值方法进行了确认,采用荧光定量PCR方法,考察了T25转化体特异性方法和Adh1内标基因检测方法的扩增效率,保证二者的扩增效率相近。④考察数字PCR系统的适用性,在数字PCR平台上用确认的定量方法检测纯品DNA 样品的拷贝数比值,测量结果均接近理论值。⑤充分测定了数字PCR的有效动力学范围[11-12]。
2 结果与分析
2.1 原有标准验证
参照农业部869号公告-14-2007《转基因植物及其产品成分检测 耐除草剂玉米T25及其衍生品种定性PCR方法》[13]进行PCR检测。PCR结果(图1)显示,阴性对照和空白对照的T25基因检测结果均为阴性;5~10号样品的T25基因检测结果为阳性,含有T25转化体,但是无法满足定量检测的需求,故本研究拟建立数字PCR方法,以期解决转基因含量绝对定量的问题。

注:M—分子标记;1、2—空白对照;3、4—阴性对照;5~10—T25。
2.2 方法确认
2.2.1数字PCR的特异性测试 不同玉米品种的T25/Adh1二重数字PCR检测结果(图2)显示,Adh1基因在空白对照中无阳性微滴,但在转基因玉米MON863、MON810、NK603、MIR604、TC1507和非转基因玉米NTC中均扩增正常。在Adh1基因扩增正常的情况下,T25基因只有在转基因玉米T25中才有阳性微滴,而其他转基因玉米品种(MON863、MON810、NK603、MIR604、TC1507)和非转基因玉米(NTC)中,均无阳性微滴或阳性微滴数小于3,扩增结果为阴性。结果表明,T25/Adh1二重数字PCR系统具有良好的扩增特异性。
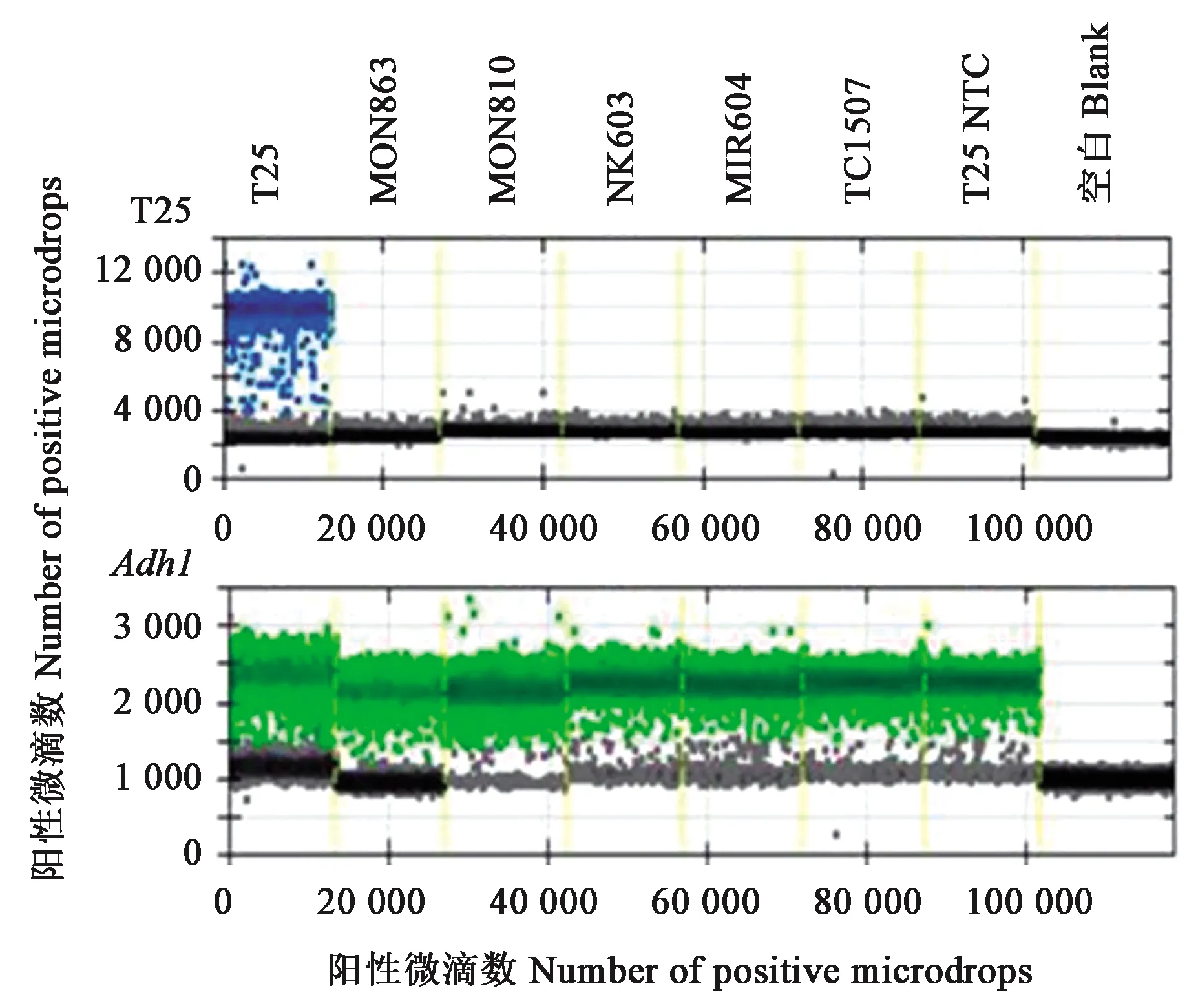
图2 T25和Adh1二重数字PCR特异性扩增热图
2.2.2数字PCR的动力学范围 微滴式数字PCR的理论有效线性范围是1~120 000个拷贝,但20 μL反应液在微滴生成器中只能产生12 000~16 000个有效微滴,微滴数大于10 000为有效反应。结果发现,当DNA模板量为1.8×105拷贝时,所有微滴均呈阳性,超出数字PCR的动力学范围。其他浓度微滴数字PCR的测量值分别为34 400、6 852、1 396、264、50和18拷贝。分析预期值和测量值的相关性结果(图3)发现,当模板量在50~36 000拷贝之间时,通过微滴数字PCR获得的测量值与预期拷贝数间具有良好的相关性,决定系数R2值等于1.0;而模板拷贝数低至11个拷贝时,测量值偏离预期值。当测试样品的浓度处于动力学范围的中间位置时,定量结果最准确。因此,推荐在配置数字PCR反应体系前,将基因组DNA稀释到100~10 000拷贝·μL-1之间,加2 μL DNA溶液到数字 PCR反应体系中,使初始模板量在200~20 000拷贝,可获得稳定、可靠的检测结果。

图3 数字PCR的动力学范围测试
2.2.3数字PCR的稳定性检测结果 以梯度稀释的T25基因组DNA为模板进行二重数字PCR扩增,统计4个重复间测量值的相对标准偏差,结果(表2)表明,在数字PCR的动力学范围内,随着拷贝数的降低,相对标准偏差升高,但低于25%。说明测试样品的稳定性良好。

表2 T25/Adh1二重数字PCR测量结果稳定性分析
2.3 多家实验室协同定值结果
8家单位协同定值结果显示,测定数据服从正态分布,对数据进一步分析(表3)表明,T25转基因和内标基因比值为1.001 2, 数据的相对标准偏差值较小为0.16%。对所有数据计算总平均值和总标准差,将总平均值作为转基因和内标基因比值的标准值,将总标准差作为联合定值的不确定度。总平均值为1.001 2,定值过程引入的不确定度(s)为0.001 6,即相对不确定度[14-17]为0.001 6,最终确定本研究的转基因玉米T25标准物质的标准值为1.001 2±0.0016。通过多试验室协同定值说明T25/Adh1二重数字PCR方法准确、可靠。

表3 T25/Adh1联合定值数据
3 讨论
为保证转基因生物安全管理和标识制度的顺利实施,各国政府十分重视转基因产品检测技术体系的研究和标准化。欧盟、美国、日本、中国均展开了标准物质的研制工作。根据转基因产品检测标准物质的形态特征,将其分为基体(含种子颗粒和种子粉末标准物质)、基因组DNA和质粒DNA标准物质3种类型。研发机构主要有欧盟联合研究中心下属的标准物质与测量研究所(Institute for Reference Materials and Measurements,IRMM)和美国石油化学家学会(American Oil Chemists’ Society, AOCS)。
欧盟为了实施转基因产品标识法规,位于比利时的IRMM专门成立了工作小组,建立转基因产品标准物质的研制方法和工艺流程。到2017年,欧盟IRMM针对在欧盟商业化生产的转基因作物已经研发了127种转基因检测基体标准物质,如转基因大豆GTS40-3-2、356043、305423,转基因玉米 MON863、MON810、TC1507、Bt11和Bt176等品系,涵盖6大作物的30个转基因品种,每个品种有2~6个浓度梯度;IRMM还研发了4种质粒标准物质,包括转基因玉米MON810、98140、NK603,和转基因大豆356043。美国的转基因生物标准物质由AOCS负责研制,主要生产植物基因组DNA和种子粉末这两种形态的纯品标准物质,其生产的基体粉末标准物质有35种、纯品基因组DNA有19种,涉及的转化体也几乎覆盖目前已在国际市场上商业化种植的转基因作物。日本以及一些生物公司如SIGMA公司也制备了质粒形态的标准物质,但研制的数量比较有限。另外,国外研制的标准物质目前都是使用实时荧光定量PCR方法进行定值,没有实现绝对定量。本研究根据欧盟联合实验室发布的T25实时荧光定量PCR方法提供的相关信息,建立并优化了T25的微滴数字PCR方法。推荐微滴数字PCR 体系为20 μL,包含10 μL 2×ddPCR Master Mix、10 μmol·L-1正向引物和反向引物各0.8 μL、探针0.4 μL、DNA模板2 μL。微滴式数字PCR反应程序为:95 ℃ 变性10 min; 95 ℃变性15 s,57.7 ℃退火延伸1 min(40 个循环);98 ℃变性10 min;4 ℃保存。每20 μL反应体系的起始模板数在200~20 000拷贝。经验证发现,该数字PCR方法具有良好的重复性,重复间测量结果稳定、可靠,可以满足标准物质定值要求。通过8家有资质实验室对转基因玉米T25的基体标准物质进行联合定值得出,转基因玉米T25粉末标准物质的转基因DNA与总DNA拷贝数比值为1.001 2,相对不确定度为0.001 6。
