含二苯醚结构单元的新型烟酰胺类衍生物的合成及杀菌活性研究
2020-03-13高梦琪朱晓磊杨光富
李 华,武 园,高梦琪,朱晓磊,杨光富
(华中师范大学农药与化学生物学教育部重点实验室,武汉 430079)
琥珀酸脱氢酶(SDH)作为一类重要的杀菌剂靶标,在农药学研究领域扮演着十分重要的角色。琥珀酸脱氢酶抑制剂(SDHI)类杀菌剂因其具有高效、广谱的杀菌活性和环境友好的特点,成为杀菌剂市场的“黑马”,受到世界各大农药公司的关注[1]。啶酰菌胺(boscalid)为巴斯夫公司开发的烟酰胺类杀菌剂,是第一个广谱性的SDHI类杀菌剂,几乎对所有的真菌病害都有效果,主要用于防治白粉病、灰霉病、菌核病、各类腐烂病、褐腐病和根腐病等[2]。啶酰菌胺是在灭锈胺和氟酰胺的基础上,利用生物电子等排原理,将酸部分的苯环替换为吡啶环,同时将胺部分的苯环替换为空间位阻更大的联苯结构而得到高活性、低毒性、高内吸性和高选择性的化合物。啶酰菌胺与多菌灵、腐霉利等无交互抗性,对作物安全,加上有利的生态效果和毒理学数据,使之迅速成为上亿美元的产品[3]。其结构式见图1。
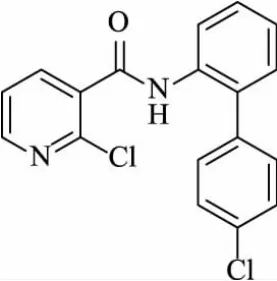
图1 啶酰菌胺的结构式
近年来,一些结构类似的品种不断涌现,如氟唑菌酰胺(fluxapyroxad)、联苯吡菌胺(bixafen)和pyraziflumid等(图2)。这些化合物的显著特点为:酸部分不再局限于吡啶环,出现了吡唑环和吡嗪环;酰胺键旁边碳上的取代基由氯原子变成了二氟甲基或三氟甲基,活性有了进一步提高[4-6]。但这些化合物的胺部分仍为联苯结构,需要昂贵的钯催化剂和苯硼酸作为原料,成本较高[7]。

图2 近年来上市的联苯类SDHIs的结构式
在课题组前期的工作中,笔者发现柔性的二苯醚片段替换刚性的联苯片段,可以有效地降低合成成本,提高生物活性,并且成功开发了候选杀菌剂品种氯苯醚酰胺和氟苯醚酰胺[8]。因此,本文在啶酰菌胺的基础上,将其胺部分的联苯替换为二苯醚,酰胺键旁边碳上的取代基由氯原子替换为三氟甲基,继而合成了一系列含二苯醚结构单元的新型烟酰胺类化合物。目标化合物的合成路线见图3。在本研究中,以廉价的取代苯酚和邻氟硝基苯为起始原料,通过芳环上的亲核取代反应和还原反应得到氨基二苯醚,其再与2-三氟甲基烟酸经EDCI/HOBt酰化得到22个未见报道的烟酰胺类化合物。随后,对所合成的目标化合物进行了结构鉴定、离体酶抑制活性测试、作用模式研究、构效关系和活体杀菌活性研究,旨在发现较高活性的新化合物。
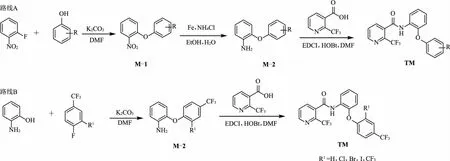
图3 目标化合物的合成路线
1 材料与方法
1.1 所用仪器及试剂
使用仪器及试剂:循环水式真空泵,型号为SHZ-D(Ⅲ);远红外线干燥箱,型号为W70-1;电子天平,型号为德国Sartotuis BSA223S-CW;旋转蒸发仪,型号为BüCHI R-200;隔膜泵,型号为BuCHI Vacuum Pump=V-700;低温循环冷却泵,型号为DLSB;恒温磁力搅拌器,型号为德国Heidolph MR3001。使用60~90℃沸程的石油醚;其他溶剂和试剂如无特殊说明,均从各大试剂公司购买,为分析纯或化学纯。
化合物结构鉴定与表征使用仪器:核磁共振仪,型号为Varian VNMR 400 MHz(溶剂为DMSO-d6,内标为TMS);数字熔点仪(温度计未经校正),型号为BüCHI B-545;高分辨质谱仪,型号为WATERS MALDI SYNAPT G2 HDMS(MA,USA)。
1.2 关键中间体的合成
1.2.1 中间体M-1的合成
在100 mL圆底烧瓶中加入5 mmol 2-氟硝基苯、6 mmol取代苯酚和7.5 mmol碳酸钾,再加入20 mL DMF后升温至100℃。TLC监测原料反应完全后停止反应,加入50 mL乙酸乙酯后用30 mL 2 mol NaOH洗2次,再用50 mL饱和食盐水洗1次,减压除去溶剂后得中间体M-1。
1.2.2 中间体M-2的合成
在100 mL圆底烧瓶中加入3 mmol中间体M-1和3.6 mmol氯化铵,再加入50 mL乙醇和5 mL水,加热至回流后加入还原铁粉(9 mmol),TLC监测原料反应完毕后停止反应,硅藻土过滤,滤液旋去大部分溶剂后加入50 mL乙酸乙酯萃取,有机相用50 mL饱和食盐水洗,无水硫酸钠干燥,减压除去溶剂后柱层析得中间体M-2。
将3 mmol取代的1-氟-4-三氟甲苯、3.6 mmol 2-氨基苯酚和4.5 mmol碳酸钾加入到50 mL圆底烧瓶中,再加入20 mL DMF,升温至70℃,TLC监测原料反应完毕后停止反应,加入50 mL乙酸乙酯,分别用50 mL饱和食盐水洗2次后加无水硫酸钠干燥,减压除去溶剂后柱层析得中间体M-2。
1.3 目标化合物的合成及表征
在100 mL圆底烧瓶中加入2-(三氟甲基)烟酸(2 mmol)、EDCI(0.460 g,2.4 mmol)、HOBt(0.325 g,2.4 mmol)和10 mL DMF,室温下反应1 h,然后将中间体M-2(2.4 mmol)加入到上述溶液,室温下反应24 h,减压除去溶剂后柱层析得目标化合物TM(图4、表1)。

图4 目标化合物的结构式

表1 目标化合物的结构
化合物TM-1为白色粉末,收率为85%,熔点为112.6~113.3℃。
1H NMR(400 MHz,DMSO-d6)δ:10.49(s,1H)、8.82(d,J=4.5 Hz,1H)、8.00(dd,J=10.3、5.9 Hz,2H)、7.79(dd,J=7.8、4.7 Hz,1H)、7.47-7.32(m,1H)、7.27-7.15(m,4H)、7.13-7.02(m,1H)、6.86(dd,J=6.2、3.3 Hz,1H)。HRMS(MALDI)Calcd for C19H12F4N2O2[M+H]+:377.090 77,found 377.090 19。
化合物TM-2为白色粉末,收率为75%,熔点为109.0~110.1℃。
1H NMR(400 MHz,DMSO-d6)δ:10.49(s,1H)、8.82(d,J=4.5 Hz,1H)、8.00(dd,J=10.3、6.0 Hz,2H)、7.79(dd,J=7.8、4.8 Hz,1H),7.46-7.33(m,1H)、7.27-7.14(m,4H)、7.13-7.02(m,1H)、6.91-6.80(m,1H)。HRMS(MALDI)Calcd for C19H12ClF3N2O2[M+Na]+:415.043 16,found 415.045 00。
化合物TM-3为白色粉末,收率为83%,熔点为126.5~127.6℃。
1H NMR(400 MHz,DMSO-d6)δ:10.46(s,1H)、8.82(d,J=4.4 Hz,1H)、7.99 (dd,J=8.4、5.2 Hz,2H)、7.80(dd,J=7.8、4.8 Hz,1H)、7.74(dd,J=8.0、1.4 Hz,1H)、7.47-7.34(m,1H)、7.26-7.16(m,2H)、7.16-7.10(m,1H)、7.01(dd,J=8.2、1.1 Hz,1H)、6.85-6.72(m,1H)。HRMS(MALDI)Calcd for C19H12BrF3N2O2[M+H]+:437.010 70,found 437.011 48。
化合物TM-4为白色粉末,收率为81%,熔点为87.2~88.1℃。
1H NMR(400 MHz,DMSO-d6)δ:10.39(s,1H)、8.82(d,J=4.5 Hz,1H)、8.01-7.91(m,2H)、7.79(dd,J=7.8、4.7 Hz,1H)、7.32(d,J=7.2 Hz,1H)、7.21(t,J=7.1 Hz,1H)、7.17-7.07(m,3H)、6.86(d,J=7.9 Hz,1H)、6.74-6.66(m,1H)、2.18(s,3H)。HRMS(MALDI)Calcd for C20H15F3N2O2[M+Na]+:395.097 78,found 395.097 39。
化合物TM-5为白色粉末,收率为89%,熔点为127.0~128.1℃。
1H NMR(400 MHz,DMSO-d6)δ:10.43(s,1H)、8.82(d,J=4.5 Hz,1H)、7.97(d,J=7.7 Hz,1H)、7.92-7.85(m,1H)、7.82(dd,J=7.8、4.7 Hz,1H)、7.77(d,J=7.8 Hz,1H)、7.64(t,J=7.4 Hz,1H)、7.32(d,J=7.6 Hz,1H)、7.28-7.24(m,2H)、6.99(d,J=8.3 Hz,1H)、6.94(dd,J=6.1、3.5 Hz,1H)。HRMS(MALDI)Calcd forC20H12F6N2O2[M+H]+:427.087 57,found 427.088 01。
化合物TM-6为白色粉末,收率为95%,熔点为112.2~112.9℃。
1H NMR(400 MHz,DMSO-d6)δ:10.43(s,1H)、8.81(d,J=3.2 Hz,1H)、7.96(d,J=7.5 Hz,1H)、7.84-7.70(m,2H)、7.49(t,J=8.3 Hz,1H)、7.36-7.25(m,2H)、7.12(dd,J=7.5、1.8 Hz,2H)、6.98-6.87(m,2H)。 HRMS(MALDI) Calcd for C20H12F6N2O3[M+H]+:443.082 49,found 443.081 49。
化合物TM-7为白色粉末,收率为78%,熔点为87.5~88.2℃。
1H NMR(400 MHz,DMSO-d6)δ:10.41(s,1H)、8.81(d,J=3.7 Hz,1H)、7.95(dd,J=6.3、3.2 Hz,1H)、7.78(dt,J=7.8、5.7 Hz,2H)、7.40(t,J=8.2 Hz,1H)、7.32-7.23(m,2H)、7.19(dd,J=8.0、1.2 Hz,1H)、7.12-7.06(m,1H)、6.99(t,J=2.0 Hz,1H)、6.92(dd,J=8.3、2.1 Hz,1H)。HRMS(MALDI)Calcd for C19H12ClF3N2O2[M+H]+:393.061 22,found 393.061 47。
化合物TM-8为白色粉末,收率为75%,熔点为122.8~123.9℃。
1H NMR(400 MHz,DMSO-d6)δ:10.42(s,1H)、8.81(d,J=4.5 Hz,1H)、8.02-7.94(m,1H)、7.91(d,J=7.7 Hz,1H)、7.78(dd,J=7.8、4.7 Hz,1H)、7.28-7.22(m,4H)、7.08-6.98(m,2H)、6.97-6.89(m,1H)。HRMS(MALDI) Calcd for C19H12F4N2O2[M+Na]+:399.072 71,found 399.072 03。
化合物TM-9为白色粉末,收率为83%,熔点为119.5~120.6℃。
1H NMR(400 MHz,DMSO-d6)δ:10.41(s,1H)、8.81(d,J=4.3 Hz,1H)、8.05-7.90(m,1H)、7.86(d,J=7.5 Hz,1H)、7.77(dd,J=7.7、4.7 Hz,1H)、7.43(d,J=8.8 Hz,2H)、7.31-7.18(m,2H)、7.07-6.89(m,3H)。HRMS(MALDI) Calcd for C19H12ClF3N2O2[M+H]+:393.061 22,found 393.060 87。
化合物TM-10为白色粉末,收率为82%,熔点为113.5~114.5℃。
1H NMR(400 MHz,DMSO-d6)δ:10.40(s,1H)、8.82-8.78(m,1H)、7.99-7.91(m,1H)、7.78-7.69(m,4H)、7.37-7.27(m,2H)、7.21-7.14(m,1H)、7.09(d,J=8.6 Hz,2H)。HRMS(MALDI)Calcd for C20H12F6N2O2[M+H]+:427.087 57,found 427.087 30。
化合物TM-11为白色粉末,收率为84%,熔点为109.0~109.9℃。
1H NMR(400 MHz,DMSO-d6)δ:10.50(s,1H)、8.82(d,J=4.5 Hz,1H)、8.00(t,J=7.5 Hz,2H)、7.80(dd,J=7.8、4.7 Hz,1H)、7.33-7.13(m,4H)、7.03(dd,J=7.6、1.7 Hz,1H)、6.83(t,J=7.6 Hz,1H)。HRMS(MALDI)Calcd for C19H11F5N2O2[M+H]+:395.081 35,found 395.080 77。
化合物TM-12为白色粉末,收率为80%,熔点为112.9~113.5℃。
1H NMR(400 MHz,DMSO-d6)δ:10.41(s,1H)、8.82(d,J=4.2 Hz,1H)、8.00(d,J=7.6 Hz,1H)、7.87(dd,J=7.6、1.7 Hz,1H)、7.80(dd,J=7.8、4.8 Hz,1H)、7.37(d,J=2.3 Hz,1H)、7.24-7.10(m,3H)、6.74(dd,J=7.8、1.3 Hz,1H)、6.68(d,J=8.5 Hz,1H)、1.37(s,9H)、1.27(s,9H)。HRMS(MALDI)Calcd for C27H29F3N2O2[M+H]+:471.225 39,found 471.224 49。
化合物TM-13为白色粉末,收率为85%,熔点为111.0~112.3℃。
1H NMR(400 MHz,DMSO-d6)δ:10.45(s,1H)、8.82(d,J=4.5 Hz,1H)、8.00(d,J=2.0 Hz,1H)、7.98-7.91(m,2H)、7.80(dd,J=7.8、4.8 Hz,1H)、7.69(dd,J=8.7、1.9 Hz,1H)、7.38-7.25(m,2H)、7.10(dd,J=7.7、1.7 Hz,1H)、7.03(d,J=8.6 Hz,1H)。HRMS (MALDI) Calcd for C20H11ClF6N2O2[M+H]+:461.048 60,found 461.048 77。
化合物TM-14为白色粉末,收率为82%,熔点为119.5~120.7℃。
1H NMR(400 MHz,DMSO-d6)δ:10.44(s,1H)、8.82(d,J=4.6 Hz,1H)、8.11(d,J=1.9 Hz,1H)、7.98-7.89(m,2H)、7.80(dd,J=7.8、4.8 Hz,1H)、7.73(dd,J=8.7、2.0 Hz,1H)、7.34-7.31(m,2H)、7.08(dd,J=7.7、1.8 Hz,1H)、7.00(d,J=8.6 Hz,1H)。HRMS(MALDI)Calcd forC20H11BrF6N2O2[M+H]+:504.998 09,found 504.997 21。
化合物TM-15为白色粉末,收率为81%,熔点为124.5~125.1℃。
1H NMR(400 MHz,DMSO-d6)δ:10.42(s,1H)、8.82(d,J=4.6 Hz,1H)、8.21(d,J=1.8 Hz,1H)、7.97(d,J=7.8 Hz,1H)、7.92(dd,J=7.6、2.0 Hz,1H)、7.80(dd,J=7.8、4.7 Hz,1H)、7.73(dd,J=8.7、1.9 Hz,1H)、7.36-7.22(m,2H)、7.02(dd,J=7.7、1.8 Hz,1H)、6.92(d,J=8.6 Hz,1H)。HRMS(MALDI)Calcd for C20H11F6IN2O2[M+H]+:552.984 22,found 552.984 07。
化合物TM-16为白色粉末,收率为85%,熔点为152.8~153.4℃。
1H NMR(400 MHz,DMSO-d6)δ:10.47(s,1H)、8.85(d,J=4.4 Hz,1H)、8.09(s,1H)、8.02(dd,J=16.3、8.3 Hz,2H)、7.89-7.83(m,2H)、7.44-7.34(m,2H)、7.21(d,J=7.4 Hz,1H)、7.15(d,J=8.8 Hz,1H)。HRMS(MALDI) Calcd for C21H11F9N2O2[M+H]+:495.074 96,found 495.074 18。
化合物TM-17为白色粉末,收率为89%,熔点为73.4~74.1℃。
1H NMR(400 MHz,DMSO-d6)δ:10.37(s,1H)、8.81(d,J=4.5 Hz,1H)、8.01-7.94(m,1H)、7.89(d,J=7.7 Hz,1H)、7.78(dd,J=7.8、4.8 Hz,1H)、7.22(d,J=7.8 Hz,1H)、7.18-7.09(m,2H)、6.99(d,J=7.7 Hz,1H)、6.74(s,1H)、6.67(dd,J=7.3、2.1 Hz,1H)、2.87-2.74(m,1H)、2.12(s,3H)、1.12(d,J=6.9 Hz,6H)。HRMS(MALDI)Calcd for C23H21F3N2O2[M+H]+:415.162 79,found 415.163 37。
化合物TM-18为白色粉末,收率为73%,熔点为85.8~87.1℃。
1H NMR(400 MHz,DMSO-d6)δ:10.39(s,1H)、8.82(d,J=4.5 Hz,1H)、8.04-7.89(m,2H)、7.80(dd,J=7.8、4.7 Hz,1H)、7.27(d,J=7.9 Hz,1H)、7.13(pd,J=7.4、1.7 Hz,2H)、6.98(d,J=7.7 Hz,1H)、6.73-6.63(m,2H)、3.18(dt,J=13.8、6.9 Hz,1H)、2.56-2.47(m,1H)、1.14(d,J=6.9 Hz,6H)。 HRMS(MALDI)Calcd for C23H21F3N2O2[M+H]+:415.162 79,found 415.162 46。
化合物TM-19为白色粉末,收率为75%,熔点为99.1~100.3℃。
1H NMR(400 MHz,DMSO-d6)δ:10.46(s,1H)、8.83(d,J=4.6 Hz,1H)、8.09-7.95(m,2H)、7.89-7.79(m,2H)、7.67(d,J=8.2 Hz,1H)、7.43-7.28(m,2H)、7.18(s,1H)、7.12(dd,J=7.6、1.9 Hz,1H)。HRMS(MALDI)Calcd for C21H11F9N2O2[M+H]+:495.074 96,found 495.074 00。
化合物TM-20为白色粉末,收率为90%,熔点为162.3~163.2℃。
1H NMR(400 MHz,DMSO-d6)δ:10.35(s,1H)、8.80(d,J=2.8 Hz,1H)、8.02-7.88(m,1H)、7.86-7.72(m,2H)、7.27-7.13(m,2H)、7.03-6.90(m,1H)、6.78(s,1H)、6.60(s,2H)、2.23(s,6H)。HRMS(MALDI)Calcd for C21H17F3N2O2[M+Na]+:409.113 43,found 409.113 81。
化合物TM-21为白色粉末,收率为82%,熔点为142.9~143.4℃。
1H NMR(400 MHz,DMSO-d6)δ:10.44(s,1H)、8.81(d,J=4.0 Hz,1H)、7.99(dd,J=7.7、1.8 Hz,1H)、7.92-7.87(m,1H)、7.84(s,1H)、7.78(dd,J=7.8、4.7 Hz,1H)、7.50(s,2H)、7.44-7.32(m,2H)、7.27(dd,J=7.8、1.7 Hz,1H)。HRMS(MALDI)Calcd for C21H11F9N2O2[M+H]+:495.074 96,found 495.075 33。
化合物TM-22为白色粉末,收率为79%,熔点为103.9~104.7℃。
1H NMR(400 MHz,DMSO-d6)δ:10.42(s,1H)、8.83(d,J=4.4 Hz,1H)、8.06-7.90(m,2H)、7.81(dd,J=7.8、4.7 Hz,1H)、7.39-7.24(m,2H)、7.14(dd,J=7.5、2.0 Hz,1H)、6.94(dd,J=9.1、6.0 Hz,2H)。HRMS(MALDI)Calcd for C19H10F6N2O2[M+H]+:413.071 92,found 413.410 12。
1.4 离体酶抑制活性测定
按文献[9]中的方法对合成的22个目标化合物进行离体酶水平的活性测试。测试中使用的SDH来自猪心线粒体。反应底物为琥珀酸和2,6-二氯酚吲哚酚钠(2,6-dichlorophenolindophenol,DCIP)。琥珀酸被氧化成延胡索酸,被还原后的泛醌继续将电子传递给电子受体DCIP,最终DCIP被还原并产生光吸收变化。反应总体积为200 μL,其中含pH=7.4的100 mmol/L磷酸缓冲液、20 mmol/L琥珀酸、53 μmol/L DCIP、0.3 mmol/L乙二胺四乙酸(EDTA)和20.6 nmol/L酶,在30℃恒温条件下反应,监测7 min内波长为600 nm处底物DCIP的还原产物的光吸收变化。根据DCIP的摩尔消光系数21 mmol/(L·cm),可以计算得到DCIP的还原产量,并用origin软件拟合得到反应初速度。加入不同抑制剂时反应速率不同,按照公式计算抑制率,并用Sigmaplot软件拟合求出IC50值。
1.5 分子对接
小分子的三维结构通过SYBYL-X 2.0构建,使用最陡下降法和共轭梯度法各2 000步优化结构,收敛标准为0.001 kcal/(mol·Å)。受体选用猪心SDH,其晶体结构可从PDB库中获取(PDB ID:1ZOY)。由于其活性腔只涉及B、C、D三条链,且距离A链较远,所以对接时将A链删除。对接时格点盒子大小设置为50×44×44,格点间距为0.375 Å。对接过程中使用拉马克遗传算法搜索构象,对接构象个数为256。其余参数均采用默认值。对接结束后,挑选合适的构象进行简单优化并计算结合能,挑选结合能最优的构象确定其结合模式[10]。
1.6 温室盆栽试验
委托沈阳化工研究院对22个目标化合物进行活体水平的杀菌活性测试,具体方法参见文献[11]杀菌剂卷中SOP-SC-1101黄瓜白粉病盆栽法、SOP-SC-1119玉米锈病盆栽法和SOP-SC-1120大豆锈病盆栽法。
2 结果与分析
2.1 离体酶抑制活性
目标化合物对猪心来源SDH的抑制活性测试结果见表2。由表2可见,10个化合物的IC50值达到了微摩尔水平,优于对照药剂啶酰菌胺,其中化合物TM-12、TM-15、TM-18的IC50值分别为0.24、0.23、0.20 μmol/L,较啶酰菌胺(IC50=2.57 μmol/L)提高了近10倍。总结构效关系发现:①对于单取代化合物,2号位取代最优,对于2号位取代的化合物活性,2-CF3>2-Br>2-Cl>2-F,说明2号位的位阻越大,越有利于活性的提高;②对于双取代化合物,2,3-二取代、2,4-二取代和2,5-二取代活性普遍较高,只有3,5-二取代的化合物的活性较差,在10 μmol/L的浓度下抑制率小于50%,进一步说明了2号位对活性的保持至关重要。
2.2 作用模式研究
为了研究目标化合物与靶标蛋白的作用模式,将酶抑制活性较好的代表化合物TM-18和啶酰菌胺分别与猪心来源SDH进行了分子对接,结果发现啶酰菌胺的酰胺氧原子与B_W173残基和D_Y91残基形成两个氢键(图5(A));吡啶环与C_R46残基形成π-cation相互作用;联苯的中间苯环处于C_I30、C_W35、C_I43和B_W172残基形成的疏水口袋中。代表化合物TM-18的结合模式(图5(B))与啶酰菌胺类似,其酰胺氧原子与B_W173残基和D_Y91残基形成两个氢键;吡啶环与C_R46残基形成π-cation相互作用;二苯醚的中间苯环部分同样处于SDH的疏水口袋中。此外,化合物TM-18二苯醚的末端苯环与D_Y91残基形成π-π相互作用,与C_I43残基和B_W173残基形成疏水相互作用,以上作用使得化合物TM-18与SDH结合时有较强的范德华力,如表3所示,其ΔEvdw为-48.41 kcal/mol,绝对值大于啶酰菌胺与SDH的ΔEvdw(-40.76 kcal/mol)绝对值。

表2 目标化合物对猪心来源SDH的抑制活性

图5 啶酰菌胺和化合物TM-18与猪心来源SDH的结合模式及TM-18和啶酰菌胺的叠合图

表3 代表化合物TM-18和啶酰菌胺与猪心来源SDH的计算结合自由能 kcal/mol
2.3 温室盆栽杀菌活性
目标化合物对黄瓜白粉病、玉米锈病和大豆锈病的杀菌活性测试结果见表4。由表4可见,目标化合物TM-5、TM-13、TM-14、TM-15、TM-16和TM-19表现出广谱的杀菌活性,在6.25 mg/L下对黄瓜白粉病、玉米锈病和大豆锈病防效优异,优于对照药剂啶酰菌胺。进一步EC90值测试结果见表5。化合物TM-16对黄瓜白粉病的治疗效果EC90值为28.74 mg/L,较苯醚甲环唑(108.15 mg/L)提高了近3倍。
3 结 论
本文以啶酰菌胺为先导化合物,设计合成了一类含二苯醚结构单元的靶向SDH的新型烟酰胺类化合物。酶抑制活性测试结果显示,10个化合物对猪心来源SDH的IC50值均达到了微摩尔水平,其中化合物TM-12、TM-15、TM-18的IC50值分别为0.24、0.23、0.20 μmol/L,较啶酰菌胺提高了近10倍。通过分子对接发现,新化合物在保留啶酰菌胺酸部分和酰胺键与SDH之间关键作用的同时,二苯醚的末端苯环还与氨基酸残基形成了π-π相互作用和疏水相互作用,这可能是新化合物活性较好的原因。

表4 目标化合物的温室盆栽杀菌活性筛选结果

表5 目标化合物TM-16的深入杀菌活性筛选
构效关系研究表明,二苯醚末端苯环2号位的取代基对活性的保持至关重要,且2号位上位阻较大的取代有利于活性的提高。进一步温室盆栽试验结果表明,化合物TM-5、TM-13、TM-14、TM-15、TM-16和TM-19表现出广谱的杀菌活性,在6.25 mg/L质量浓度下对黄瓜白粉病、玉米锈病和大豆锈病具有优异的防效,优于对照药剂啶酰菌胺。其中化合物TM-16对黄瓜白粉病的治疗效果EC90值为28.74 mg/L,明显高于苯醚甲环唑,具有进一步研究价值。本研究为新型烟酰胺类化合物的设计与构效关系研究提供了新思路。
