基于数字基因表达谱筛选雌雄鸡胚胎性别分化相关的差异表达基因
2020-03-13王晓路翟曼君解一凡张虎军李青峰赵宗胜
王晓路,翟曼君,解一凡,张虎军,李青峰,赵宗胜*
(1石河子大学动物科技学院,新疆 石河子,832003;2石河子大学生命科学学院,新疆 石河子,832003)
鸡在养殖生产中有着重要地位,生长发育性状和经济性状受着性别的影响,不同性别的鸡在生产性能有着显著的差异。在生产过程中根据不同生产需要我们需要不同性别的鸡,如肉鸡生产我们希望得到的雏鸡都是公鸡,但在蛋鸡生产过程中,希望得到的雏鸡都是母鸡。因此人们对性别分化进行了研究。性别这一质量性状受到遗传因素和环境条件的影响,所以可以通过这两方面来调控性别分化。与哺乳动物不同的是,在禽类中至今尚未发现与性别分化相关联的核心调控基因。脊椎动物性腺的分化过程是大致相同的,所以性别的决定在其遗传的途径上也是相对统一的,只是在有些的主要的调控点上有些差异。已经有学者对脊椎动物中与决定性别联系有的基因的表达情况在鸡胚中得到了证实[1]。
数字基因表达谱(digital gene expression profiling,DGE)是利用高通量测序、高性能计算分析的技术[2]。近年来,伴随着高通量技术的广泛应用,DGE技术也不断的被使用,这项技术已被广泛应用于各个领域。目前,有研究人员对中华鳖面对冷胁迫的反应途径和生物学功能进行了研究[3]。通过对小鼠心脏组织进行差异基因表达谱分析,进一步阐明了哺乳动物的心脏具有可测量的更新能力过程的机制,采用数字基因表达谱技术,检测到小鼠的心脏在不同关键时间点的全基因表达谱,利用此技术也鉴定了家蚕潜在母体基因[4]。
本试验拟用DGE技术,试图去建立有关雌雄鸡胚胎发育至第三天的DGE文库。从而筛选出不同组间的差异表达基因,以便进行相关的生物信息学分析,重点查找和分析与鸡胚胎性别分化相关的差异表达基因,为研究鸡胚胎性别分化奠定基础。
1 材料与方法
1.1 材料与试剂
鸡蛋购自于新疆中盛峪口禽业有限公司,品种为京红1号。在孵化机中进行同批次的孵化种蛋,并把温度调控在37.2 ℃~38.5 ℃,湿度控制在54%~70%。采集孵化第三天发育正常的胚胎,放入1.5 mL无酶离心管中,迅速置于液氮中,于-80 ℃保存待用。
TRizol试剂(购自于TRizol©Reagent,Invitrogen);DNA提取试剂盒、Marker1(均购自于北京天根生物工程);RT-PCR试剂盒(TaKaRa)。
1.2 胚胎采集与性别鉴定
随机采取3日龄(72 h)的鸡胚30枚,采集前照蛋,确保样品为受精蛋。采集的胚胎分为两部分,前部用于DNA提取,后部放入无酶管,放入-80 ℃冰箱中保存。
CHD(chromobox-helicase-DNAbinding)基因2550F/2718R,设计引物鉴定性别[5],CHD引物:F:5′-GTTACTGATTCGTCTACGAGA-3′;R:5′-ATTGAAATGATCCAGTGCTTG-3′;进行PCR扩增并用1.5%的凝胶电泳对产物进行检测。雄性和雌性胚胎组织分别扩增出1条和 2条片段。
1.3 DGE文库构建及测序
采集孵化72 h相同性别的鸡胚胎6枚,作为一份混合样,各自有3个重复。提取鸡胚胎中总的RNA并用凝胶鉴定总RNA的含量、纯度和完整性。由华大基因公司生物分析仪对样品先进行检测,质量合格后进行测序。RNA质量合格后,取每个胚胎总RNA,用磁珠富集总mRNA并反转成cDNA。加PrimerGX1和PrimerGX2进行PCR扩增。用6%的PAGE扩增出来样本条带,经胶回收纯化后由华大基因测序。
1.4 DGE数据分析
首先,筛选鸡胚中差异表达的基因以及模式聚类分析,然后进行Gene Ontology功能显著性富集,最后 KEGG Pathway显著性富集分析。
1.5 实时荧光定量PCR验证
1.5.1 引物序列设计及合成
根据GenBank中鸡的mRNA序列HINT1Z(NM_204689.1),SOX9的mRNA序列(NM_204281.1),鸡RSPO1的mRNA序(NM_001318444.1),鸡DMRT1的mRNA序列(NM_001101831.1),LHX9序列(NM_205426.1)和GAPDH(NM_204305.1),PCR引物见表1,引物合成由上海生工完成。

表1 各基因荧光定量引物
1.5.2 RNA提取及cDNA合成与实时荧光定量PCR
取-80 ℃保存的第三天胚胎组织样,提取总的RNA并将RNA反转录为cDNA,放-20 ℃备用。最后进行实时荧光定量PCR;所有实验组进行3个重复,以减少由于实验操作过程、环境等引起的不可避免的误差。鸡的GAPDH作为内参基因,实验所得数据利用2-△△CT的方法计算基因相对的表达量。
2 结果与分析
2.1 胚胎采集与性别鉴定
鸡孵化72 h的胚胎形态如图1所示,采样收集与此具有相似的大小及形态的胚胎。

图1 鸡胚胎发育72 h形态
用凝胶电泳检测DNA纯度,其条带清晰无拖尾;用分光光度计测核酸浓度,质量合格,-20 ℃保存用做后续试验。用CHD基因PCR,泳道1-4扩出2条带是雌鸡;5-11扩出1条带是雄鸡(图2)。

注:M:DNAmarkerⅠ(600 bp),1-4:雌性, 5-11:雄性,12:阴性对照图2 PCR扩增鉴定早期胚胎性别
2.2 DGE测序数据的评估
得到的2个DGE文库:胚胎发育到72 h(21期)的雌性胚胎(CF)和雄性胚胎(CM)。经测序后的雌鸡、雄鸡获得Clean Reads数分别为3663147、3622515,分别占原始数据3693492、3650026的99.18%、99.25%。分别有2840108、2817776条Clean Reads数可以比对到参考基因序列中,分别占总Clean Reads数的77.53%、77.79%。
2.3 差异表达基因筛选
差异基因的表达图如图3所示,利用DGE筛选出它们之间表达差异的标签,红色代表上调,绿色代表下调;雌性鸡和雄性鸡之间的差异表达基因的个数是66个,上调的是41个基因,下调的是25个基因(图4)。

图3 差异基因表达图

图4 雄性(CF)vs雌性(CM)差异表达基因统计
2.4 差异基因表达模式聚类分析
功能相似的基因往往会有相类似表达模式。每行是一个基因,不同表达变化的倍数或着表达量用不同的颜色表示。差异基因聚类:红色表达上调,绿色表达下调;对于样品的聚类:颜色越深则表示其表达量越高(图5)。

图5 差异表达基因等级聚类图
2.5 Gene Ontology功能显著性富集分析
模式聚类分析,是一种表达模式即帮助科研人员观察到有某个功能的所有的差异基因表达。GO 功能分为3大类即分子功能、细胞组分以及生物过程。这3个大类别又被详细的划分为62个亚类,例如代谢过程、生化过程、免疫防御生长与发育等过程。雌性鸡与雄性鸡,通过功能注释,其中生物过程共获得与性别分化相关基因5个:HINT1Z、SOX9、RSPO1、DMRTI基因和LHX9基因(图6)。

图6 CF与CM差异表达基因分子功能显著富集的GOterms
2.6 KEGG Pathway显著性富集分析
Pathway分析利用KEGG生物通路数据库进行富集度分析,对比获得的差异表达基因经过KEGG数据库的注释,能够准确定位到对应的Pathway条目中,经过超几何的检验,得到差异基因显著富集20条。包含p53、 Wnt以及TGF-β等参与生殖、生长发育相关的信号通路。部分结果展示如表2所示。

表2 差异表达基因显著富集的部分Pathway
注:表中上标均表示次方
2.7 荧光定量
为验证测序结果,随机选5个差异表达基HINT1Z、SOX9、RSPO1、DMRTI基因和LHX9基因,设计引物,进行实时荧光定量PCR(QuantitativeReal-timePCR)分析,P<0.05为显著*,P<0.01为极显著**(图7)。HINT1Z基因在雄鸡中比在雌鸡中的表达量较高,在雌雄鸡中表达差异不显著;RSPO1基因表达雌鸡比雄鸡中高;SOX9基因表达量雄鸡高于雌鸡且差异极显著;DMRT1基因在雄鸡中的表达量高于雌鸡且差异极显著;LHX9雄鸡中的表达量较雌鸡中高但差异不显著。各基因的相对表达量均与DGE文库中上调与下调的结果一致(图8)。这些基因的缺失或着突变会引起个体性腺发育异常或着发生性反转,在鸟类的性别分化过程中已被证明很重要,部分基因在常或性染色体上。这些基因不会单独发挥功能需要多个基因参与来共同调控性别分化。
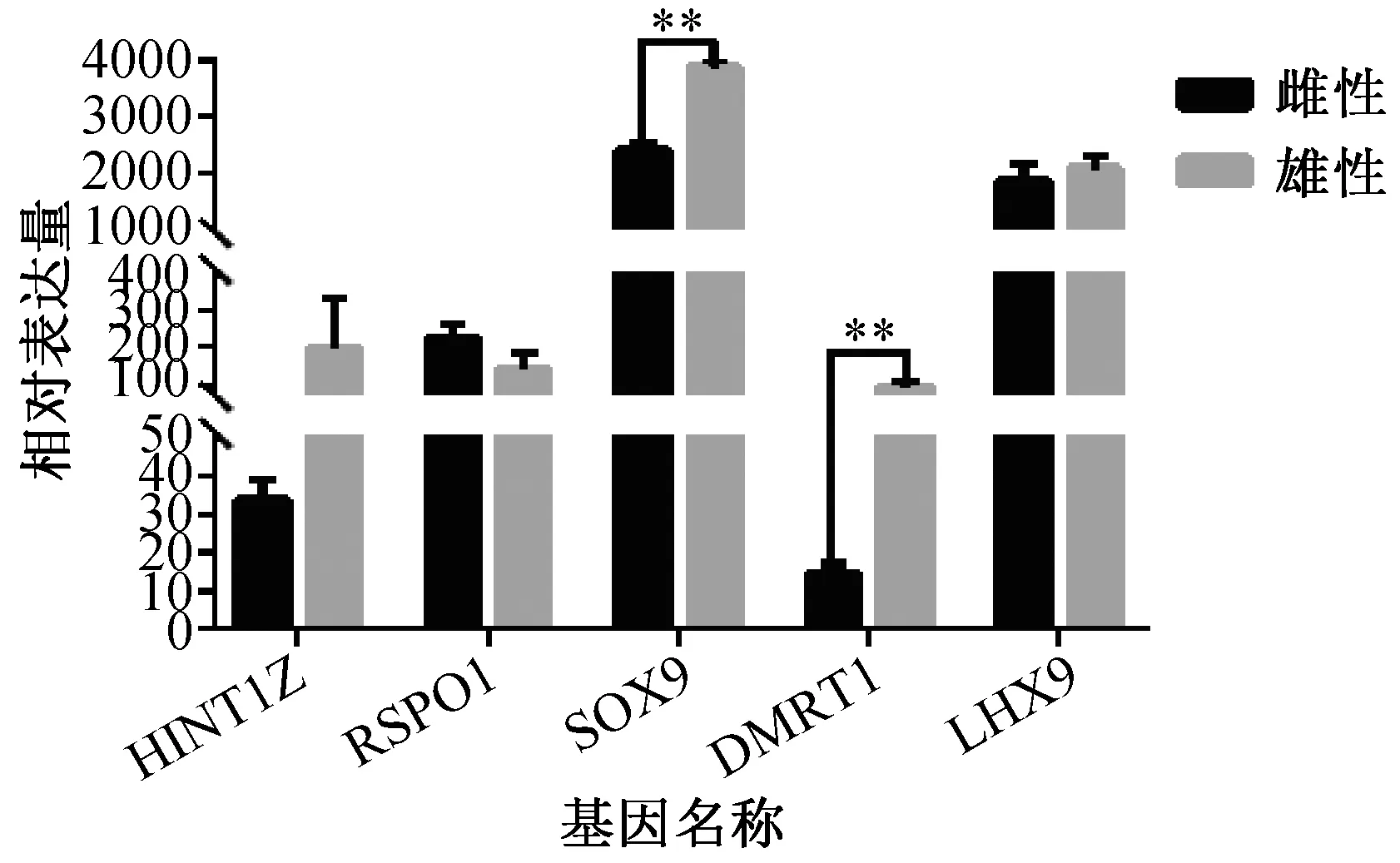
注:*表示P<0.05,**表示P<0.01图7 差异基因相对表达量

图8 差异表达基因的q RT-PCR验证结果和 DGE文库测序结果的差异倍数比较
3 讨论
鸡种蛋孵化第3天,胚胎中肾腹内侧表面可见原始性腺,接着性腺会开始分化为雌雄鸡,本试验选取72 h的鸡胚为试验对象为了探究在胚胎分化时刻与相别分化相关基因的表达情况来探究在早期胚胎发育过程中与性别分化相关的决定基因。孵化3 d雌、雄鸡进行DGE分析,共计获得大约7 M的数据量,两个样品的cleanreads都大于99%,表示测序质量较高。将两组cleanreads数据分别与数据库中参考转录组比对,其中有77% 以上序列与数据库中的参考转录组能比对一致,结果比较理想,RPKM定量分析,选出样品间差异基因,GO功能及KEGG,表明差异基因为控制性分化相关基因,如RSPO1、SOX9、DMRTI、LHX9基因,在表达时间上也与前期研究一致[6-7]。
RSPO1基因,是RSPO家族第一个被发现的基因,因为它表达在胚胎神经管顶板且与血小板有相同结构域,所以称为RSPO1。RSPO1基因在性分化中卵巢发育扮演着关键角色,本试验表明RSPO1基因表达雌鸡比雄鸡中高。鸡胚胎生长至4.5 d,RSPO1基因在雌鸡和雄鸡胚胎性腺中的表达不同,到E8.5差异会变大,RSPO1基因在雄鸡性腺中表达不变,而雌鸡性腺中表达上升[8]。卵巢发育RSPO1高表达,RSPO1突变会引起XX型的病人性反转。WNT信号通路中的调节物是RSPO1基因,它作用的通路有β-连环蛋白等[9]。WNT蛋白和RSPO1基因共表达,且能正向调节β-连环蛋白信号,推断在WNT通路中能分泌生长因子。Wnt4能激活β-连环蛋白信号传递,是形成正常卵巢必备的。在鸡胚胎中,RSPO1雌性上调,性腺的皮质到外髓中RSPO1和WNT4表达。
具有一个能编码约79个氨基酸的HMG保守序列是SRY相关促HMG盒基因家族共性,发现SRY基因后首个有内含子的Sox家族成员是Sox9基因。本试验表明SOX9基因表达量雄鸡高于雌鸡且差异极显著。Sox9基因在鸡胚胎孵化E6.5 d到E8.5 d时在雌性性腺中不表达,而在雄性中表达。性分化中哺乳动物性反转是由XY胚胎的Sox9基因失活引起。XX胚胎中,Sox9表达上调可阻止雌性生殖器发育来向雄性发育[10]。Sox9异位表达,可使XX胚胎向XY个体发育。Sox9突变使性腺发育失常,XY性别发育异常或XX男性性反转,性腺发育失常占约为30%~40%是由Sox9基因突变引起[11]。鸡无SRY基因,但能表达Sox9,最新研究表明[12],Sox9基因单个远端增强子缺失后的性反转,Sox9基因中的增强子13是启动小鼠睾丸发育所必需的,它的缺失导致XY雌性的Sox9转录水平相当于XX性腺的转录水平。
鸟类DMRT1基因在Z染色体,其作用遵循剂量机制,是鸟类中与性别分化相关的备选调节基因。DMRT1是锌指样家族的一员,所有物种DMRT1基因有保守DNA结合域与性别决定有关,且在性分化中相对保守的。本研究中DMRT1基因在雄鸡中的表达量高于雌鸡且差异极显著。成人睾丸中表达DMRT1但卵巢中较少表达。雄鼠DMRT1基因敲除不会出现性反转,但其睾丸由于生殖及支持细胞功能紊乱会发育失常。人类性腺发育失常可由染色体含DMRT1区段缺失引起。DMRT1基因在鸡胚性腺外器官表达情况被Ayers等[13]首次发现,它在导管形态且在两性鸡胚的早期缪勒氏管中也都表达。雌性鸡胚性腺被含外源DMRT1的病毒载体感染,结果DMRT1在雌性中高表达且上调相关基因的表达来诱导雄性通路,抑制雌性鸡性逆转[14]。总之,DMRT1是性腺发育标志的关键基因,但它的产物对性别决定不能直接起作用,有可能是通过调控其他的雄性基因,一起作用于性腺。
HINT1Z基因又称HINTZ基因,可以与目前为止在禽类W性染色体上发现唯一与性分化有关的基因HINTW的编码产物形成二聚体影响雄性发育。HINT1Z基因在胚胎发育前期中雄鸡发育较高但是差异不显著。LHX9(LIM-homeodomain gene9)是保守转录因子家族Apterous组的一员,LHX9基因对性腺、四肢、心脏和神经系统等多个器官发育是必需的,本研究发现在早期胚胎发育中LHX9雄鸡中的表达量较雌鸡中高但差异不显著。有学者研究发现LHX9基因突变的小鼠基因型是雌性或雄性均表现为性腺不育[15],研究者还发现LHX9基因有3种亚型,每个亚型都有独特的表达模式,且只有LHX9a和LHX9c在肢体发育早期表达。HINT1Z基因、LHX9基因在禽类上胚胎性腺发育的研究还有待探索。
4 结论
通过成功构建了鸡孵化第3天的雌性和雄性胚胎DGE文库,通过生物信息学分析,筛选出鸡早期胚胎发育中与性别分化相关的差异表达基因HINT1Z、RSPO1、SOX9、DMRTI、LHX9基因,为禽类早期胚胎性别分化的研究奠定基础。
