氨基酸席夫碱类小分子探针衍生物电子光谱的检测研究*
2020-03-12赵小菁徐敬敬赖国华阮文娟
赵小菁,徐敬敬,赖国华,阮文娟
(1 杭州医学院通识教学部,浙江 杭州 310053;2 南开大学,天津 300071)
细胞信号转导是一切生命活动的基础,细胞膜上蛋白受体介导的跨膜细胞信号转导是细胞信号转导的重要组成部分,是人体细胞感受外界环境和调控代谢产物及生理反应的基础,尤其和人类重大疾病的产生密切相关,因此具有重要的理论和实际意义[1]。通过设计合成一系列多样化的小分子化合物作为探针,以这些探针为工具可以深入开展细胞生理、病理活动的调控机制,细胞关键信号转导通路及重要靶标、抑制剂和标记物的发现以及基于金属催化剂的活细胞生物分子激活等方面的研究[2]。小分子化合物作为荧光探针,具备体积小、合成简单等特点,在蛋白质成像技术中扮演着越来越重要的角色[3-4]。
氨基酸席夫碱具有氮、氧等多个配位原子,是一类有意义的生物配体,是细胞生长所必需的[5]。研究此类配体的金属新配合物,有助于了解生物体内金属离子-蛋白质间的键合作用,并可用来设计合成小分子探针[6],研究活性化合物与靶标蛋白的作用[7]。还可以开发具有生物活性的非铂系前药探寻其与DNA的作用模式[8]。本文试图通过检测氨基酸席夫碱及其金属配合物的电子光谱来考察氨基酸席夫碱类探针衍生物的作用活性。因此,我们合成了Sal-Gly(甘氨酸席夫碱)和Sal-Met(甲硫氨酸席夫碱)及其金属配合物作为小分子探针衍生物,检测了氨基酸席夫碱金属化合物的紫外可见光谱和荧光光谱,并进行了探讨。
1 实 验
1.1 仪器与试剂
Perkin-Elmer 240元素分析仪;Nicolet Auatar 370 DTGS光谱仪(KBr压片);Mercury Plus 400核磁共振仪(400 Hz), 四甲基硅烷TMS为内标;Shimadu UV-2450紫外-可见分光光度计。
溶剂三氯甲烷经NaHCO3和CaCl2干燥处理, 重蒸后使用。其他试剂均为分析纯, 未经进一步纯化。
1.2 氨基酸席夫碱类小分子探针衍生物的合成
氨基酸席夫碱化合物按前文报道[9]方法合成,所得粗产品用无水乙醇重结晶。合成路线见图1。

图1 氨基酸席夫碱及其金属配合物的合成路线
Sal-Gly产率 88%,1H NMR(CD3OD) δ: 8.398(s, 1H, CH=N), 4.228(s, 2H, CH2ⅰ), 7.301~7.307(m, 1H, Ph-H①), 7.258~7.288(m, 1H, Ph-H②), 6.760~6.796(m, 1H, Ph-H③), 6.711~6.748(m, 1H, Ph-H④); IR(KBr) ν/cm-1: 3445.9(-OH), 1649.0(-CH=N-), 1596.2(asCOO), 1395.6(sCOO)。
Sal-Gly-Zn产率 83%,1H NMR(CD3OD) δ: 8.343(s, 1H, CH=N), 4.099(s, 2H, CH2ⅰ), 7.195~7.182(m, 1H, Ph-H①), 7.161~7.182(m, 1H, Ph-H②), 6.791~6.813(m, 1H, Ph-H③), 6.545~6.580(m, 1H, Ph-H④); IR(KBr) ν/cm-1: 3409.3(-OH), 1644.4(-CH=N-), 1598.2(asCOO), 1397.6(sCOO), 545.7(Zn-N), 438.9(Zn-O)。
Sal-Gly-Cu产率 79%,1H NMR(CD3OD) δ: 8.251(s, 1H, CH=N), 4.087(s, 2H, CH2ⅰ), 7.225~7.262(m, 1H, Ph-H①), 7.171~7.201(m, 1H, Ph-H②), 6.833~6.847(m, 1H, Ph-H③), 6.525~6.560(m, 1H, Ph-H④); IR(KBr) ν/cm-1: 3419.8(-OH), 1627.9(-CH=N-), 1576.6(asCOO), 1294.2(sCOO), 474.5(Cu-N), 426.3(Cu-O)。
Sal-Met产率 67%,1H NMR(CD3OD) δ: 8.515(s, 1H, CH=N), 4.234~4.267(m, 2H, CH2ⅰ), 2.238~2.312(m, 2H, CH2ⅱ), 2.560~2.645(m, 2H, CH2ⅲ), 2.108(m, 2H, CH2ⅳ), 7.397~7.415(s, 1H, Ph-H①), 7.314~7.356(s, 1H, Ph-H②), 7.135~7.173(s, 1H, Ph-H③), 6.887~6.907(s, 1H, Ph-H④); IR(KBr) ν/cm-1: 3448.2(-OH), 1661.8(-CH=N-), 1448.6(asCOO), 1395.6(sCOO)。
Sal-Met-Zn产率 85%,1H NMR(CD3OD) δ: 8.397(s, 1H, CH=N), 4.002(s, 2H, CH2ⅰ), 2.620~2.635(m, 2H, CH2ⅱ), 3.127,3.476(m, 2H, CH2ⅲ), 2.526~2.545(m, 2H, CH2ⅳ), 7.230~7.251(s, 1H, Ph-H①②), 6.856(s, 1H, Ph-H③), 6.603(s, 1H, Ph-H④); IR(KBr) ν/cm-1: 3402.1(-OH), 1629.9(-CH=N-), 1447.7(asCOO), 1394.8(sCOO), 545.0(Zn-N), 442.8(Zn-O)。
Sal-Met-Cu产率 72%,1H NMR(CD3OD) δ: 8.301(s, 1H, CH=N), 3.876(s, 2H, CH2ⅰ), 7.155~7.173(m, 1H, Ph-H①), 7.121~7.142(m, 1H, Ph-H②), 6.801~6.812(m, 1H, Ph-H③), 6.556~6.563(m, 1H, Ph-H④); IR(KBr) ν/cm-1: 3442.1(-OH), 1636.7(-CH=N-), 1512.4(asCOO), 1295.3(sCOO), 475.6(Cu-N),429.3(Cu-O)。
1.3 氨基酸席夫碱类小分子探针衍生物电子光谱的检测
以CHCl3:C2H5OH=1:1的混合溶液为溶剂,氨基酸席夫碱金属配合物配制溶液浓度为5.0×10-4mol/L,静置,分别在荧光分光光度计和紫外分光光度计上进行检测。紫外可见光谱测试条件:室温,样品池为1 cm×1 cm×1 cm石英池,设置波长范围190~1100 nm,测试波长范围200~700 nm,波长分辨率为0.1 nm。荧光光谱测试条件:室温,激发波长λex为451 nm(Sal-Gly金属配合物)和480 nm(Sal-Met金属配合物),样品池为1 cm×1 cm×1 cm石英池,狭缝宽度5.5 nm,记谱范围为350~600 nm。
2 结果与讨论
2.1 氨基酸席夫碱类小分子探针衍生物的紫外可见光谱
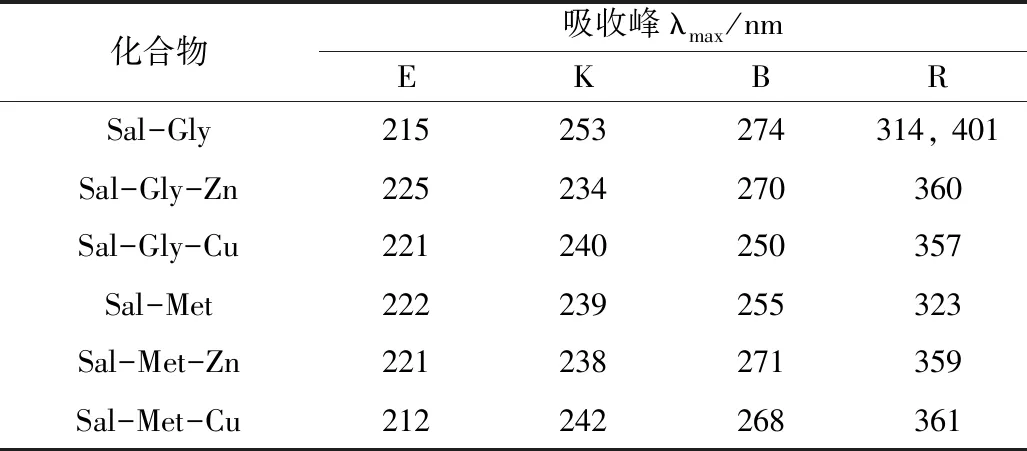
表1 氨基酸席夫碱类小分子探针衍生物的紫外可见光谱数据
以氯仿和无水乙醇1:1混合为溶剂作参比,在UV/vis-2450紫外-可见分光光度计上分别测定200~700 nm范围内氨基酸席夫碱及其金属配合物的紫外吸收光谱,所得数据如表1所示。化合物4个主要吸收峰(E2带、K带、B带、R带)。E2带是酚羟基中氧原子的P轨道上的孤对电子与苯环大π键形成的n-π*吸收带。K带是亚胺基与苯环大π键的π-π共轭所形成的π-π*吸收带。B带是芳香族化合物的特征吸收带。R带是亚胺基中的N原子P轨道上的孤对电子与苯环大π键所形成的n-π*吸收带,跃迁几率小,吸收强度弱[10]。当金属离子与不同氨基酸水杨醛席夫碱反应后,配合物R带的λmax值不同,是由于氨基酸席夫碱R基不同所致。
2.2 氨基酸席夫碱类小分子探针衍生物的荧光光谱
选择氨基酸席夫碱金属配合物溶液的最大激发波长355 nm,其发射光谱如图2所示。
由图2可知,Sal-Gly金属配合物的最大发射波长为451 nm左右,Sal-Met金属配合物的最大发射波长在480 nm处,铜配合物的荧光强度与锌配合物相比很低,原因是金属配合物的荧光性质与过渡金属离子的d电子数直接相关[11]。当d电子未充满时,出现了所谓的猝灭效应。这是因为d电子未满时,配体的电子从激发态跃回基态时可发生配体电子向金属离子d轨道转移的现象,导致跃回到配体基态的电子数减少从而出现猝灭效应[12]。Cu2+的d电子为d9,由于d轨道未充满,因此易于发生氧化还原,倾向于接受配体的电子,达到d10的全满稳定结构,因而电子从配体转移到金属离子d轨道的几率大,造成配体荧光强度的减弱[13]。锌配合物的荧光强度较高,原因可能是:一方面,Zn2+与配体的配位增加了分子结构的刚性从而使荧光增强;另一方面,Zn2+的d电子为全充满的d10状态,具有较稳定结构,所以Zn配合物荧光强度较配体的更强[14]。
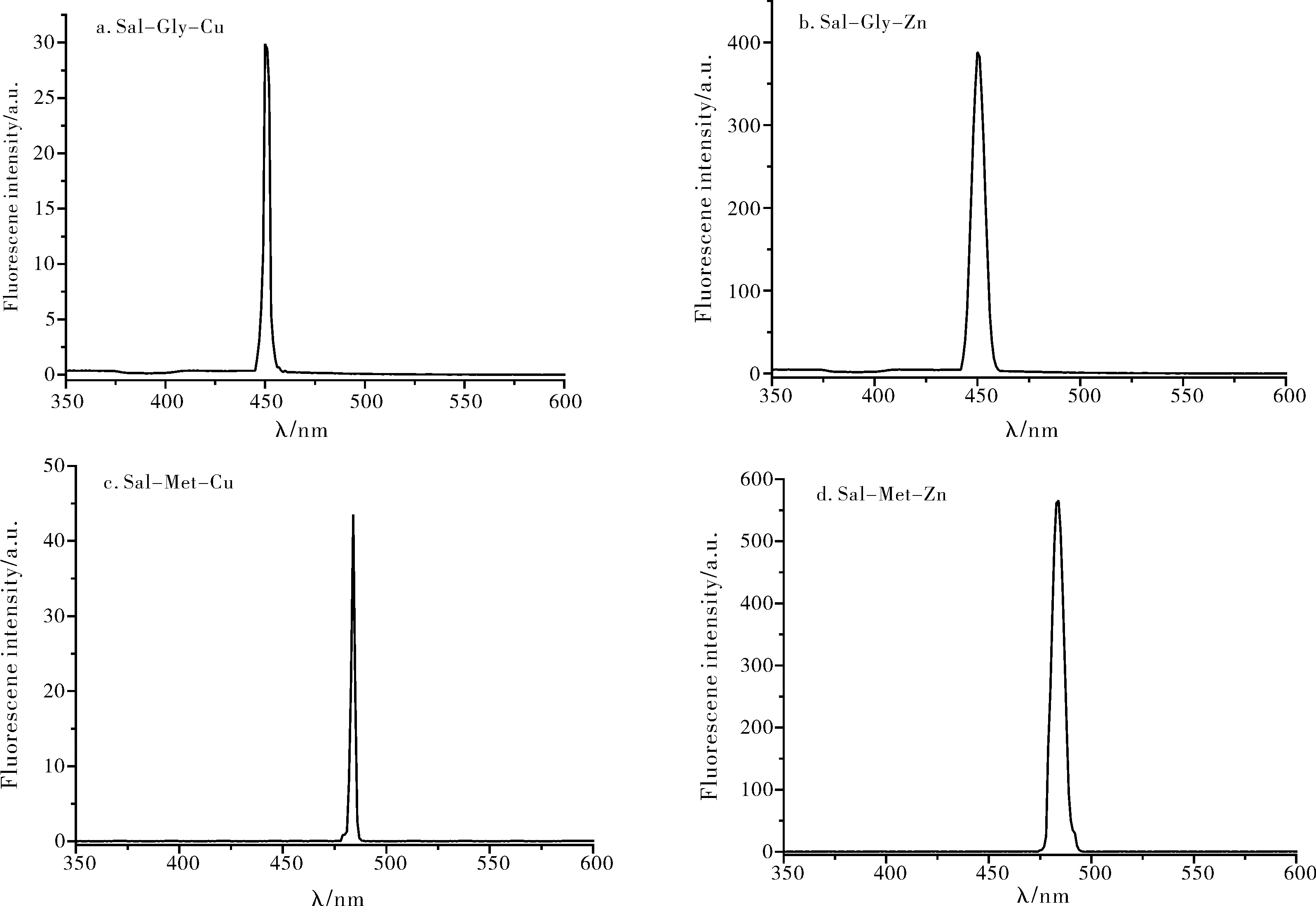
图2 样品的荧光光谱
3 结 论
本文对Sal-Gly和Sal-Met金属化合物的紫外可见光谱和荧光光谱进行了研究。所得的结果表明席夫碱的结构对光谱性质的变化有着重要的影响。
氨基酸席夫碱化合物的紫外可见光谱有4个主要吸收峰(E2带、K带、B带、R带),λmax值不同,是由于氨基酸席夫碱R基不同所致;而荧光光谱中,铜配合物的荧光强度与锌配合物相比很低,原因是金属配合物的荧光性质与过渡金属离子的d电子数直接相关。
