固定化酶:从策略到材料设计
2020-03-12陈海欣张赛男赵力民
陈海欣,张赛男,赵力民,陈 瑶,4
(1.广东药科大学医药化工学院,广东广州510000;2.广东省化妆品工程技术研究中心,广东广州510000;3.南开大学药物化学生物学国家重点实验室,天津300071;4.南开大学药学院,天津300071)
酶作为一种生物催化剂,与化学催化剂相比具有高效、专一、催化条件温和等优点,在食品、化工、医疗、能源和环境等领域具有巨大的应用潜力。然而,在实际操作环境或极端条件(如高温、强酸强碱或有机溶剂等)下,酶分子容易失活,且不易回收和重复利用,使得酶的工业化应用受到了很大限制[1-2]。为了解决酶的工业化应用问题,固定化酶技术应运而生。酶的固定化是指利用固体载体将酶束缚或限制于一定区域内,仍能保持酶特有的催化活性,并使其可回收及重复使用的一类技术[3]。固定化酶具有以下优点:①提高酶的稳定性。通过载体的保护作用,使其在较宽泛的pH、高温或有机溶剂中仍保持活性。②提高酶的分离、回收效率和再利用性。可利用过滤等方法,简单地将酶与产物分离,并回收利用。③提高酶的催化活性。通过载体固有的亲疏水性等性质,调节酶的微环境及其与底物的反应环境,从而促进酶催化反应。④提高酶的选择性。通过载体的空间位阻或孔道大小所提供的尺寸筛分等效应,可以选择一定尺寸的底物进行催化[4]。
固定化酶技术早在1916年首次被发现[5],自20世纪60年代以来得到迅猛发展。随着固定化材料和酶工程领域的进一步发展,固定化酶的研究日益得到科研工作者的广泛关注。由于固定化酶的化学和物理性质很大程度上受到固定载体和固定方法的影响,开发对酶活影响最小(甚至增强酶活)且不容易发生泄漏的载体材料和固定技术一直是固定化酶的研究目标。
近年来,随着生物技术、化学合成以及材料科学的学科交叉和发展,固定化酶在载体的开发和固定化技术的提高方面取得长足的进展。其中,新型多孔框架材料,如金属-有机框架材料(MOFs)[6]和共价有机框架材料(COFs)[7],作为酶的新型固相载体的研究逐步展开。此外,可实现大尺寸生物分子固定化的新方法,如原位包覆策略也逐渐成熟,使得越来越多种类的生物大分子实现高效固定化[8-11]。
本文中,笔者主要总结了以酶为代表的生物大分子的固定化方法、固定载体材料的种类及其选择方法,并总结了近年来固定化酶在生物催化、生物传感以及生物分离这三大主要应用领域的研究进展,重点介绍了金属-有机框架材料(MOFs)和共价有机框架材料(COFs)作为新型结晶性多孔载体材料在酶的固定化方面的最新进展。
1 固定化酶的方法
固定化酶是通过物理或化学方法将游离酶与特定的载体材料结合。按照酶与载体的结合方式,主要分为吸附法[5]、共价结合法[12]、包埋法[13]、交联法[14]以及近年来发展起来的原位合成覆法[8]五大类(图1)。

图1 酶固定化方法示意Fig.1 Schematic diagram of enzyme immobilization strategies
吸附法是最简单、方便的固定化方法,主要分为表面吸附和孔道吸附两类,通过弱的相互作用力(如氢键、范德华力、亲疏水作用和静电作用等)实现酶的固定化。共价结合法主要利用酶表面的氨基酸残基,如氨基(—NH2)、羧基(—COOH)或巯基(—SH)等与载体材料上特定官能团发生化学反应,以强的共价键实现两者的结合。包埋法是将酶包封在材料中,一般是将载体原料与酶“一锅反应”,通过机械搅拌、加入交联剂等将酶分子包裹在凝胶等材料中的方法。交联法是利用酶自身的双官能团结构或者加入一些交联剂(如戊二醛、甲苯二异氰酸酯等)联结起来而不需要载体的一种固定化方法。此外,原位合成法(denovo法)也是一种酶的高效固定方法,主要是基于MOFs材料而发展起来的,是指将酶溶液与合成MOFs的前体(如金属盐和配体)混合在一起,在MOFs结构的形成、生长过程中,同时实现酶的包覆的新型固定化策略。5种固定化方式各有优缺点,总结于表1中。
2 固定化酶的载体
选择合适的固体载体对酶的固定及其应用起着至关重要的作用。载体材料的选择应当考虑酶的类型、反应介质、反应条件及应用领域等方面。理想的固定化酶载体应满足以下条件:①具有热稳定性、力学稳定性和化学稳定性。②该载体应具有较高的负载酶能力,不能导致酶的变性或失活。③提供生物相容且有利于酶催化反应的微环境。④工业应用的载体应是相对便宜和环境友好的材料[15-18]。随着生物、材料和化学学科的不断交叉发展,越来越多的可服务于固定化生物分子的新型载体材料被开发和应用。按照载体材料化学组成的不同,可将其分为无机载体材料(包括沸石[19]、多孔二氧化硅[20]、活性炭[21、硅藻土[22]和氧化铝等)、无机-有机杂化载体材料(包括金属-有机框架材料(MOFs)等[6]以及纯有机载体材料(包括天然高分子材料[23]、共价有机框架材料(COFs)[7]等)这三大类。其中,金属-有机框架材料(MOFs)和共价有机框架材料(COFs)两种新型结晶性材料具有可调节的孔道、较高的比表面积、多样的结构及易于后修饰等特点,成为近几年来固定载体的研究热点,引起国内外科研工作者的广泛关注。

表1 5种酶固定化方法的优缺点
2.1 无机载体材料
无机载体材料(包括沸石、多孔二氧化硅、活性炭、硅藻土、金属氧化物及碳纳米管等)由于热稳定性和化学稳定性强、力学强度高、来源广泛和价格低等优点,已被广泛用于酶的固定化。
Diaz等[24]首次将4种尺寸不同的酶(细胞色素C、胰蛋白酶、木瓜蛋白酶和过氧化物酶)成功固定在孔径为4 nm的介孔二氧化硅MCM-41上,结果发现负载效率与酶的尺寸大小有明显的相关性。
Sheng等[25]通过席夫碱反应将木瓜蛋白酶共价固定在多孔Fe3O4纳米颗粒上,固定化的木瓜蛋白酶比游离酶具有更高的活性、更宽的pH和温度适用范围,循环催化8次后仍保持70%的初始酶活。
Khan等[26]分别通过物理吸附和共价固定两种方法将β-半乳糖苷酶固定在修饰后的钴/多壁碳纳米管(MWCNTs)复合物上,两种方法均提高了酶的稳定性和循环利用性,同时发现共价固定法比物理吸附具有更高的负载量和循环利用性。
虽然无机材料已被广泛应用,但是由于其结构不易调控、有时易发生酶泄露等问题,导致其应用仍具有一定的局限性。
2.2 无机-有机杂化载体材料
金属-有机骨架材料(MOFs),又称多孔配位聚合物(PCPs),是一类由无机金属离子或金属簇(nodes)与有机配体(linker)通过配位键连接而成的一类新型的多孔晶体材料,在气体吸附和分离、能源储存、质子传导和药物传输等方面具有巨大的应用潜力[27-30]。由于金属节点和有机配体的结构及种类具有多样性,科研工作者可以灵活设计并合成具有特定几何形状、尺寸和功能的MOFs。同时,MOFs具有极高的比表面积和高孔隙率的特点,使其可作为优良的生物分子固定化平台。用MOFs固定酶具有以下优点[6,31-32]:①高比表面积和高孔隙率使得其可达到很高的酶负载量。②MOFs具有开放的孔隙结构,底物和产物可以通过孔隙进行运输和传递。③MOFs的金属节点、配体和拓扑结构具有多样性,可以根据酶的性质和应用目的进行相应的载体材料设计和优化,以提升酶的固定化效果。④MOFs具有高结晶性,可提供材料明确而清晰的结构信息,这为进一步研究载体与酶的相互作用及相关机制提供了有利条件。
2011年,笔者所在课题组的Lykourinou等[33]首次成功将微过氧化物酶(MP-11)固定在介孔的Tb-mesoMOF中,并证明了MP-11@Tb-mesoMOF在有机溶剂中具有很好的催化性能和优良的重复利用性。为了探究MOFs的包裹机制,Chen等[34]进一步研究了尺寸为2.6 nm×3.2 nm×3.3 nm的细胞色素c(Cyt c)进入孔隙窗口为1.3 nm和1.7 nm的Tb-mesoMOF机制,通过研究发现,Cyt c能够进入孔隙比酶本身尺寸更小的MOF孔道,并且在进入过程中酶的构象会发生明显变化,在穿过MOFs相对较小的孔隙窗口后,酶进入了较大的笼状孔空间中(~3.9 nm),因而自身会发生构象恢复,从而恢复其活性(图2)。这一有趣的发现与自然界中普遍存在的生物大分子穿膜现象高度相似,这一研究也为利用多孔框架材料固定化生物分子研究其传递现象提供了新的思路。此外,Chen等[35]进一步解释了酶为什么可以保留在MOFs孔内部而不易泄露,通过拉曼光谱等研究发现MP-11与Tb-mesoMOF之间有着强π-π相互作用,使得酶与MOFs的结合更牢固(图3)。这些工作为接下来设计和优化MOFs材料,进而为酶的固定化方向奠定了理论基础。
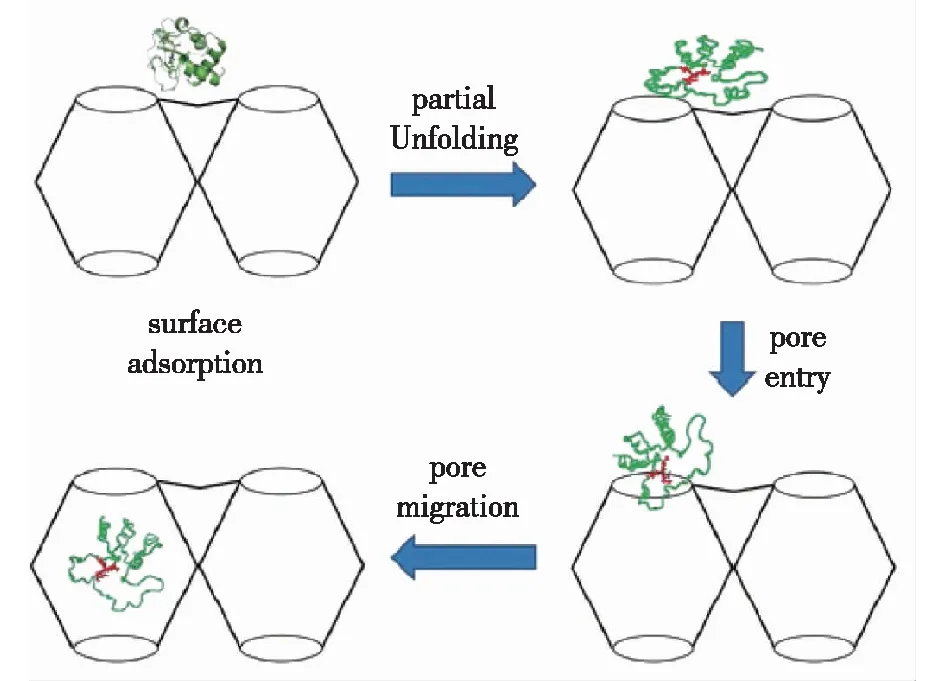
图2 细胞色素c向Tb-mesoMOF孔隙扩散的机制[34]Fig.2 Tentative mechanism of Cyt c diffusing into the pores of Tb-mesoMOF[34]
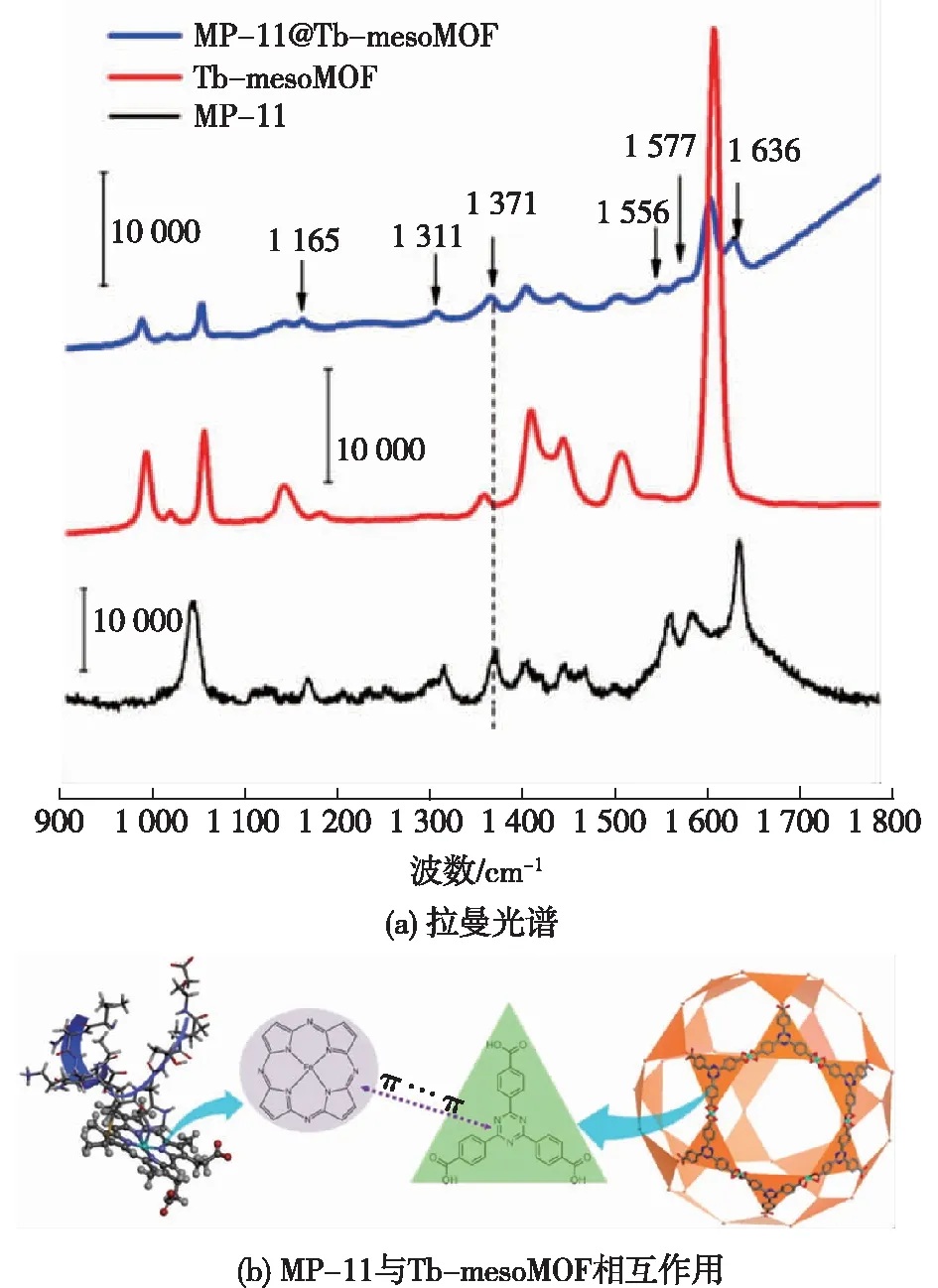
图3 MP-11@Tb-mesoMOF,Tb-mesoMOF和 MP-11的拉曼光谱(a)以及MP-11与 Tb-mesoMOF相互作用的机制(b)[35]Fig.3 Raman spectra of MP-11@Tb-mesoMOF,Tb- mesoMOF and MP-11 (a) and tentative mech- anism for the specific interactions between MP-11 and Tb-mesoMOF (b)[35]
2015年,周宏才教授课题组的Feng等[36]用具有优良水稳定性的MOFs(PCN-332、PCN-333)固定化酶,很好地保持了酶的催化活性并实现较高的重复利用性。随后,Lian等[37]制备了具有3种不同孔径的多级孔道结构PCN-888,通过分步包埋的方法将两种不同尺寸的酶分子葡萄糖氧化酶(GOx)和辣根过氧化氢酶(HRP)分区固定在MOFs的多级孔道中,构建了级联反应的纳米反应器。此外,刘铮教授和戈钧教授团队的Lyu等[8]在2014年首次通过原位包裹法将Cyt c固定在ZIF-8中,解决了MOFs难以固定大尺寸酶分子和酶泄露等问题。
2.3 有机载体材料
有机材料按照其来源可分为天然高分子材料和合成有机材料(包括非多孔有机材料和多孔有机材料),而用于固定化酶研究的有机载体主要是天然高分子材料和共价有机骨架材料两大类。
2.3.1 天然高分子材料
天然高分子材料主要包括海藻酸盐、明胶、壳聚糖、甲壳素、纤维素和淀粉等[23]。这类材料具有来源广泛、成本低廉、生物兼容性好及生物可降解等优点,是用于固定化酶的良好载体材料,可有效改善酶的稳定性和使用效率。其中,海藻酸盐是研究较多的用以固定化酶的天然高分子载体材料。另外,在海藻酸溶液中加入二价阳离子交联剂,如CaCl2溶液,可以制备具有独特性质的水凝胶或微球结构,即常用的海藻酸钙载体。2011年,Wang等[38]为了提高GOx的稳定性和催化率,将葡萄糖氧化酶固定在海藻酸钙和壳聚糖的复合物(CACM)上,研究发现,CACM-GOx在4 ℃储存两个月后仍能保留初始酶活的70.4%,明显高于游离酶的7.5%。
2019年,Yang等[39]将脂肪酶固定在经过化学改性的海藻酸钙载体上,提供了一种可用于油/水双相的催化体系,并具有良好的稳定性和可回收性,循环催化10次仍保持90%初始酶活。
虽然天然高分子在固定化酶上具有生物兼容性良好等优点,但这类材料力学强度通常较低,有时也会由于微生物的侵入而被分解。
2.3.2 共价有机框架材料
共价有机框架材料(COFs),是一类完全由有机单体通过共价键连接而形成的结晶性多孔材料,近年来在材料研究领域迅速发展起来[7,40-43]。COFs材料不仅有着与MOFs类似的可用于固定化酶的良好性质,如结构可调性、高孔隙率和高比表面积等,还具有密度低、结构稳定和生物兼容性好等优点,是一类在固定化酶领域具有巨大应用潜力的新型材料。
2015年Banerjee课题组的Kandambeth等[44]将胰蛋白酶固定在具有介孔结构的COF-Dha-Tab上,负载量达到15.5 μmol/g,固定化后可保持游离酶活的60%,这是首次将酶固定在COFs材料上,为开发新型固定化酶载体提供了新的思路。2018年,马胜前教授课题组的Sun等[45]将脂肪酶(PS)吸附固定在COFs材料中,研究发现PS@COFs的稳定性和催化活性远高于其他类型的多孔材料,如MCM-41和PCN-128(图4),这是由于COFs独特的介孔结构和表面化学的可调节性使其具有更好的亲和力和生物相容性,为酶发挥催化性能提供了适宜的孔道微环境。2018年,笔者所在课题组的Zhang等[46]通过共价连接法将溶菌酶固定在COFs中,用于手性分子的高效分离,酶负载量达到22 μmol/g,且无泄露。有趣的是,酶分子的两亲性能在其固定化后制备的手性拆分柱中被继承,因而此新型手性分离柱可兼容正相和反相高效液相色谱(HPLC)(图5)。
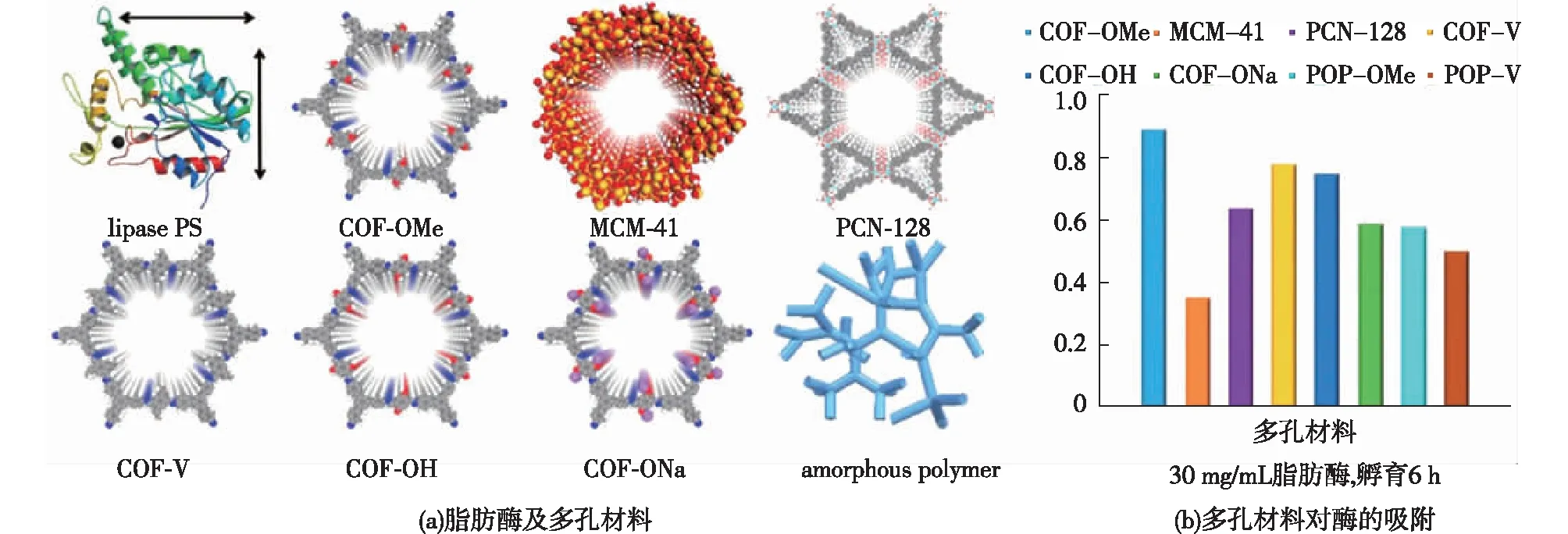
图4 脂肪酶及用于固定酶的多孔材料(a)和多孔材料对脂肪酶吸附(b)[45]Fig.4 Graphic view of lipase PS and porous materials used for the immobilization of enzymes (a)and enzyme uptake capacity of various porous materials after incubation in lipase PS solution (30 mg/mL for 6 h) (b)[45]
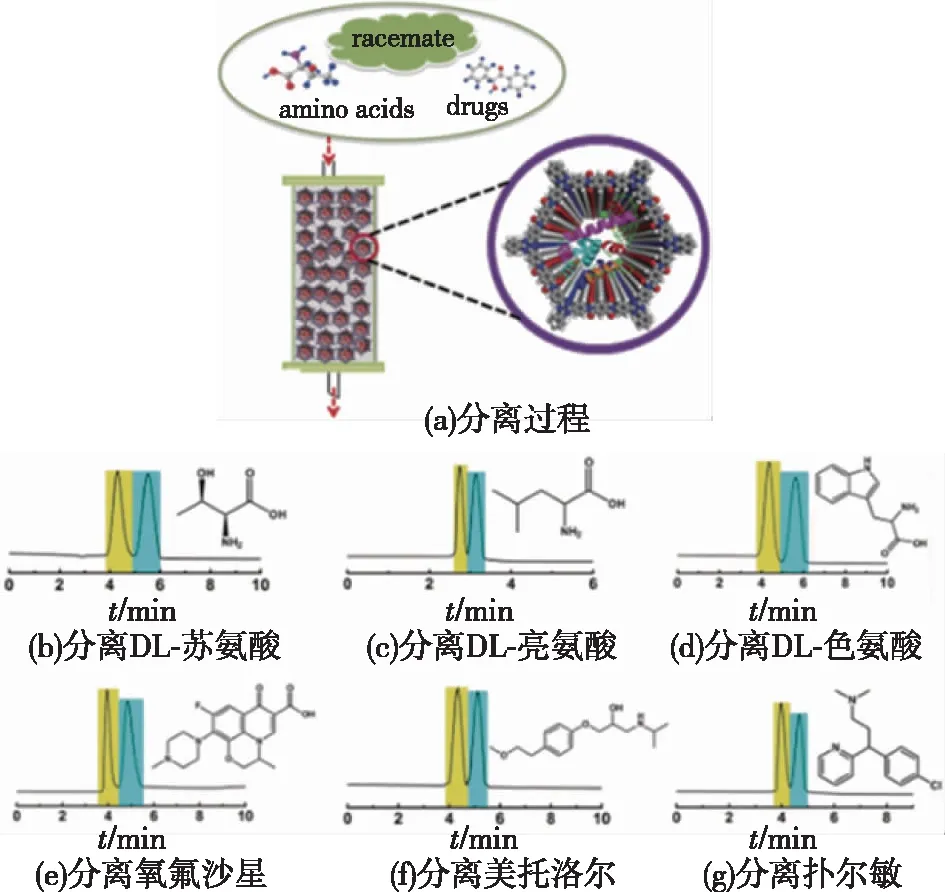
图5 Lysozyme ⊂ COF 1作为手性固定相及用于 手性分离对映体的分离效果[46]Fig.5 Illustration of lysozyme⊂COF 1 based CSPs for chiral separation[46]
3 固定化酶的应用
自1916年固定化酶技术首次应用以来[5],科研工作者通过不断探究和改进固定化载体和策略,大大提高了酶的操作稳定性、回收和重复利用性,使其在生物催化、生物传感等领域得到了广泛的应用。
3.1 生物催化
随着酶学理论的不断深入及“酶工程”的崛起,生物催化在化学、食品和医药等领域得到日益广泛的应用。酶在温和条件下工作时具有较高的化学选择性、立体选择性和区域选择性[47]。然而,游离酶的耐酸碱度范围窄、热稳定性差及对有机溶剂的耐受性差等缺点限制了其工业化应用。固定化酶技术的出现和发展不断拓宽了酶的应用范围。Rafiei等[48]将脂肪酶包埋在微孔沸石咪唑酯骨架材料(ZIF-67)中,构建一种新的生物催化剂lipase@ZIF-67,成功地催化了大豆油与生物柴油的酯交换反应,并且在循环催化6次后,酶活无明显降低。Hu等[49]将脂肪酶固定在经聚二甲基硅氧烷(PDMS)修饰过的疏水UiO-66-PDMS材料中,并用于催化生产生物柴油,研究发现,固定化脂肪酶处理24 h时,生物柴油产率可达88%,连续操作10次后酶活性仍保持83%。
3.2 生物传感
生物传感是将DNA、抗体或酶通过共价结合、吸附或包封等方法固定在特定的材料上,开发出灵敏的生物传感器和生物检测方法[50]。固定化酶用于生物传感可以快速灵敏和具有选择性地分析目标分子,因而成为检测各种生物和化学成分的重要工具,在医疗诊断、食品的毒素检测、制药、环境监测以及农业等方面具有重要应用价值。1962年,Clark等[51]用GOx设计生物传感器,用于葡萄糖的检测,首次实现生物传感的应用。经过60多年的研究,生物传感在灵敏度和检测范围上得到很大的进步和提高。2015年,Patra等[52]用一种生物相容性、电化学性质良好的纳米复合材料MIL-100(Fe)-Pt来固定GOx,制备了用于检测葡萄糖的新型生物传感器,在很短的响应时间(<5 s)内,其检测限可达5 μmol/L。
3.3 生物分离
天然酶不仅具有手性结构单元,还具有特异性相互作用的特点,而一些多孔材料(如MOFs、COFs)具有特定的孔道尺寸和孔道环境,且可以很好地固定化酶,提高其稳定性。将两者结合起来所得的复合材料,使得酶分子在分离方面也具有巨大的应用潜力。2018年,Ren等[53]利用聚乙烯亚胺(PEI)、MOFs、漆酶和聚多巴胺(PDA)对工业用聚丙烯腈(PAN)超滤膜的分离层和支撑层进行“三维改性”,制备了一种高渗透、高效且稳定的生物催化膜,用于去除水中的微污染物;进一步研究发现,LacPAN-MIL-101-L生物催化膜具有良好的渗透性和去除微污染性能。同年,笔者所在课题组的Zhang等[46]将具有手性结构的溶菌酶通过共价键固定在COFs材料(COF-1)上,得到的复合材料作为手性固定相,用于HPLC中外消旋化合物的分离,研究发现:该手性固定相可用于正相、反相和极性有机相HPLC中,对多种外消旋体均表现出较高的手性分离效率,并且具有很好的重现性和重复利用性(图5)。
4 总结与展望
随着酶的工业化发展,人们对于获得操作稳定性好、应用条件宽、易于回收利用的固定化酶技术的需求越来越大,对固定化策略和固定化载体的探索和创新也越来越迫切。虽然近年来在固定化策略和载体材料发展上取得了很大的突破,酶的可操作性和回收利用性得到很大提高,但也存在一些不足:如,固定化过程影响酶的结构,导致活性下降、酶的泄露、传质受阻、载体结构坍塌、固定化过程复杂、载体改性成本高等问题。未来仍需不断探索新的固定化策略和载体,并将不同的策略和载体材料结合起来解决当前固定化酶技术中的问题。其中,MOFs和COFs材料的改性、联用将会成为固定化酶载体的研究热点,同时也会利用新的技术,创新性地从分子结构、构象变化等方面深入探究酶与载体材料之间的作用机制,为进一步优化固定化酶技术提供理论指导。
