微生物合成丙二酰辅酶A衍生物的代谢工程
2020-03-12王凯峰纪晓俊
王凯峰,丁 颖,纪晓俊
(南京工业大学生物与制药工程学院,江苏南京211800)
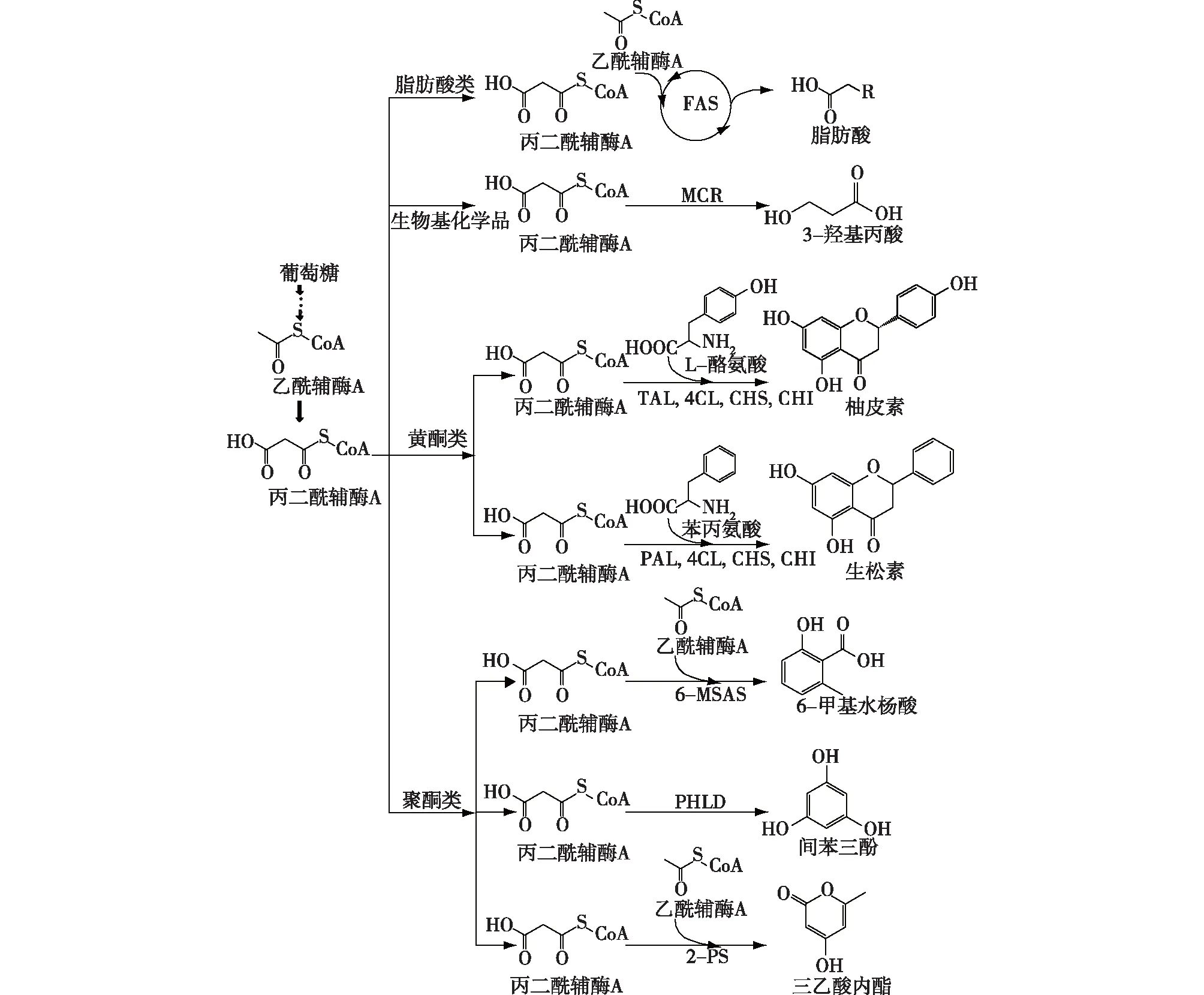
FAS—脂肪酸合成酶;MCR—丙二酰辅酶A还原酶;TAL—酪氨酸氨裂解酶;4CL—4-香豆酸酯辅酶 A连接酶;CHS—查尔酮合酶;CHI—查尔酮异构酶;PAL—苯丙氨酸氨裂解酶;6-MSAS—6-甲基水杨酸合成酶;PHLD—Ⅲ型聚酮化合物合酶;2-PS—2-吡喃酮合酶图1 丙二酰辅酶A衍生物的合成途径Fig.1 Synthetic pathways of malonyl-CoA derivatives
绿色生物制造利用可再生的生物质资源为原料,将其绿色转化为具有更高附加值的生物基产品,是一种新型的工业可持续发展的模式,微生物作为其中重要的角色,对可再生资源的催化转化能力一直是制约绿色生物制造发展的关键因素[1]。随着代谢工程技术的不断发展,人工构建的微生物细胞工厂在绿色生物制造中发挥了重要作用。通过在微生物细胞中重构目标化合物的代谢途径,可以实现利用可再生的生物质原料合成多种高附加值化合物,如燃料、药物、食品和化学品等[2-4]。
在众多的生物制造产品体系中,以微生物胞内的丙二酰辅酶A(malonyl-CoA)为前体的衍生物已经成为当前的研究热点(图1)。在微生物中,乙酰辅酶A在乙酰辅酶A羧化酶(ACC)的催化下转化为丙二酰辅酶A,而丙二酰辅酶A作为一种关键的代谢中间体,对于微生物而言至关重要,主要表现为能够维持细胞膜的完整以及细胞能量代谢的平衡[5]。丙二酰辅酶A衍生物是以丙二酰辅酶A为前体衍生而来,主要包括脂肪酸类化合物、生物基化学品和植物源黄酮及聚酮类天然产物等。脂肪酸类化合物除了可用于生产润滑剂、表面活性剂等工业产品外[6],还可应用于化妆品、医药等行业[7]。此外,由于脂肪酸类化合物具有吸湿性低、能量密度高、能与石油基燃料混溶等特点[8],有望替代传统化石燃料,解决全球化石燃料枯竭的问题。以3-羟基丙酸为代表的丙二酰辅酶A衍生物可以作为一种应用广泛的生物基化学品生产多种化工产品,如丙二酸、丙烯酸、1,3-丙二醇和生物可降解聚合物聚3-羟基丙酸(P[3-HP])[9]。另一类丙二酰辅酶A衍生物为植物源天然产物,包括黄酮类和聚酮类化合物。黄酮类化合物具有抗炎、清除有害活性氧、抗细胞毒性、抗肿瘤活性等功效,广泛应用于医药行业[10-14]。聚酮类化合物具有抗肿瘤生物学活性以及抑制细胞生长、抗寄生虫和免疫抑制等特性,亦有重要的医药价值[15]。
目前,上述丙二酰辅酶A衍生物主要是通过化学法和植物提取法生产。化学法依赖于石油为原料,具有不可持续性。如3-羟基丙酸由石油来源的3-羟基丙腈通过化学反应生成,不仅原料来源受限,而且催化反应过程具有高毒性、高成本等不利因素[16]。而脂肪酸类化合物主要从油料植物中提取获得,黄酮类和聚酮类化合物也主要依赖各种稀有植物资源。植物提取法不仅目标产物含量低,而且提取工艺复杂、受季节因素影响较大。为了应对上述两种常规生产方法过程中存在的问题,人们试图利用代谢工程的手段构建微生物细胞工厂,以其胞内丙二酰辅酶A为前体合成这些丙二酰辅酶A衍生物。在微生物中,乙酰辅酶A在ACC的催化下转化为丙二酰辅酶A,然后在脂肪酸合成酶(FAS)的作用下合成系列脂肪酸[8]。其中,丙二酰辅酶A作为脂肪酸合成的限速底物,对于维持细胞膜的完整性和细胞能量代谢至关重要[5]。但丙二酰辅酶A的细胞内浓度始终处于较低水平,这就为在微生物中构建非天然的丙二酰辅酶A衍生物的代谢途径带来了障碍。因此,如何有效提高胞内丙二酰辅酶A含量并使其精确导向目标代谢产物显得尤为重要。
目前,为了提高丙二酰辅酶A衍生物的合成而改善胞内丙二酰辅酶A积累的代谢工程策略主要包括:强化丙二酰辅酶A的供应,降低丙二酰辅酶A的消耗以及基于生物传感器自动调节丙二酰辅酶A生成和消耗的精细调控。
1 强化丙二酰辅酶A的供应
ACC是催化乙酰辅酶A生成丙二酰辅酶A的关键酶,其催化的反应是微生物中丙二酰辅酶A衍生物合成的限速步骤。ACC是一种多结构域酶,包含生物素羧化酶(BC)域、羧基转移酶(CT)域和生物素羧基载体蛋白(BCCP)域。真核生物的ACC还包含2个非催化区域:中央结构域(CD)和BC-CT相互作用结构域(BT)[17]。目前,强化丙二酰辅酶A供应的主要手段是过表达ACC和突变ACC以增加其酶活(图2)。

图2 强化丙二酰辅酶A供应和降低丙二酰辅酶A 消耗关键代谢途径Fig.2 Key metabolic pathway for strengthening the malonyl-CoA supply and reducing the compe- titive malonyl-CoA branch consumption
1.1 过表达乙酰辅酶A羧化酶
最常见的基因过表达手段包括利用强启动子表达目的基因以及增加目的基因的拷贝数两种。针对合成丙二酰辅酶A的限速酶ACC,过表达能够推动乙酰辅酶A生成丙二酰辅酶A,有利于丙二酰辅酶A衍生物的生产。Davis等[18]在低拷贝质粒中利用 T7启动子过表达大肠杆菌ACC的4个亚基,使丙二酰辅酶A的含量相比于原始菌提高了100倍,目标产物游离脂肪酸也提高了6倍。Wattanachaisaereekul等[19]在酿酒酵母中,用相对较强的启动子TEF1代替天然ACC的启动子,使聚酮化合物6-甲基水杨酸(6-MSA)的产量增加了60%。
除了上述模式微生物外,解脂耶氏酵母作为一种非常规的产油酵母,具有独特的柠檬酸穿梭途径,因而胞内具有很高的乙酰辅酶A含量。Tai等[20]为了提高解脂耶氏酵母中脂质含量,利用强启动子hp4d控制ACC编码基因,以推动脂肪酸合成的第一步,使脂质含量提高了2倍。过表达解脂耶氏酵母自身ACC还有利于生产聚酮化合物——三乙酸内酯[21-22]。Markham等[21]在解脂耶氏酵母中首次鉴定解脂耶氏酵母丙酮酸旁路途径可提高三乙酸内酯产量,在TEF启动子中插入16个UAS1B序列构建强启动子UAS1B16-TEF来过表达丙酮酸脱羧酶(PDC)、乙醛脱氢酶(ALD)、乙酰辅酶A合成酶(ACS)以及ACC,使三乙酸内酯产量提高64.7%。
Liu等[22]在解脂耶氏酵母中表达能够转化乙酰辅酶A和丙二酰辅酶A合成三乙酸内酯的Ⅲ型聚酮化合物合酶(2-PS),该酶表达后能够生成0.5 g/L的三乙酸内酯。为了进一步强化丙二酰辅酶A供应以提高三乙酸内酯产量,他们使用TEFin强启动子过表达自身的ACC,使三乙酸内酯产量提高至0.66 g/L。
除了过表达微生物自身的ACC外,表达异源的ACC也能提高胞内丙二酰辅酶A含量。Zha等[23]在大肠杆菌中利用高拷贝数质粒和T7启动子过表达谷氨酸棒杆菌来源的ACC的2个亚基,使胞内丙二酰辅酶A浓度增加了3倍,丙二酰辅酶A衍生物间苯三酚浓度也因此提高了2.7倍,有趣的是,他们发现过表达大肠杆菌自身的ACC并不能提高间苯三酚的产量。
1.2 突变乙酰辅酶A羧化酶
尽管在一些微生物胞内过表达ACC有利于各种丙二酰辅酶A衍生物的合成,但研究发现过表达天然ACC,其活性增加并不明显,这是因为ACC的转录和翻译在胞内受到严格调控[24-25]。例如,酿酒酵母中ACC会受到转录激活因子Ino2和Ino4以及负调控因子Opi1的调控[26],另外还受到蛋白激酶Snf1的负调控。Snf1在葡萄糖(<0.5 g/L)的限制条件下会使ACC磷酸化,从而降低酶活[27]。
Feng等[28]试图敲除酿酒酵母的Snf1来解除对ACC的抑制,敲除后发现目标产物1-十六烷醇的产量没有提高,但是在Δsnf1菌株中过表达ACC使1-十六烷醇产量提高了50%。这是因为Snf1除了调节ACC以外,还是碳代谢、β氧化和应激反应的关键调控因子[29]。敲除Snf1会引起细胞代谢失衡而无法提高丙二酰辅酶A衍生物的产量。
突变ACC的磷酸化位点可以解除Snf1对其的抑制,从而提高ACC的酶活。Li等[30]发现过表达ACC并不能显著提高酿酒酵母脂肪酸产量,他们利用靶向性实验方法(MIDAS)[31]鉴定了蛋白数据库中ACC的14个磷酸化位点,并指出通过突变这些磷酸化位点来解除Snf1对ACC的抑制具备一定的可行性。
Choi等[32]将Rattusnorvegicus(rat)与酿酒酵母的ACC比对分析发现,1 157位的Ser(丝氨酸)是新的磷酸化位点。因此,将其突变为Ala(丙氨酸)后提高了ACC的酶活,并有利于丙二酰辅酶A的衍生物6-甲基水杨酸和脂肪酸的合成。
Shi等[24]在酿酒酵母中通过比对ACC的磷酸化识别基序(Hyd-X-Arg-XX-Ser-XXX-Hyd)鉴定了2个受Snf1调控的磷酸化位点,分别是659位和1 157位的Ser,同时将这2个位点突变为Ala,使得ACC的酶活增加了3倍,并提高了2种丙二酰辅酶A衍生物脂肪酸乙酯和3-羟基丙酸的产量。
Chen等[33]利用MIDAS进一步推测出ACC可能存在15个磷酸化位点,进一步构建了利用荧光强度响应丙二酰辅酶A浓度的丙二酰辅酶A传感器,以检测每个磷酸化位点突变为Ala后对丙二酰辅酶A浓度的影响,最终预测到新的磷酸化位点686位的Ser。同时将上述3个磷酸化位点突变为Ala后,发现丙二酰辅酶A含量显著提升,并且丙二酰辅酶A衍生物3-羟基丙酸的产量比两位点突变提高更为明显。由于Snf1对ACC磷酸化调控的复杂性,可以预见,未来更多新的磷酸化位点将被发现,同时对其调控机制的进一步挖掘将有利于更好地改造ACC。
2 降低丙二酰辅酶A的消耗
丙二酰辅酶A在微生物胞内的直接去路是在脂肪酸合成酶的催化下生成系列脂肪酸。异源引入的丙二酰辅酶A衍生物合成途径会与脂肪酸合成途径竞争消耗丙二酰辅酶A。因此,降低脂肪酸合成将有利于生产非脂肪酸类的丙二酰辅酶A衍生物。目前,铜绿素、三氯生和浅蓝菌素等化学物质已经被证明能够有效抑制微生物体内的脂肪酸合成[18,34],但这些化合物成本高、细胞毒性强等因素限制了其在工业化生产中的应用[18]。
为了通过基因工程手段在大肠杆菌中抑制脂肪酸合成,Carbonell等[35]敲除了脂肪酸合成酶的关键基因fabf(编码3-氧酰基-(酰基载体蛋白)合酶Ⅱ)。在引入苯丙氨酸氨裂解酶(PAL)、查尔酮合酶(CHS)、查尔酮异构酶(CHI)和4-香豆酸酯辅酶A连接酶(4CL)的基础上,菌株能够利用L-苯丙氨酸和丙二酰辅酶A合成88 mg/L的黄酮类化合物生松素。
在微生物中,天然的脂肪酸属于直链脂肪酸。在生产支链脂肪酸时,天然的脂肪酸竞争消耗了丙二酰辅酶A。2种脂肪酸的合成都需要fabh(编码β-酮酰基-ACP合酶Ⅲ),它负责催化丙二酰基-ACP和短链酰基辅酶A之间的初始缩合反应,Jiang等[36]通过敲除大肠杆菌自身的fabh,导入来自金黄色葡萄球菌中对支链酰基辅酶A有特异性的safabh,使更多的丙二酰辅酶A流向支链脂肪酸的合成,最终支链脂肪酸产量提高了81倍。
然而,完全敲除脂肪酸合成基因对于微生物细胞生长来说是致命的,而抑制脂肪酸合成基因既可以降低丙二酰辅酶A的消耗,又能缓解对细胞带来的损伤。所以通过抑制脂肪酸合成基因能够平衡丙二酰辅酶A衍生物合成和细胞生长,更有利于积累丙二酰辅酶A衍生物(图2)。
转录激活因子Ino2负责激活参与磷脂生物合成相关基因(acc、fas1和fas2)的转录。Chen等[37]敲除酿酒酵母ino2以降低丙二酰辅酶A的消耗,从而使3-羟基丙酸产量提高18倍。然而敲除ino2会使脂肪酸过度减少进而影响磷脂合成,使细胞生长受到严重抑制。为了缓解细胞生长,针对ino2基因的激活域和DNA结合域进行了改造,试图筛选较低活性的Ino2,使其对脂肪酸合成途径的转录激活效果降低,适当地减少对丙二酰辅酶A流向脂肪酸的合成,平衡分配丙二酰辅酶A用于细胞生长与产物合成。
此外,人工构建的基因抑制工具也被用于抑制脂肪酸合成途径。反义RNA可通过与靶mRNA互补结合来破坏mRNA的翻译并加快其降解,因此被广泛用作基因抑制工具。在大肠杆菌中利用反义RNA抑制脂肪酸合成基因fabd(编码丙二酰辅酶A:ACP转酰酶)能使丙二酰辅酶A 的含量提高4.5倍。同样地抑制其他脂肪酸合成基因fabh、fabf(编码β-酮酰基-ACP合酶Ⅱ)、fabb(编码β-酮酰基-ACP合酶Ⅰ),均能提高丙二酰辅酶A衍生物4-羟基香豆素的产量[38]。同样,Wu等[39]在大肠杆菌中利用反义RNA抑制fabb和fabf,使得丙二酰辅酶A浓度增加了8.8倍,(2S)-柚皮素最终质量浓度提高了431%,达到了391 mg/L。
除了反义RNA外,另一种是基于分子伴侣Hfq和支架MicC的基因抑制工具Hfq-MicC。MicC支架包含可以与特定mRNA结合的反义RNA以及与Hfq结合的部分。Hfq作用是促进反义RNA和靶mRNA结合、促进RNA酶水解mRNA以及保护反义RNA不被水解。
Sun等[40]在蓝细菌中利用Hfq-MicC抑制fabh、fabf和fabd3个脂肪酸合成基因,使胞内丙二酰辅酶A含量提高了41%。吕永坤[41]选择解脂耶氏酵母,基于CRISPRi技术,利用诱导型启动子控制sgRNA的表达来靶向脂肪酸合成基因fas1和fas2,最终有效抑制了脂肪酸合成,从而提高了黄酮类化合物黄衫素的产量。
3 细胞内丙二酰辅酶A含量的精细调控
微生物胞内过量的丙二酰辅酶A虽然有利于其衍生物的合成,但也会损害其细胞生长[19],因此,需要开发一种精细控制胞内丙二酰辅酶A含量的方法。2种丙二酰辅酶A 生物传感器先后被开发用于监测胞内丙二酰辅酶A含量,并使其在一定范围内可调被用来精细调控丙二酰辅酶A。
最常见的丙二酰辅酶A 生物传感器是基于天然脂肪酸生物合成转录水平的调控而设计,这种转录调控存在于很多革兰氏阳性菌中,如枯草芽孢杆菌、金黄色葡萄球菌等[42-43]。该传感器由脂肪酸合成的操纵子上的顺式调控元件fapO和FapR转录阻遏物模块组成。FapR会以蛋白质-DNA作用与启动子fapO区域结合,从而形成FapR-fapO复合物,该复合物在空间上阻碍RNA聚合酶从而阻止下游脂肪酸合成基因的转录。而丙二酰辅酶A会以代谢物-蛋白质作用与FapR结合以削弱FapR-fapO的作用,减少对RNA聚合酶的阻遏[34,44-45]。
Liu等[46]利用这一原理设计了一个利用负反馈调节丙二酰辅酶A相关途径基因表达的传感器。高水平的丙二酰辅酶A会解除FapR-fapO抑制促进lacI表达,从而关闭ACC的表达;相反,低水平的丙二酰辅酶A会使 ACC持续表达以补充丙二酰辅酶A,以此实现细胞内自动监管丙二酰辅酶A的合成(图3(a))。最终脂肪酸浓度和生产速率分别提高了34%和33%。
与T7启动子不同,GAP启动子会被FapR激活。根据此原理,Xu等[45]设计了丙二酰辅酶A双响应启动子传感器,它利用GAP和T7启动子动态调节胞内丙二酰辅酶A的合成和消耗。当体内丙二酰辅酶A含量低时,FapR激活GAP启动子并且与fapO结合,抑制T7启动子的转录,即激活ACC启动丙二酰辅酶A 的合成,同时抑制FAS阻止丙二酰辅酶A合成脂肪酸,使丙二酰辅酶A逐步积累。相反,高水平的丙二酰辅酶A会与FapR结合抑制上述调节,即关闭丙二酰辅酶A的合成,同时开启丙二酰辅酶A合成脂肪酸(图3(b))。最终,丙二酰辅酶A的浓度会呈现出振荡状态,即积累至上限浓度时会被及时消耗,消耗到下限浓度时又会重新启动积累,避免了丙二酰辅酶A的过度累积而影响细胞的代谢平衡。最终改造后的大肠杆菌脂肪酸产量提高了15.7倍。
在酿酒酵母中,David等[47]在启动子TEF1碱基序列中插入FapR结合位点,将其改造为能够响应丙二酰辅酶A浓度的启动子并启动来自Chloroflexusaurantiacus中合成3-羟基丙酸的关键基因mcrCa(编码丙二酰-CoA还原酶),同时利用葡萄糖响应型启动子HXT1启动脂肪酸合成酶FAS1,双节点控制丙二酰辅酶A流向3-羟基丙酸和脂肪酸的合成,最终实现了工程菌株生产与生长平衡,3-羟基丙酸产量提高了10倍,达到1.0 g/L。
此外,丙二酰辅酶A生物传感器还被设计成能够通过结合荧光报告基因来检测细胞内的丙二酰辅酶A浓度,进而可作为一个筛选高丙二酰辅酶A生产菌的工具。Li等[48]将该生物传感器和携带全基因组过表达盒的质粒转化酿酒酵母构建全基因组的过表达文库。通过三轮荧光激活的细胞分选,鉴定出具有最高荧光强度的转化菌落,并鉴定出2个影响丙二酰辅酶A含量的靶标——pmp1(编码质膜蛋白脂)和tpi1(编码磷酸三糖异构酶)。最终,过表达靶基因tpi1后,3-羟基丙酸的产量提高了20%。Ferreira等[49]在酿酒酵母中将基于CRISPR/dCas9的gRNA文库与丙二酰辅酶A传感器结合起来,经过多轮荧光激活的细胞分选和文库测序后,最终筛选出能显著提高丙二酰辅酶A产量的gRNA,这将指导代谢工程改造酿酒酵母以提高3-羟基丙酸产量。
最近,Yang等[50]开发了另一种不同的丙二酰辅酶A传感器,利用一种Ⅲ型聚酮化合物合酶RPPA,催化丙二酰辅酶A生成红色产物丙二醛辅酶A,红色物质可以间接反映出丙二酰辅酶A浓度。利用该丙二酰辅酶A传感器和全基因组sRNA抑制文库筛选出了高丙二酰辅酶A的大肠杆菌用于生产6-甲基水杨酸、柚皮素等丙二酰辅酶A衍生物[51]。

图3 基于生物传感器精细调控微生物胞内 丙二酰辅酶A含量[52]Fig.3 Fine-turning the intracellular malonyl-CoA content based on the biosensor[52]
除了以上综述的针对丙二酰辅酶A及不同的衍生物的改造策略以提高其产量外,还有利用乙酰辅酶A的研究,因它为是除丙二酰辅酶A之外另一重要的前体。过表达过氧化物酶体基质蛋白PEX10增强β氧化[21,52]、表达丙酮酸脱氢酶(PDH)催化丙酮酸氧化脱羧为乙酰辅酶A[22]能够强化乙酰辅酶A的供应,均有利于生产三乙酸内酯。本文总结了现有提高丙二酰辅酶A衍生物合成的代谢工程策略(表1)。
4 结论与展望
利用微生物合成丙二酰辅酶A衍生物包括脂肪酸类化合物、生物基化学品、黄酮及聚酮类化合物等有着独特的优势,不仅原料再生,而且过程绿色。为了进一步提高微生物合成这些丙二酰辅酶A衍生物的产量,除了文中所述精准控制丙二酰辅酶A含量的代谢工程操作外,还要根据不同的衍生产物对后续的人工代谢途径进行合理设计及改造。然而,目前人们对微生物胞内丙二酰辅酶A含量精准控制的代谢工程操作策略主要是通过抑制或激活特定酶和代谢途径,这势必会导致代谢网络不平衡。因此,为了平衡细胞自身代谢与产物合成,可以通过建立细胞对产物的自动调节系统来维持代谢系统的稳态。为了实现这一目标,基于丙二酰辅酶A传感器控制的动态调控策略可以很好地平衡丙二酰辅酶A的相关代谢。另外,利用丙二酰辅酶A传感器检测丙二酰辅酶A的浓度,结合适应性进化、CRISPR/dCas9技术和基因转座技术等可在全基因组规模筛选胞内影响丙二酰辅酶A含量的基因靶标,以构建合成丙二酰辅酶A衍生物的优良宿主。可以相信,随着代谢工程操作方法发展,结合高通量的筛选方法鉴定的新靶标基因可以促进丙二酰辅酶A精准导向目标产物,这将有助于推动广泛应用于能源、化工和医药等领域的丙二酰辅酶A衍生物的高效微生物合成,加快绿色生物制造的快速发展。

表1 微生物合成丙二酰辅酶A衍生物的代谢工程策略
