完全性肺静脉异位引流患儿的ARHGEF16基因突变筛查及突变功能分析
2020-03-12金理辉
王 静,金理辉,张 琪,孙 锟,于 昱
上海交通大学医学院附属新华医院小儿心血管科,心血管发育与再生医学研究所,上海200092
完全性肺静脉异位引流(total anomalous pulmonary venous connection, TAPVC)是一类罕见的先天性心脏病,占先天性心脏病发病的1.5%~3%;在活产婴儿中,其发病率为1/15 000[1-2]。目前,TAPVC按病理解剖分型分为心上型、心内型、心下型及混合型。TAPVC临床表现较为严重,患儿出现紫绀、心脏杂音,常伴呼吸衰竭和心力衰竭等严重的症状而需要早期手术治疗;如不早期手术,80%的患儿2岁内会死亡[3-4]。心脏超声往往可以明确诊断及分型。目前,关于TAPVC的基因学研究报道较少,主要通过散发病例进行生物信息学测序分析筛选候选致病基因,且先天性心脏病由多基因导致,病因复杂,其发病机制尚未阐明。因而,收集大量TAPVC样本进行生物学分析并研究其发病机制,对于该病的诊断及预防具有重大的临床意义。
Nash等[5]通过全基因组测序方法分析2例TAPVC患者,发现视黄醇结合蛋白 5(retinol binding protein 5,RBP 5)基因存在突变。另有研究[6]通过全基因组测序方法检测6例TAPVC 患者及81名对照,发现激活素受体酶 1(activin receptor like kinase 1,ACVRL1) 及肌三角(sarcoglycan delta,SGCD) 2个基因存在突变,并在另外12 例TAPVC 患者中验证了这些突变。截止到目前,TAPVC 相关的高通量测序研究仍然很少,其原因与该病发病率较低使得样本收集较为困难,且该病有着较高的致死率使得早期临床诊断相对困难等有关。
2014—2019年,我们收集了78 例散发TAPVC 病例和100 例正常健康儿童血液样本及完整的临床资料。血液样本通过抽提出 DNA 进行全外显子测序(whole exome sequencing,WES)以检测其可能的致病基因和突变位点。WES是利用序列捕获技术将全基因组外显子区域DNA捕捉并富集后进行高通量测序的基因组分析方法,是一种选择基因组的编码序列的高效策略,对研究已知基因的单核苷酸多态性(single nucleotide polymorphism,SNP)、Indel等具有较大的优势。为了明确TAPVC的致病基因,我们通过SNP-based 关联分析和 Gene-based 负荷分析等生物信息学手段对 WES 的数据进行分析处理,最后初步筛选得到候选基因Rho鸟嘌呤核苷酸交换因子16(ARHGEF16)。ARHGEF16突变位点包括 c.C236>T(A79V)和 c.G619>C(G207R)。ARHGEF16编码的蛋白功能尚不明确,其参与蛋白质-蛋白质和蛋白质-脂质的相互作用;可刺激RHOG相关GDP与GTP的交换,介导EPHA2激活RAC1而在趋化细胞迁移中发挥作用,也可以通过病毒蛋白HPV16 E6.1激活CDC42并介导CDC42的激活[7-8]。本研究主要根据WES进行生物信息学分析[9],进一步对候选基因ARHGEF16在细胞中的突变功能进行分析,并探讨其可能调控的下游靶基因,以期为阐明TAPVC发病遗传分子机制提供理论依据。
1 对象与方法
1.1 研究对象
收集在上海交通大学医学院附属新华医院及儿童医学中心通过心脏彩色超声、心导管、腹部超声、CT或手术记录确诊为TAPVC的患儿血液标本(病例组),同时收集与病例组年龄和性别相匹配的健康儿童血液作为对照组。2014—2019年获得病例组血浆 210 例,对照组血浆150 例。已完成生物样本采集和流行病资料收集。研究获得医院伦理委员会审批,伦理审查编号为XHEC-C-2017-KJB-003。
1.2 方法
1.2.1 TAPVC 可能致病基因的生物信息学分析 对78例
TAPVC患儿和100名正常对照儿童WES数据进行基于致病基因和致病SNP的关联分析,获得TAPVC的可能致病的候选基因ARHGEF16。在新增的100 例患儿中作更高深度的目标区域靶向捕获测序以进行验证[9](数据未显示)。
通过人群基因组数据库,参考常见数据库包括1000G、Kaviar、ExAC、 ESP6500等筛选出最小等位基因频率(minor allele frequency,MAF)小于0.01的罕见突变,参考SIFT、PolyPhen-2、Mutation Taster 等数据库筛选出致病可能性高的ARHGEF16的突变位点C236T和G619C。随后,评估变异在核苷酸或氨基酸水平造成的影响,包括其引起的转录的变化以及对蛋白质功能的影响。
1.2.2ARHGEF16突变位点的Sanger验证 设计人类基因ARHGEF16(NM_014448.4)特异性引物(表1),以入选病例及对照样本DNA为模板,PCR扩增特异性片段,Sanger测序法验证变异位点。

表1 引物序列Tab 1 Primers sequence
1.2.3 质粒构建 GV358-ARHGEF16质粒购于吉凯基因生物公司。以野生型质粒为模板,设计构建突变质粒的引物(表1)。用KOD-Plus-Neo(TOYOBO)酶对模板进行定点突变,得到突变质粒C236T、G619C。突变质粒送华大生物公司进行Sanger测序,测序结果用NCBI BLAST网站与GenBank中ARHGEF16比较,分析突变位置是否正确。
1.2.4 细胞培养与转染 人肾上皮细胞系(293T)购于中国科学院细胞库,在含有10%胎牛血清(MP Biomedicals)和1%青霉素-链霉素混合液(Gibco)的高糖培养基中培养(Hyclone)。培养条件设置为37 ℃,5% CO2。对数生长期时用FuGene转染试剂(Promega)转染空载(GV358)、ARHGEF16野生型质粒(WT)、ARHGEF16突变质粒(C236T、G619C)。转染48 h后用RT-qPCR检测转染效率和mRNA表达量变化。
1.2.5 RT-qPCR 将293T细胞以4×105个/mL的密度接种于6孔板,待细胞融合度达到60%~70%时转染GV358、WT、C236T和 G619C。48 h后用 TRIzol裂解细胞提取RNA。将1 μg RNA用PrimeScript™ RT Master Mix (Takara)反转录为cDNA,RT-qPCR采用15 μL体系,包括cDNA为2 μL,正、反引物各0.3 μL(引物序列见表1),2×SYBR (Takara) 7.5 μL,50×ROX DyeⅡ0.3 μL 及 dd H2O 4.6 μL, 在 AIpplied Biosystems 7500 上进行反应,按照预变性95 ℃ 30 s,PCR反应95 ℃ 5 s、64 ℃ 34 s(40个循环)的条件进行扩增。GAPDH作为内参。使用2-△△CT法对ARHGEF16 mRNA表达量进行相对定量。
1.2.6 蛋白质印迹法(Western blotting) 293T细胞接种于12孔板并分别转染空载、WT-ARHGEF16、C236T和G619C。转染48 h后用RIPA和PMSF裂解细胞,并收集蛋白。用BCA试剂盒(碧云天)测浓度后加蛋白缓冲液100 ℃变性10 min。取30 μg上述变性蛋白样本进行15%SDS-PAGE电泳,电转至硝酸纤维素膜上(Millipore)。脱脂牛奶室温封闭2 h,ARHGEF16的一抗(Proteintech)和anti-GAPDH 4 ℃孵育过夜。分别用山羊抗兔和抗鼠二抗室温孵育2 h,ECL发光试剂盒(Millipore)显影蛋白。
1.2.7 生物信息学方法 利用STRING软件(https://string-db.org/)进行蛋白质-蛋白质相互作用网络分析,通过输入ARHGEF16和已知血管生成、TAPVC等的相关基因,预测ARHGEF16与其他基因编码的蛋白相互作用。用 Cytoscape软件制作网络相互作用图(https://cytoscape.org/),从文献中挑选100个与血管发育、TAPVC等相关的基因编码的蛋白与ARHGEF16进行相互作用分析。
1.3 统计学方法
2 结果
2.1 入选病例信息
入选的2例患儿经超声检查分别确诊为心上型和心内型的TAPVC。入院时已经出现发绀、喂养困难及呼吸衰竭等症状。患儿父母否认有家族性先天性心脏病的病史。Mutation Taster网站预测这2个突变位点均具有致病性,MAF均小于0.05,SIFT评分分别为0.12和0.38(数值越小,引起蛋白质功能改变的可能性越大)。2例患儿具体病例信息如表2所示。
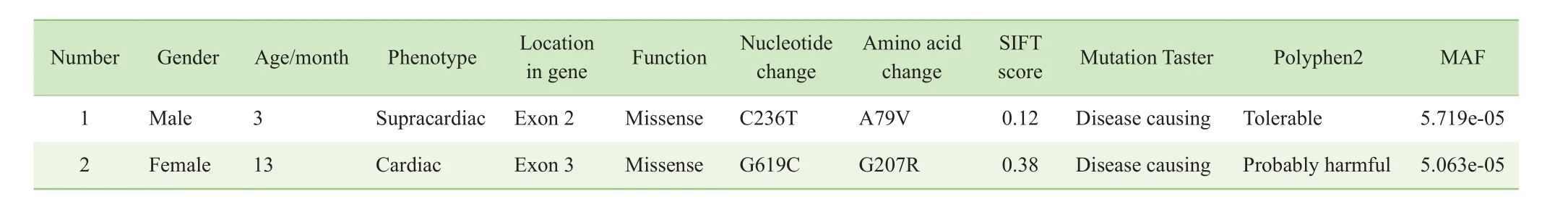
表2 入选TAPVC患儿的临床信息和ARHGEF16突变位点的特征Tab 2 Clinical information and variant characteristics of ARHGEF16 in TAPVC patients
2.2 Sanger测序结果和突变保守性分析
Sanger测序结果显示入选的2例患儿第2、3外显子区c.C236T、c.G619C的改变导致第79位氨基酸从丙氨酸(GCG)变成缬氨酸(GGT),第207位氨基酸从甘氨酸变成精氨酸,且这2个杂合突变位点在正常对照组中未发现(图 1)。

图1 病例组及对照组儿童的ARHGEF16测序峰图Fig 1 Sequence chromatograms of ARHGEF16 missense variants in patients and controls
另外,我们发现这2个突变位点在人类、豚尾猴、褐家鼠等脊椎动物中具有共同的保守序列,表明这2个位点具有重要的作用,其突变可能导致ARHGEF16功能的改变(图2)。

图2 ARHGEF16在不同物种之间的编码蛋白质序列Fig 2 Conservation of ARHGEF16 variants among different species
2.3 ARHGEF16 mRNA和蛋白表达量分析
通过RT-qPCR分析WT、突变型C236T和G619C组ARHGEF16 mRNA表达量差异。结果如图3A所示,较WT组相比,C236T和G619C组ARHGEF16 mRNA表达量显著上调(P=0.001)。Western blotting结果显示,与WT组相比,C236T和G619C组ARHGEF16蛋白表达量上调显著(P=0.002,P=0.001),其相对表达量分别为WT组的1.9和2.2倍,表明这2个位点的错义突变对蛋白表达量产生影响(图3B)。

图3 ARHGEF16 mRNA和蛋白表达分析(n=3)Fig 3 Analysis of mRNA and protein expression of ARHGEF16 (n=3)
2.4 ARHGEF16与编码血管发育相关基因的蛋白相互作用分析
ARHGEF16位于1号染色体,由15个外显子和14个内含子组成,可以促进人脑胶质瘤细胞的迁移[10-11]。Cytoscape结果显示ARHGEF16与RAC1存在直接关联(图4),可能通过RAC1与其他血管发育类基因相互作用,其中VAV2和KDR是已知的TAPVC可能致病候选基因[9],从而最终在TAPVC的发育形成过程中发挥重要作用。

图 4 ARHGEF16和其他血管类相关基因之间的蛋白相互作用网络图Fig 4 Protein-protein interaction network between ARHGEF16 and other genes with angiogenetic functions
2.5 ARHGEF16过表达对RAC1 mRNA表达量影响
蛋白相互作用分析结果显示,ARHGEF16与RAC1存在直接相互作用。用ARHGEF16质粒转染293T细胞,收集细胞RNA,通过RT-qPCR分析ARHGEF16 对RAC1 mRNA表达调控。结果如图5所示,ARHGEF16过表达时RAC1的表达量上调(P=0.006)。

图5 ARHGEF16过表达对RAC1表达的影响Fig 5 Analysis of RAC1 mRNA expression in HEK293 cells with ARHGEF16 overexpression
3 讨论
TAPVC患儿出生后往往出现青紫、呼吸急促、喂养困难、日益加重的心力衰竭,如不给予治疗,多在3个月左右死亡。然而,TAPVC的发病机制尚不明确,Neill等[12]1960年首次在弯刀综合征中描述了 TAPVC。随后,遗传学研究表明,TAPVC 为常染色体显性遗传,具有不完全外显率及可变表达特性。有研究[13-14]表明,编码血管内皮生长因子受体2的基因(KDR)和编码血小板衍生生长因子受体α(PDGFRA)的基因参与TAPVC的发生。PDGFRA基因在小鼠心系膜中被敲除后,出现 TAPVC的表型,表明基因PDGFRA确实与TAPVC的发生有关[15-16]。此外,从TAPVC 患者分离出的外周血淋巴细胞中发现基因锚链重复域1(ANKRD1)表达量明显增加,提示ANKRD1的过表达也与TAPVC的发生相关。Degenhardt等[17]发现,轴突向导因子3d (Semaphorin 3d,SEMA3D)基因突变小鼠具有TAPVC的表型。
迄今为止,关于TAPVC的基因学研究甚少。我们收集较大样本量——78 例散发TAPVC病例和100例健康儿童,通过抽提全血DNA 进行WES以检测其可能的致病基因和致病突变。通过 SNP-based 关联分析和 Gene-based 负荷分析等生物信息学方法对 WES 的数据进行分析处理,筛选出基因ARHGEF16,其具有2个突变位点(c.C236T:p.A79V和c.G619C:p.G207R)。通过Mutation Taster在线预测发现这2个突变位点均为“致病性”位点;采用Clustalx 软件分析基因序列保守性,结果显示,这2个突变位点的基因序列在人、豚尾猴和褐家鼠等脊椎动物上高度保守,提示这2个突变位点可能具有重要的功能意义。
RT-qPCR和 Western blotting实验结果表明,ARHGEF16(c.C236T和c.G619C)mRNA和蛋白的表达量较野生型均有上调,说明这2个位点的突变影响了ARHGEF16 mRNA及蛋白表达。另外,本研究通过Cytoscape在线分析,发现ARHGEF16与RAC1存在直接关联。
ARHGEF16编码的蛋白质功能尚不明确,研究人员认为它与蛋白质-蛋白质和蛋白质-脂质相互作用有关[7]。有研究[18]表明其参与人神经瘤胶质细胞的增殖和迁移、斑马鱼视神经的再生。RAC1基因编码的蛋白是一种GTP酶,属于小GTP结合蛋白的Ras超家族。这个超家族的成员调节细胞内重要生物学功能,包括细胞生长、细胞骨架重组和蛋白激酶的激活[19]。有研究[20]提出,RAC1作为血管新生的重要因子,在肿瘤的血管生成、心脑血管的稳态等方面发挥重要的作用。Lee等[7]提出,RAC1作为ARHGEF16下游靶基因在促进凋亡细胞的清除方面发挥重要作用。在吞噬细胞中过表达ARHGEF16促进了吞噬细胞吞噬凋亡细胞,而在这个过程中,ARHGEF16可通过RhoG-Elmo-Dock4途径激活RAC1。
ARHGEF16是否可以通过RAC1影响TAPVC等先天性心血管疾病的发生呢?RT-qPCR结果显示在293T细胞中,ARHGEF16过表达会上调RAC1的表达量。然而在心血管发育方面,ARHGEF16对RAC1的具体调控作用需要更多功能实验进行验证。
综上所述,本研究发现错义突变c.C236>T(p.A79V)、c.G619>C(p.G207R)影响ARHGEF16 mRNA和蛋白的表达量;并且ARHGEF16对RAC1表达量的调节,可能会影响心血管发育的异常,进而影响TAPVC的发生。其具体的机制有待进一步研究。本研究可为TAPVC的诊断、治疗与提前干预提供理论指导。
