基于异丁酯化的脂肪酸GC-FID/MS定量分析研究
2020-03-12干渺妍唐惠儒
干渺妍,谢 晖,唐惠儒,
1. 复旦大学生命科学学院,上海 200433;2. 复旦大学人类表型组研究院,上海 201203
脂肪酸是生物体内重要的能量[1-2]和结构物质,可通过代谢转化为三磷酸腺苷为心肌和肝脏等组织提供能量[3],也可用于合成磷脂、激素及酮体等具有生理功能的物质。研究显示,脂肪酸代谢失调会导致炎症[4]、肿瘤[5-6]及心血管疾病[7]等,因此定量分析此类物质随生理及病理生理过程的变化具有重要意义[8-12]。基于脂肪酸所含碳数的不同,其可被分为短链(C1~C6)、中链(C8~C12)和长链(C16~C26)脂肪酸。目前,对其进行同步定量是代谢组学分析及生理与病理生理机制研究中亟待解决的问题。
脂肪酸的定量分析主要包括核磁共振波谱法(nuclear magnetic resonance,NMR)[13-14]、气相色谱 - 氢火焰离子化检测器/质谱联用技术(gas chromatography-f l ame ionization detector/mass spectrometry,GC-FID/MS)[15]及液相色谱 - 质谱联用技术(liquid chromatography-mass spectrometry,LCMS)等[16-17]。其中,GC-FID/MS将气相色谱稳定分离的优势与FID及质谱的高灵敏度检测相结合,成为了脂肪酸的定量分析的一种重要方法。该技术具有良好的重现性和线性动态范围[18],拥有商业化的标准质谱库,可以辅助对未知物的定性。气相色谱分离要求待测物具有良好的挥发性及热稳定性,而脂肪酸由于含有极性官能团羧基且链长不同使得其物理化学性质差异较大,因此常需先对其进行化学衍生化处理。目前,脂肪酸的衍生化方法主要有三甲基硅烷化[19-22]及甲酯化[23-25]。其中,前者常用的试剂是N, O-双三甲基硅基三氟乙酰胺和N-甲基-N-三甲基硅烷基三氟乙酰胺。上述2种试剂极易水解,因此在衍生化前要求样本行干燥处理,同时衍生化过程须在无水条件下进行;而该种操作使样品在前处理时较为繁杂、耗时,且易导致分析对象(即代谢物)发生损失。甲酯化法被广泛用于中长链脂肪酸的定量分析,但这种方法衍生化耗时较长,且应用于短链脂肪酸产生的甲酯化产物易挥发,因此甲酯化法不适合对短、中、长链脂肪酸进行同步定量分析。
针对上述问题,本文利用GC-FID/MS中的FID与质谱同步检测,并通过对脂肪酸进行异丁酯化建立一种简便快速、条件温和且可对水相介质中短、中、长链脂肪酸进行同步定量分析的方法;同时,使用27种脂肪酸对该方法进行验证,并通过将该方法应用于血清、尿液、粪便、肝脏等典型的常见生物样本以验证其基质普适性,从而为生理及病理生理过程中脂肪酸的变化规律及其功能研究提供新的方法。限公司,十二烷酸购自梯希爱(上海)化成工业发展有限公司,4-甲基己酸购自加拿大TRC公司,乙酸购自生工生物工程(上海)股份有限公司。上述脂肪酸样品分别用水配制成已知浓度的标准溶液,并密封贮存待检。
1 材料与方法
1.1 试剂
本实验所用试剂均购自商业化产品来源而未经任何纯化。异丁醇购自上海化学试剂研究所有限公司,色谱纯正己烷购自美国Merck公司,无水硫酸钠购自上海大合化学品有限公司,(-) -氯甲酸薄荷酯、氢氧化钠、吡啶、2, 6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT)、癸酸、十六烷酸、十八烷酸、二十烷酸、芥酸、二十二烷酸、二十四烷酸均购自美国Sigma-Aldrich公司,甲酸、丙酸、异丁酸、新戊酸、丁酸、2-甲基丁酸、异戊酸、戊酸、2-乙基丁酸、异己酸、己酸、庚酸、正辛酸、十四烷酸、亚油酸、油酸、亚麻酸均购自阿拉丁试剂(上海)有
1.2 研究方法
1.2.1 脂肪酸的异丁酯化 本研究采用异丁酯化的方法对标准溶液或生物样本进行衍生化处理,具体操作如下:取100 μL标准溶液于离心管中,加入130 μL氢氧化钠水溶液(20 mmol/L)、50 μL 吡啶和80 μL 异丁醇后涡旋震荡 10 s。加入20 μL (-) -氯甲酸薄荷酯涡旋震荡30 s,放气后再涡旋震荡30 s。再次加入20 μL (-) -氯甲酸薄荷酯,重复上述涡旋震荡步骤。完毕后,向上述衍生化混合物加入150 μL正己烷并涡旋萃取2 min,16 099×g离心5 min。取上清液,经无水硫酸钠干燥后,将其加入气相色谱进样瓶中检测。
1.2.2 GC-FID/MS检测及数据分析 本研究使用配有FID的气相色谱 - 质谱仪(7890B-5977A,美国Agilent Technologies公司)和HP-5MS色谱柱(30 m×250 μm×0.25 μm,美国Agilent J&W公司)对衍生化后的脂肪酸进行分析。采用分流进样(分流比为29:1),进样量为1 μL。进样口温度为280 ℃,载气氦气(纯度>99.999%)的流速为1.0 mL/ min。色谱柱起始温度为40 ℃,保持3 min后以 10 ℃ /min升至145 ℃,以30 ℃ /min升至175 ℃,再以10 ℃ /min升至260 ℃,保持1.5 min,最后以30 ℃ /min的速率升至310 ℃,保持3 min。FID温度为280 ℃,氢气流速为30 mL/min。质谱溶剂延迟时间4.2 min,将质量选择检测器(mass selective detector,MSD)传输管及电子离子化(electron ionization,EI)源温度设为230 ℃,灯丝电压固定为 70 eV。质谱采集采用选择离子扫描模式(selective ion monitoring,SIM),检测碎片离子作为各目标物定性定量离子。使用MassHunter软件(定性分析B.06.00版以及定量分析B.06.00版,美国Agilent Technologies公司)分析上述检测获得的GC-FID/MS数据。所有代谢物根据其保留时间及质谱碎片质荷比分布信息进行定性分析,标准溶液中对提取的定量离子色谱峰进行积分得到定量数据。
1.2.3 方法学验证 本研究使用27种脂肪酸样品建立标准曲线并得到检测限(limit of detection,LOD)及定量限(limit of quantitation,LOQ);使用高浓度、中浓度、低浓度的样品混合溶液测量方法的日间及日内的相对标准偏差(relative standard deviation,RSD)。通过与文献报道结果比较评估方法的灵敏度及稳定性,具体操作如下。
本研究所用的脂肪酸样品的母液由双蒸水及10%异丁醇水溶液配制而成,其中碳数小于6的脂肪酸用双蒸水作为溶剂配制。研究采用逐级稀释法建立标准曲线,将脂肪酸样品的母液稀释1、2、4、10、20、40、100倍后获得的7个浓度梯度标准溶液分别进行衍生化,并依次进行GCFID/MS分析检测。将进样的柱上摩尔数作为横坐标,峰面积作为纵坐标得到标准曲线及其对应的线性范围。LOD及LOQ分别为信噪比等于3和10时的代谢物柱上量。此外,选用稀释1、10及100倍的3个浓度的标准溶液经衍生化后进行日内及日间RSD评估,即将衍生化后的标准溶液置于室温,1 d内每间隔8 h检测1次,计算3次峰面积间的RSD值作为日内RSD评价;标准溶液在3 d内检测3次,计算3次峰面积间的RSD值作为日间RSD评价,且标准溶液在测定间隙需置于4 ℃保存。
1.2.4 普适性分析 将所建方法应用于血清、尿液、粪便、肝脏等生物样本的脂肪酸进行定量分析,以验证该方法在不同生物基质中的普适性。本研究所用血清样本源于健康青少年(13岁~18岁),尿液样本来源于健康成年人(25岁),血清和尿液样本均为已通过伦理审批的代谢组研究生物样本,采集后储存在-80 ℃冰箱;实验前,将样本梯度解冻后可直接进行衍生化处理,通过前述建立的方法对样本中的脂肪酸进行分析。本研究使用的粪便来源于健康婴幼儿(0岁~3岁),粪便样本为已通过伦理审批的代谢组研究生物样本,肝脏样本来源于雄性Sprague-Dawley(SD)大鼠;实验时将样本梯度解冻后称取粪便0.042 6 g、肝脏组织0.054 6 g,分别加入500 μL 10%异丁醇水溶液,采用组织破碎仪(德国QIAGEN公司)进行匀浆(每次20 Hz匀浆90 s,间隔60 s,循环3次);随后,在冰浴中以45 Hz持续30 s、80 Hz持续30 s交替超声10 min,进一步提取生物样本中的代谢物;提取后的粪便及肝脏组织经离心后,取100 μL匀浆液进行衍生化处理并使用GC-FID/MS对衍生化后的脂肪酸进行分析。
2 结果
2.1 脂肪酸的异丁酯化
脂肪酸异丁酯化的反应原理已在文献[26]中报道。本研究通过优化衍生化过程中的试剂用量、时间、处理方法等参数,建立了27种脂肪酸的异丁酯化方法。该反应可直接在水相中进行,常温下涡旋震荡1 min即可完成衍生化,且衍生化产物较稳定。
2.2 GC-FID/MS检测
本研究在文献[27]报道的升温程序基础上,结合不同链长脂肪酸异丁酯的性质,优化确定了分析的升温梯度及分流比等色谱分离参数。结果(图1)显示,使用(-) -氯甲酸薄荷酯与异丁醇对27种脂肪酸进行衍生化后,脂肪酸在HP-5MS色谱柱上可较好保留且峰型良好,其中甲酸及乙酸也可与溶剂峰分离,从而实现对甲酸和乙酸更准确的定性定量分析。
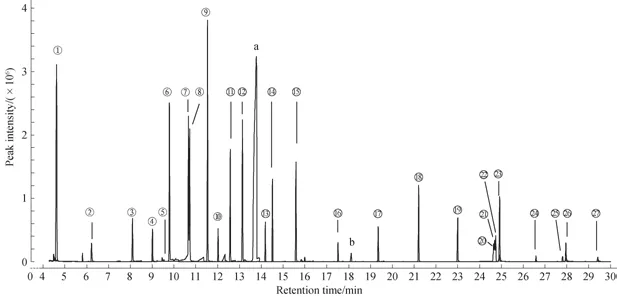
图1 27种脂肪酸异丁酯的GC-MS色谱图Fig 1 GC-MS chromatogram of 27 kinds of fatty acids isobutyl esters
本研究对脂肪酸的色谱保留时间、质谱定性及定量离子进行分析,结果(表1)显示27种脂肪酸经衍生化后均具有特征质谱碎片离子及不同的保留时间,可用于脂肪酸的定性与定量分析。各脂肪酸的定量离子为具有特征性的且抗基质噪音干扰能力较强的质谱碎片离子,同时各脂肪酸存在3~4个辅助定性离子。因此,在复杂样本中或基质干扰严重时,使用SIM进行分析可增加定量准确性。
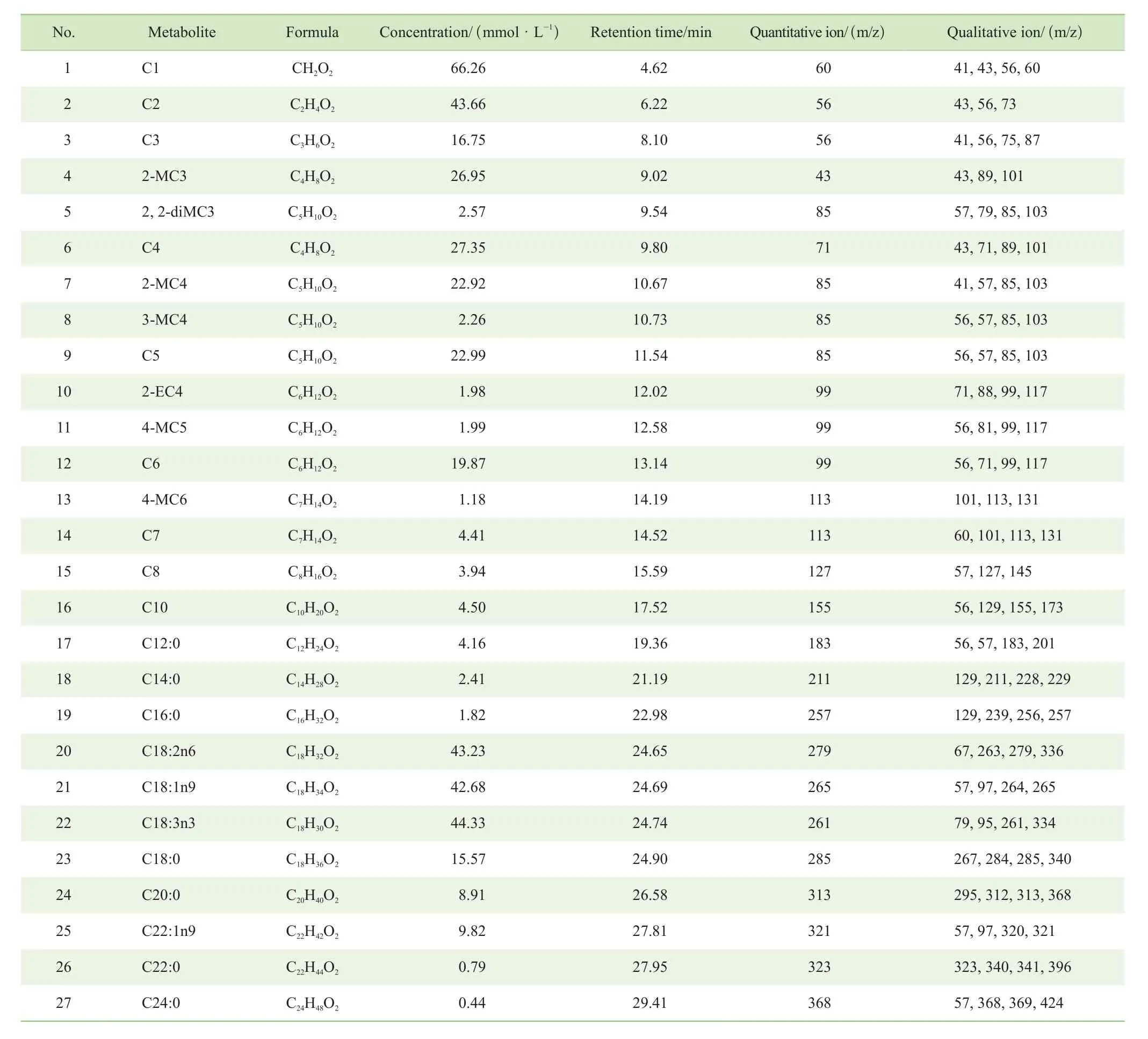
表1 27种脂肪酸配制浓度及其异丁酯色谱质谱信息Tab 1 Concentrations of 27 kinds of fatty acids and GC-MS data for the isobutyl esters
2.3 方法学验证
本研究使用27种脂肪酸进行定量分析方法的验证,主要包括线性范围、线性回归方程、LOD、LOQ、日内及日间RSD。结果(表2)表明,在使用质谱的SIM时,27种脂肪酸在2~3个数量级浓度范围内的线性方程R2值均可达0.99,其LOD在柱上0.03~2.96 pmol之间,LOQ在0.09~9.86 pmol之间,与文献中所述方法[28]相似。同时,使用FID及质谱检测器SIM采集模式进行样品检测时发现,大部分短链及中链脂肪酸的质谱响应优于FID,长链脂肪酸的FID检测灵敏度则高于质谱。此外,27种脂肪酸在低浓度、中浓度和高浓度情况下的日内及日间RSD均小于10%,说明方法具有良好的稳定性及精密度。
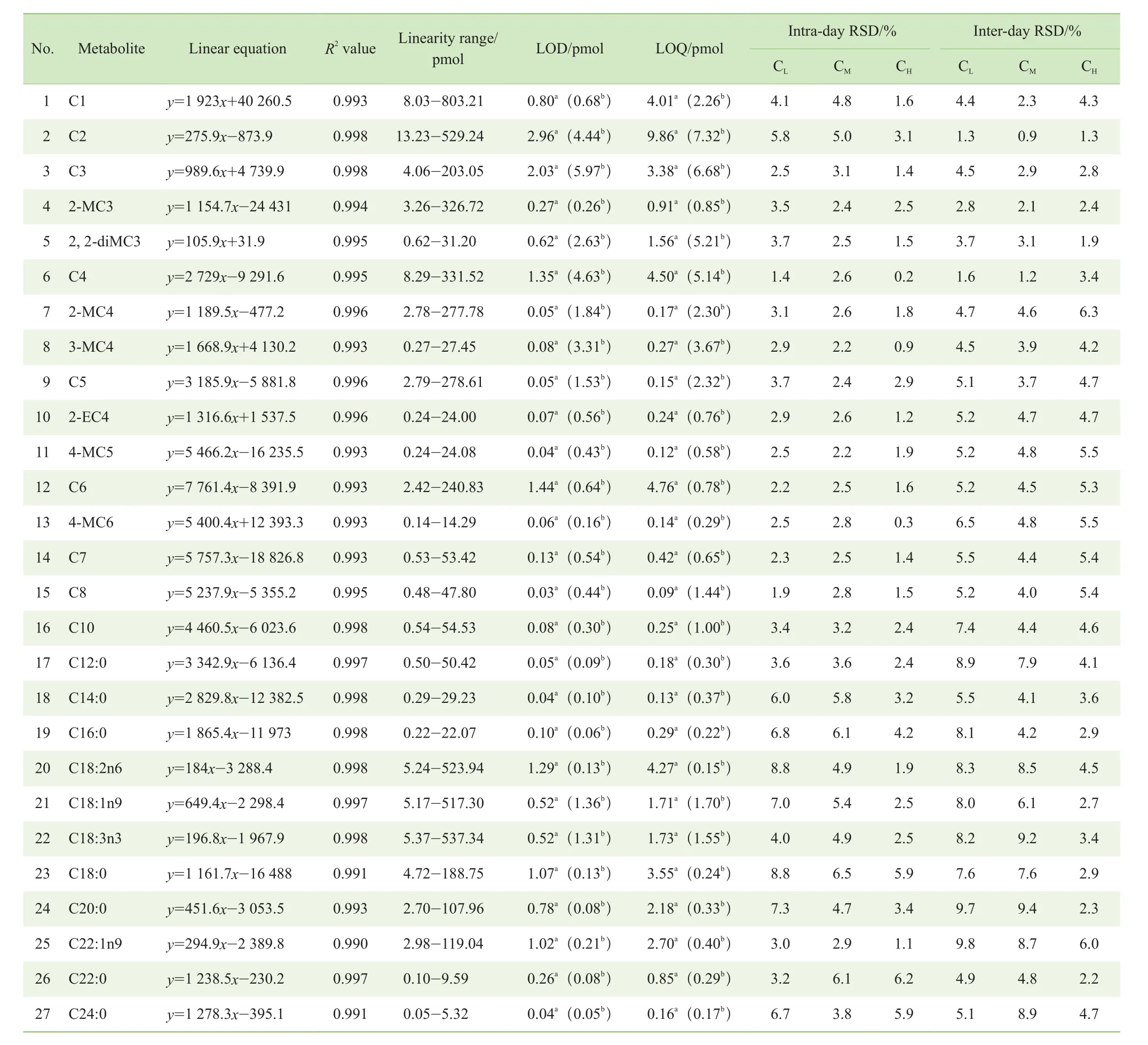
表2 脂肪酸异丁酯定量方法的线性、灵敏度、精密度及稳定性分析Tab 2 Analysis of linearity, sensitivity, precision and stability for isobutylation-based fatty acid quantification method
2.4 生物样本的普适性分析
本研究以健康青少年的血清、成年人的尿液、婴幼儿的粪便及大鼠肝脏为典型生物样本,各选择1例就上述脂肪酸定量方法对不同基质的普适性进行验证。结果(图2、表3)表明,该方法在血清样本中至少可检测到10种脂肪酸,主要为短链及长链脂肪酸,而中链脂肪酸较少;在尿液样本中可检出7种脂肪酸;在粪便样本中至少可检测到14种脂肪酸,其中乙酸含量明显高于其他脂肪酸,这与文献[29]报道结果相一致。此外,粪便样本中可检测到丙酸、2- 甲基丁酸、异戊酸、戊酸、异己酸,这些脂肪酸在其他3种生物样本中未检测到。大鼠肝脏样本可检测到9种脂肪酸。但由于选取样本量有限,上述结果并未涉及对生物学问题(如代谢物的生物学意义等)的回答,仅涉及所建方法对多种生物样本的适用性;后续在方法的具体应用中,研究者需考虑生物样本个数的重复及统计学要求。

图2 4种典型生物样本中脂肪酸的GC-MS谱图Fig 2 GC-MS chromatograms of fatty acids in four typical biological samples
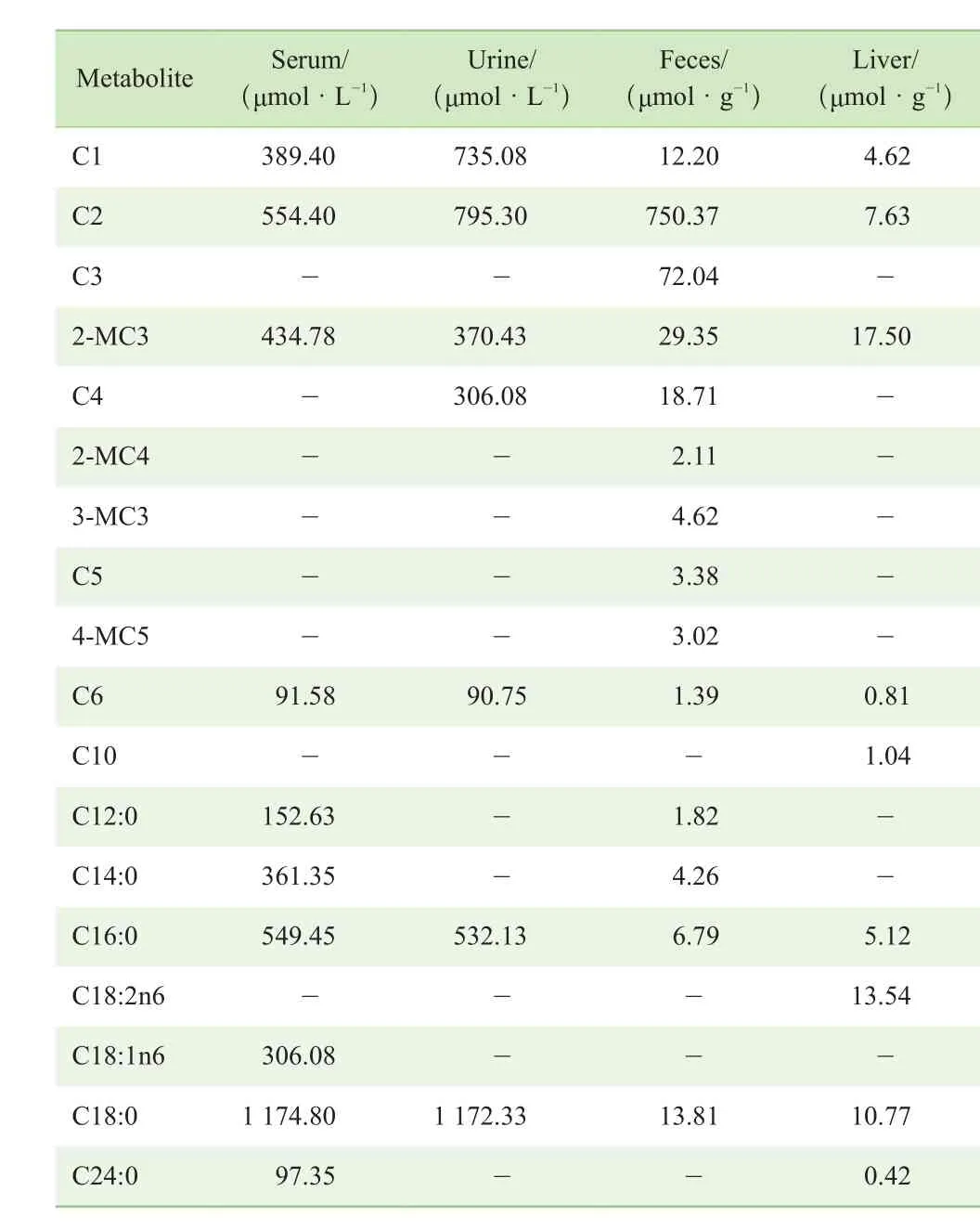
表3 4种典型生物样本中脂肪酸的含量Tab 3 Concentration of fatty acids in four typical biological samples
3 讨论
脂肪酸是细胞的重要能量来源、结构组成成分及信号物质,对其组成及变化规律进行定量分析是全局性认识此类代谢物在生理及病理过程中的功能的关键突破口。就传统的脂肪酸硅烷化及甲酯化分析方法而言,其衍生化步骤繁琐、耗时,且硅烷化分析方法必须在无水条件下进行,干燥过程易造成代谢物的损失。为此,本研究使用(-) -氯甲酸薄荷酯和异丁醇作为衍生化试剂,建立了一种基于异丁酯化的27种脂肪酸的GC-FID/MS定量分析方法,与文献[20]中报道的方法相比具有以下优势:首先,此方法可以在水相中进行,样品前处理快速便捷且无需对水进行去除或绝对隔离;其次,此方法克服了脂肪酸甲酯化或乙酯化产物的易挥发性,避免了检测前处理造成的脂肪酸酯的挥发损失;再次,此方法提高了甲酸及乙酸异丁酯的色谱保留,避免了其与溶剂峰重叠的问题,可实现短、中、长链脂肪酸的同步定量分析。
本研究通过优化相关参数,对27种脂肪酸进行了定性定量分析,包括甲酸和乙酸等在内的脂肪酸经衍生化后,实现了与溶剂峰有效分离进而被检测。使用的FID及质谱检测器SIM采集方式的检测灵敏度均可达到十亿分之一级。实验结果表明,对于短链及中链脂肪酸SIM响应更高,对于长链脂肪酸FID的响应优于SIM;但在复杂样本中或基质干扰严重时,仍然应使用SIM进行分析以增加定量准确性。方法学验证结果显示,该反应在一定浓度动态范围内呈线性(R2>0.99),且方法灵敏度高(LOQ<10 pmol)。代谢物定量分析的日内和日间RSD均小于10%,这表明当样本在常温下放置24 h或在4 ℃下放置3 d时,此方法不影响甲酸和乙酸等易挥发性脂肪酸定量结果的稳定性。因此,该方法可用于自动化程度较高的大样本脂肪酸定量分析研究。
本研究进一步以典型常见生物样本(血清、尿液、粪便、肝脏)为对象,对所建立方法的生物样本基质普适性进行验证。通过与标准溶液比对,在健康青少年血清、健康成年人尿液、婴幼儿粪便和大鼠肝脏4种常见哺乳动物的生物样本中,分别可检测到10、7、14和9种脂肪酸。其中,在粪便样本中可检测到多种短链脂肪酸且以乙酸含量最高,该结果与文献[29]报道相符合;粪便中检测到的丁酸源于肠道菌群对膳食纤维的发酵,其可作为结肠上皮细胞的重要营养物质,具有调节肠道内pH值的功能,此外其还可作为G蛋白偶联受体的天然配体。本研究尽管只聚焦27种代表性脂肪酸,但所建立的方法也可用于其他脂肪酸的定量分析,特别是血清与肝脏组织中的其他长链脂肪酸。此结果与本课题组使用甲酯化方法进行脂肪酸定量分析的前期研究[25]相比,对长链饱和及不饱和脂肪酸的检测处于同等数量级水平;虽然亚麻酸、二十烷酸等脂肪酸未被检出,但本方法扩大了短、中链脂肪酸的检测覆盖度,同时也为进一步扩大长链不饱和脂肪酸的检测覆盖度提供了可能。
综上,本研究所建立的脂肪酸定量分析方法具有简便、快速、条件温和的特点,可直接在水相中进行衍生化反应以减少代谢物损失,简化了前处理步骤,满足了代谢组分析对通量的需求;同时,该方法增加了脂肪酸检测的覆盖范围,可实现短、中、长链脂肪酸的同步定量分析。该方法为研究脂肪酸在生理病理状态下的功能提供了重要的方法学基础。
