帕金森病脑深部电刺激电极术后位置规律分析
2020-03-12张陈诚李殿友孙伯民
王 滔,张陈诚,李殿友,孙伯民,傅 萌
1. 上海交通大学医学院附属瑞金医院功能神经外科,上海 200025;2. 上海交通大学医学院附属瑞金医院放射科,上海 200025
脑深部电刺激(deep brain stimulation,DBS)治疗帕金森病(Parkinson's disease,PD)最常用的靶点为丘脑底核(subthalamic nucleus,STN)与苍白球内侧部(globus pallidus internal,GPi);向治疗靶点准确放置电极不仅能够使患者获得最优的治疗效果,还可以减少刺激相关的潜在不良反应[1-2]。DBS达到与最佳药物治疗相当或更优的疗效直接取决于DBS电极位置的准确性,据报道1%~13.6%的患者因电极位置欠理想而需要再次手术[3-4]。
目前,DBS术中常用的成像方式包括X射线(通常为C型臂X光机)、计算机断层扫描(computed tomography,CT) 或 磁 共 振 成 像(magnetic resonance imaging,MRI)等,术后则常用CT、MRI对电极位置进行评价[5]。既往的研究[6]显示,X射线仅能够判断DBS电极沿电极单一方向的位移,无法显示其与脑深部靶向核团的相对位置;CT影像需与术前MRI影像融合,以CT影像的分辨率显示电极触点与靶点的相对位置;MRI影像能够直观显示脑深部电极与靶点的相对位置而不必与术前MRI影像融合,但融合影像能够定量计算实际电极的位置与手术计划的空间距离。当前,DBS系统的电极位置评价仍以影像判断为主,对判断定位准确性与选择刺激触点程控具有重要参考意义。
鉴于快速成像的CT影像能够高分辨率显示DBS电极,而相对耗时的MRI影像能够清楚呈现脑组织与DBS电极的相对关系,本研究回顾性评价术后短期CT联合术前MRI的融合影像、长期MRI影像对电极末端位置显示的差异,并探讨2种技术成像不同的原因,以期为临床影像的选择提供参考。
1 对象与方法
1.1 研究对象
本研究选取2016年1月—2017年12月期间于上海交通大学医学院附属瑞金医院(简称瑞金医院)功能神经外科接受DBS治疗的PD患者。患者的基本信息(年龄、性别等)源自瑞金医院电子住院系统。所有患者均签署了知情同意书。
患者的纳入标准:①为原发性PD,符合英国UK脑库PD临床诊断标准或中国PD的诊断标准(2016版)[7-8]。②服用左旋多巴类药物,既往疗效良好,但目前疗效明显下降或出现运动症状波动与运动障碍,影响生活质量。③ 未服药时,PD病情关期Hoehn-Yahr分级为2.5~4期。排除标准:①患有帕金森综合征与帕金森叠加综合征,或伴有痴呆、严重抑郁症。②未服药时,PD病情关期Hoehn-Yahr分级为5期。③因存在诸如人工耳蜗、心脏起搏器、心脏除颤器等金属植入物,仅采用CT影像定位而无法获取MRI影像。④因存在恶病质、严重心血管疾病等无法耐受DBS手术。
1.2 成像流程
拟手术患者术前不安装Leksell头架(Elekta,瑞典),采集3.0 T头颅MRI影像(Signa HDx 3.0 T,GE Healthcare,美国),包括横断位、冠状位的T1加权成像(T1 weighted image,T1WI)增强影像(经静脉推注10.0 mL钆喷酸葡胺注射液)与T2加权成像(T2 weighted image,T2WI)。T1WI采用三维磁化准备快速梯度回波(three-dimensional magnetization prepared rapid gradient-echo,3D-MPRAGE) 序列,成像参数如下:回波时间(echo time,TE) =2.0 ms、反转时间(inversion time,TI) =450.0 ms、重复时间(repetition time,TR) =6.5 ms、 翻 转 角(flip angle,FA) =15.0°、带宽(bandwidth) =31.3 Hz、扫描野(field of view,FOV) =24.0 cm、矩阵(matrix) =320×256、激发次数(number of excitation,NEX) =1次、层厚=2.0 mm、层间隔=0 mm,成像时间=3′3″。T2WI采用快速自旋回波(fast spin echo,FSE)序列,成像参数如下:TE=129.1 ms、TR=3 000.0 ms、FA=90.0°、 带 宽 =31.3 Hz、FOV=24.0 cm、 矩 阵 =320×192、NEX=1次、层厚=2.0 mm、层间隔=0 mm,成像时间 =3′31″。选取前联合 - 后联合(anterior commissureposterior commissure,AC-PC)平面作为参考平面,采用常规方法对患者全颅进行成像,横断位成像平行于参考平面,冠状位成像垂直于参考平面,平均每例患者扫描15~20 min。
手术当日,经局部麻醉后将Leksell头架安装至患者头颅,完成术前CT成像(LightSpeed 16 Slice CT Scanner,GE Healthcare,美国),获取全颅平行基环平面的横断位CT影像,Helical扫描层厚3.75 mm,无缝重建层厚0.625 mm。将术前MRI与CT影像传输到Leksell三维手术计划系统(Elekta,瑞典)进行影像配准融合及三维重建,手术计划靶点由神经外科医生确定。
于患者住院期间(即术后3~5 d)再次获取CT影像以评价DBS电极(3387型号电极,Medtronic,美国)末端触点位置,成像参数与术前一致,取患者仰卧位、不带头架进行成像。利用手术计划系统将术后CT影像与术前影像融合,评价DBS电极末端触点与手术计划靶点坐标的空间差距。
于患者长期程控随访期间(通常为术后3~6个月)按需获取MRI影像,评价颅内电极位置与偏移情况。鉴于患者已手术植入DBS设备,故获取1.5 T MRI横断位影像。T1WI采用三维快速扰相梯度回波(three-dimension fast spoiled gradient-echo,3D-FSPGR)序列,成像参数如下:TE=2.4 ms、TI=350.0 ms、TR=8.1 ms、FA=20.0°、 带宽=16.7 Hz、FOV=26.0 cm、矩阵=224×224、NEX=1次、层厚 =2.0 mm、层间隔 =0 mm,成像时间 =5′5″。T2WI采用快速恢复快速自旋回波(fast recovery fast spin echo,FRFSE) 序 列, 成 像 参 数 如 下:TE=107.9 ms、TR=5400.0 ms、FA=90.0°、带宽 =10.4 Hz、FOV=26.0 cm、矩阵=256×224、NEX=3次、层厚=2.0 mm、层间隔=0 mm,成像时间=3′52″。利用手术计划系统将术后MRI影像与术前影像融合,评价DBS电极末端触点与手术计划靶点坐标的空间差距。
1.3 统计学方法
采用SPSS 23.0软件对研究数据进行统计分析。符合正态分布的定量资料以表示,采用配对样本t检验进行分析;不符合正态分布的定量资料以M(Q1,Q3)表示,采用配对样本的非参数检验Wilcoxon符号秩和检验进行分析。P≤0.05表示差异具有统计学意义。
2 结果
2.1 人口统计学信息分析
本研究共入选49例PD患者,男性22例、女性27例,年龄40~82岁,平均年龄(62.8±8.2) 岁。其中1例患者因帕金森症状改善欠佳而由双侧STN靶点调整为双侧GPi,即接受2次手术治疗,纳入研究统计2项记录。因此,共计有36例患者植入DBS电极至双侧GPi,7例患者为双侧STN,另有7例患者为单侧GPi与对侧STN的不对称靶点。
2.2 影像学分析
48例患者获取了术前3.0 T MRI影像,2例因植入DBS设备而获取1.5 T MRI影像。于术后住院期间,平均(2.6±1.2)d获取患者CT影像,用于评价电极位置;于长期程控随访期间,平均(7.4±5.9)个月获取1.5 T MRI影像,用于评价电极位置。因此,针对所有患者,共获得了50组术后CT融合影像与术后MRI影像。
分别将同一患者的术后CT影像(图1)与术后MRI影像(图2)融合至术前影像,以获得空间坐标值从而比较空间差距,即按照左右侧DBS电极分别比较同侧电极内外(X轴)、前后(Y轴)、顶底(Z轴)以及空间距离。结果(表1)显示术后CT融合影像与术后MRI影像中,DBS电极在内外、前后、顶底3个方向及空间距离间差异均具有统计学意义(右侧电极内外、顶底方向除外);因此,整体而言2种成像方法在各自时间节点对术后DBS电极末端触点位置的显示存在较大差异。
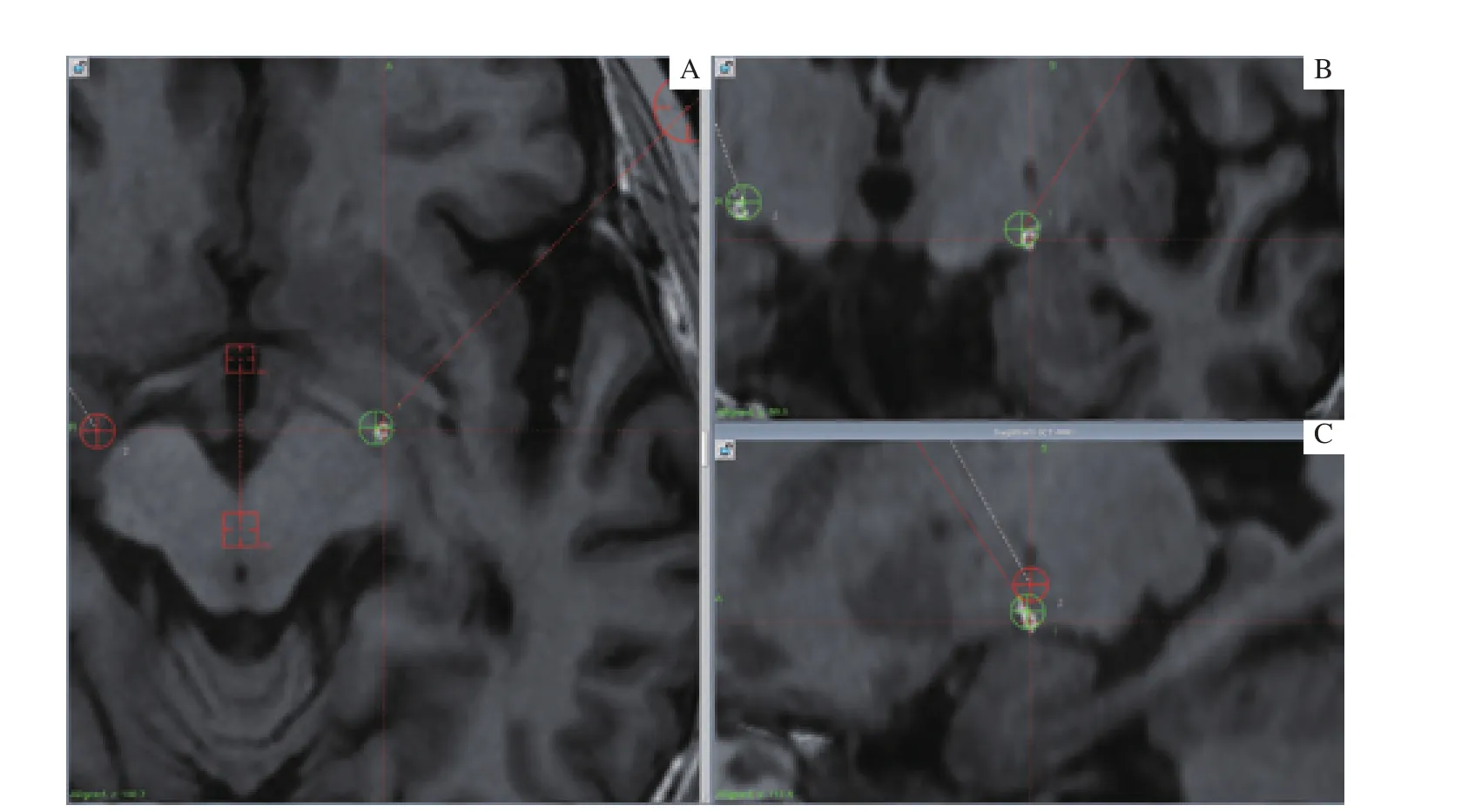
图1 DBS术后患者CT影像与术前MRI影像的融合影像Fig 1 Fused image of CT images after DBS surgery and preoperative MRI images of patients
此外,将同一患者的术后CT影像所示的电极末端触点空间坐标值与术后MRI影像坐标值间的差值进行排列并分析其分布情况(图3)。手术计划系统的影像空间以右、后、顶部为坐标原点,坐标值朝左、前、底部按照空间距离逐渐增加。依据表1所示空间差距以及手术计划系统三维坐标系实值分布提示,双侧电极在术后长期与短期相比均存在向内侧、后方、底部与脑组织发生相对位移的趋势。
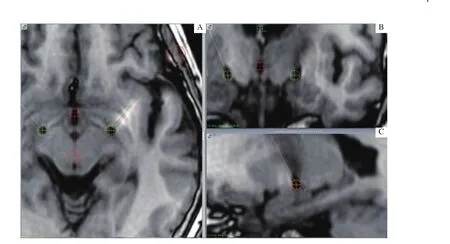
图2 DBS术后患者MRI影像与术前影像的融合影像Fig 2 Fused image of MRI images after DBS surgery and preoperative images of patients
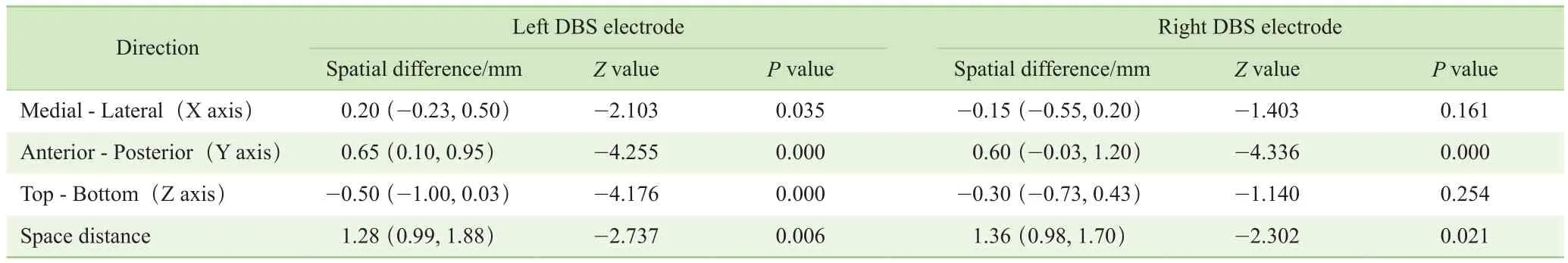
表1 DBS电极在术后CT融合影像与术后MRI影像中的立体定向空间差异Tab 1 DBS electrodes differences of stereotactic space between postoperative CT fused images and the postoperative MRI images

图3 患者术后CT、MRI影像所示电极末端触点坐标差异的频数分布直方图Fig 3 Histogram of the frequency distribution of the differences among last contacts of electrodes shown in the CT and MRI images of the patients after operation
3 讨论
本研究通过术后短期CT与术前3.0 T MRI的融合影像、术后长期随访采集的MRI影像对比分析DBS电极末端触点所示空间位置发现,前者的显示结果并未明显优于后者,但2种成像方法在各自时间节点对术后DBS电极末端触点位置的显示存在较大差异。本研究还发现,DBS电极在内外、前后、顶底三维方向均有明确位移,两者成像误差达到0~4.7 mm,且双侧电极的相对位移均存在向内侧、后方、底部发生的趋势;该误差范围将显著影响依据术后影像判断的DBS电极触点与靶向核团的相对空间关系,但其二者间相对位置的变化趋势可提示在术后长期过程中存在潜在的位移规律。由此可见,术后短期DBS电极位置仍有可能在颅内发生变化,而既往研究[9-11]提示多种因素的影响对DBS电极触点位置的评价不容忽视。本研究主要考虑以下潜在影响因素对术后短期电极位置的判断。
3.1 脑漂移
DBS手术期间颅骨被钻孔后可导致空气进入,从而使脑实质发生相对颅骨的非线性变形——主要由脑脊液(cerebrospinal fl uid,CSF)流失所致脑漂移——患者仰卧位时积气将前脑朝枕骨方向推挤。然而,在术后短期成像时患者的气颅并未完全消退,DBS电极可能因此未能严格按照手术计划被植入脑深部核团,造成电极触点未完全处于靶点的植入误差范围;即使颅内空气逐渐被吸收,脑实质变形亦逐渐恢复,但其空间位置未必能够与术前一致,从而亦可能使DBS电极相对脑实质发生位移。
据报道,与年龄、术前脑室容积、手术时间相比,脑漂移对患者DBS电极植入的影响更为显著[9-11]。术后颅内空气容积与AC的移位显著相关,且因此导致的在单侧植入DBS电极手术中AC-PC连线朝对侧移位、双侧手术中AC-PC连线朝后侧移位等情况已屡见不鲜[12-13]。随颅内硬膜下积气被吸收,DBS电极可沿电极路径向上平均位移(3.3±2.5)mm,位移程度与术后硬膜下积气量显著相关。为减少所观察到的位移,部分医师在植入DBS电极时选择比经测试刺激后有良好反应的最腹侧点更深的位置作为实际电极的植入深度值点[14],或者需要设计多条路径以准确定位靶点;然而,补偿性调整电极位置未必适合所有的患者,且路径的增加也可能增加患者脑出血等的潜在风险,因此减少CSF流失对脑漂移至关重要。目前,常通过缩小硬脑膜切口,减少手术时间,减少CSF吸引,用生理盐水冲洗颅骨钻孔并以生物蛋白胶封闭,达到减少CFS流失的目的。
本研究中患者的积气多分布于前额与钻孔附近,该情况给术后电极位置的改变造成了显著影响。结果发现,靠前、靠顶部的积气随术后的恢复逐渐被吸收后,受挤压的脑组织亦可逐渐恢复至术前形态,即向前、向顶部发生小的形变,而DBS电极相对于恢复后脑组织发生的位移倾向即为双侧均向内侧、后侧与深部。当前,脑漂移仍难以规避且是亟待解决的手术相关问题之一;而当建立相应物理模型时,研究者们需考虑电极与脑组织共同位移倾向(上述研究[12-13]提示)与两者相对位移倾向(本研究提示),以优化模拟表现。
3.2 影像融合
DBS手术定位与术后评价最常用的影像变换手段即为影像配准与融合,而这些手段多以术前定位、术后无框架头颅CT影像与术前影像融合以评价电极位置,且有条件的手术中心在术中常用头颅CT和(或)MRI影像与术前影像融合以评价电极位置[15]。由于术前影像可用于确定解剖结构,术后影像用于确定电极位置,共同配准(co-registration)则是实现上述精确影像的关键步骤[16-17]。影像配准与融合算法对融合影像质量具有决定性作用,因此不精确的配准最终会导致影像误差增加。而在临床实践中尤其是术后MRI影像方面,有时仅采集到部分大脑影像而非全颅,将其准确配准到术前影像对于配准算法颇具挑战性,而在某些情况下甚至需要手动配准术后影像。
3.3 电极识别
因具有金属材质的特性,DBS电极可在CT与MRI影像中呈现相应伪影;其中,CT影像主要以电极末端4个刺激触点为中心呈现出放射状伪影,而MRI影像主要以触点为中心呈现出4个椭圆状伪影,即电极刺激触点在平面影像中以“增粗”的形状呈现(MRI中局部空间扭曲)——伪影横截面长轴大于实际电极直径,从而可以通过人工直视来判断电极末端触点中心存在的可以预见的误差。在计算机重建电极步骤中,既往研究[18-20]利用相应模型证明MRI影像与CT影像的电极伪影中心正是对应的颅内电极中心。为此,通过计算机重建DBS电极,实现电极末端触点中心的自动识别以客观评价电极在不同时间节点的相对位移,可能是减少人工偏移的更优方案。
对DBS电极在脑深部位置的验证不仅可以发挥最大的治疗作用,减少潜在的不良反应并降低未来需要额外重新定位手术的可能性,还可以对术后程控刺激触点的筛选提供参考,避免在刺激靶点外区域引起不必要的相关不良反应。
本研究为单中心回顾性研究设计,尚存在一些局限性,包括术后复查CT与MRI的成像时间节点并未严格固定,术后扫描时间节点跨度较大,术后短期颅内水肿、积气等变化对时间的变化率较大,术后远期可能存在随年龄的脑变化等。如前所述,人工直视定位电极末端触点中心受电极周围伪影的干扰,给触点中心的识别增加了一定的难度;尽管融合影像的配准程度在人眼直视下对齐良好,但融合误差仍可能对其所测结果形成潜在差异。另外,鉴于术后评价影像均取自横断位影像,冠状位与矢状位平面的影像重建分辨率低于横断位影像,故判断这两个平面所示电极末端触点位置存在潜在的不准确性。正因如此,真实触点中心的判断应源于电极触点的横断面影像,因而影像配准融合算法的优劣对与影像评价具有至关重要的作用。
目前,利用立体定向手术精准植入DBS设备已为越来越多的患者提供了较好的生活质量。细致的手术定位是治疗的基础,严格的定位评价是对个体治疗的有效保障。术后短期的CT影像与术前影像融合受多种因素影响,因而对于DBS术后最终电极位置的评价相对有限。本研究发现,与术后短期患者相比,DBS电极在术后长期患者颅内存在微小的相对位移倾向;该结果不仅为当前临床实践操作提出了亟待完善的要求,同时也是建立脑漂移物理模型的研究基础之一,可为优化手术植入DBS电极提供参考。
