甜樱桃花芽不同发育时期内参基因的筛选与验证
2020-03-12
(贵州大学农业生物工程研究院,山地植物资源保护与保护种质创新教育部重点实验室,贵州 贵阳 550025)
甜樱桃(Prunusavium)又名欧洲甜樱桃,大樱桃,属蔷薇科(Rosaceae)李属(Prunus)樱桃亚属(Cerasus)植物[1]。甜樱桃因其鲜艳的外观和丰富的营养物质而深受人们喜爱,种植面积和产量也因此逐年增加。据统计,在2007—2016年间,全球樱桃生产呈上升趋势,2016年种植面积达43.97万hm2,产量达231.80万t,而10年前年产量仅32.71万t[2]。尽管全球樱桃产量剧增,但中国仍较低,2016年产量仅3.75万t,与产量排名全球第一的土耳其相差甚远,尚不能满足国民的需求[2]。
实时荧光定量PCR (quantitative real-time PCR,qRT-PCR)是一种用于研究基因表达水平的技术,常用于验证转录组测序数据的准确性以及不同实验条件下特定基因的表达情况等[3]。qRT-PCR技术因其高通量、高灵敏度以及较好的特异性和重复性等优点,被广泛应用于研究动植物及微生物的基因功能[4-5]。由于不同样本在RNA质量、产量、cDNA第一链合成效率以及扩增效率上的差异会影响qRT-PCR结果的准确性,因此,通常用内参基因对其数据进行校正[6]。内参基因通常是组织或器官中一些表达相对恒定的持家基因[7],但并不是所有持家基因均可以作为内参基因。因此,需根据具体实验需要,对不同组织[7]、不同实验条件[8]或不同发育时期[9]进行内参基因筛选。
因地域和气候的不同,甜樱桃花芽发育过程中一些花芽发育相关基因的表达可能会发生变化,进而可影响花粉和雌蕊的发育。而这些花器官的发育则影响果实的发育,最终影响甜樱桃产量。因此研究花芽发育相关基因表达情况对提高甜樱桃产量具有重要意义。为保证花芽发育相关基因表达情况检测的准确性,需对花芽不同发育时期的内参基因进行筛选。为筛选稳定表达的内参基因,本研究根据课题组前期果实转录组测序数据(尚未发表),从中选取表达相对稳定,表达量较高且常作为其他物种内参基因的10个持家基因(28SrRNA、EF1-a1、EF1-a2、UBC、RPL13、18SrRNA、RSP3、CYP40、ACT2、α-TUB3)作为候选内参基因,以2个甜樱桃品种3个发育时期花芽为材料,用qRT-PCR技术对这10个候选内参基因的转录情况进行分析,并结合GeNorm[10]、NormFinder[11]、BestKeeper[12]3种软件对候选内参基因的稳定性进行评价,筛选出稳定表达的内参基因,以期为甜樱桃花芽发育相关基因的表达模式研究提供参考。
1 材料与方法
1.1 实验材料
以贵州省威宁县(E:104.12,N:27.25)种植的甜樱桃桑提娜和修文县(E:106.21,N:26.45)种植的甜樱桃黔樱一号不同发育时期花芽为材料。根据花芽长度分为3个发育时期,第一时期花芽大小为0.5~0.6 cm,第二时期为0.8~0.9 cm,第三时期为1.1~1.2 cm;黔樱一号3个发育时期样本分别为Q 1、Q 2、Q 3,桑提娜3个发育时期样本分别为S 1、S 2、S 3;每个样本设3个生物学重复。
1.2 总RNA的提取和cDNA第一链的合成
实验前将经高温灭菌后的研钵、药匙等经液氮冷却,样品在液氮浸润下进行研磨。研磨后的样品使用天根生化科技(北京)有限公司的RNAprep Pure 多糖多酚植物总RNA提取试剂盒(DP 441)进行总RNA提取。随后用20 g·L-1琼脂糖凝胶电泳检测总RNA的完整性,并用Multiscan GO (Thermo)检测RNA的浓度和纯度。随后以RNA为模板,用宝生物反转录试剂盒合成cDNA第一链,产物保存于-20 ℃冰箱备用。
1.3 候选内参基因筛选和引物设计
根据本实验室建立的甜樱桃桑提娜转录组数据库和相关文献报道的常用内参基因,选取10个持家基因为候选内参基因,用引物设计软件Primer Primer 5.0设计特异性引物(表1),并将设计好的引物提交至生工生物工程(上海)股份有限公司合成。
1.4 普通PCR和qRT-PCR
候选内参基因的普通PCR扩增在Veriti 96 well PCR仪(Applied Biosystems)上进行,以2个品种不同发育时期花芽的cDNA为模板,反应体系共10μL:ddH2O 3.5μL,2×Taq PCR Mastermix (201 T),正、反向引物(10μmol·L-1)各 0.5μL,cDNA 0.5μL。PCR 扩增条件为:94 ℃预变性4 min;94 ℃变性30 s,58.4~61.3 ℃复性30 s,72 ℃延伸60 s,共35个循环;72 ℃延伸5 min;4 ℃保存。随后用琼脂糖凝胶电泳检测扩增产物的条带是否单一,以确定该引物的特异性。
候选内参基因的qRT-PCR反应在实时荧光定量 PCR仪(CFXconnect)上进行,反应体系(10μL)为:cDNA模板0.5μL,正向引物0.25μL,反向引物0.25μL,SYBR Select Master Mix 5μL,ddH2O 4μL。所用程序为:94 ℃ 10 min;94°C 15 s,58.4~61.3 ℃ 30 s,72 ℃ 1 min,39个循环;72 ℃ 2 min。
1.5 内参基因表达稳定性评价
分别用Genorm、NormFinder软件和Bestkeeper软件对候选内参基因的稳定性进行评价。其中Genorm和NormFinder稳定值越低,表明该基因表达越稳定。Bestkeeper分析结果中标准偏差(standard deviation,SD)、相关系数R值和变异系数(coefficient of variation,CV)是主要参考指标,SD和CV越小,R值越大,则该基因表达越稳定;当SD>1时,则该基因表达不稳定。最后,通过计算各候选内参基因的几何平均值进行排名,几何平均值越小,说明越稳定,反之则越不稳定。

表1 甜樱桃不同发育时期花芽候选内参基因qRT-PCR引物及扩增效率

图1 甜樱桃花芽不同发育时期总RNA提取的琼脂糖凝胶电泳检测
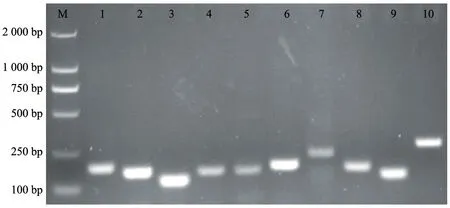
注:M为DNA Maker 2000;1为28S rRNA;2为EF1-a1;3为EF1-a2;4为UBC;5为RPL13;6为18S rRNA;7为RSP3;8为CYP40;9为ACT2;10为α-TUB3。图2 10个内参基因PCR产物电泳图
2 结果与分析
2.1 RNA纯度及完整性验证
琼脂糖凝胶电泳结果表明,RNA完整性好,无基因组DNA污染(图1),且所有样本OD260/OD280介于1.8~2.1之间,OD260/OD230介于1.8~2.2之间,表明所有样本RNA完整,纯度高,可用于进行后续实验。
以桑提娜第一时期的花芽cDNA为模板对10个候选基因进行普通PCR扩增,琼脂糖凝胶电泳结果(图2)显示只有单一的条带,没有出现引物二聚体及非特异扩增的现象,通过测序、比对证实扩增条带与预期目的基因序列信息一致。
2.2 扩增效率和扩增特异性分析
用候选内参基因的引物,以6个样本的cDNA为模板,进行qRT-PCR扩增,每个样本3个生物学重复,3个技术重复,并将获得的数据用LinRegPCR软件[13]进行计算。结果显示,候选内参基因的R2较高,均可达0.99以上,扩增效率介于87.67%~101.50%之间(表1),满足qRT-PCR对引物扩增效率的要求。另外,所有候选内参基因的溶解曲线均显示为单一信号峰,且同一样品重复性好。

表2 BestKeeper分析10个候选内参基因表达稳定性
2.3 候选内参基因表达丰度分析
Ct值是指基因进行qRT-PCR扩增时到达预设的阈值时所需的循环数[14],循环数越小代表起始基因的模板浓度越高。基于此,分析了10个候选内参基因在各样本中的Ct值,并对其表达丰度进行评估。本研究中,候选内参基因的Ct值介于19~31之间,表达丰度分布范围广(图3)。其中,以EF1-a2、RPL13和RSP3的Ct值在不同样本间变化较小,数据较为集中。因此,初步判断在甜樱桃花芽不同发育时期,EF1-a2、RPL13和RSP3表达较为稳定。为了更准确地判断内参基因的稳定性,后续还需用内参基因稳定性评价软件做进一步分析。
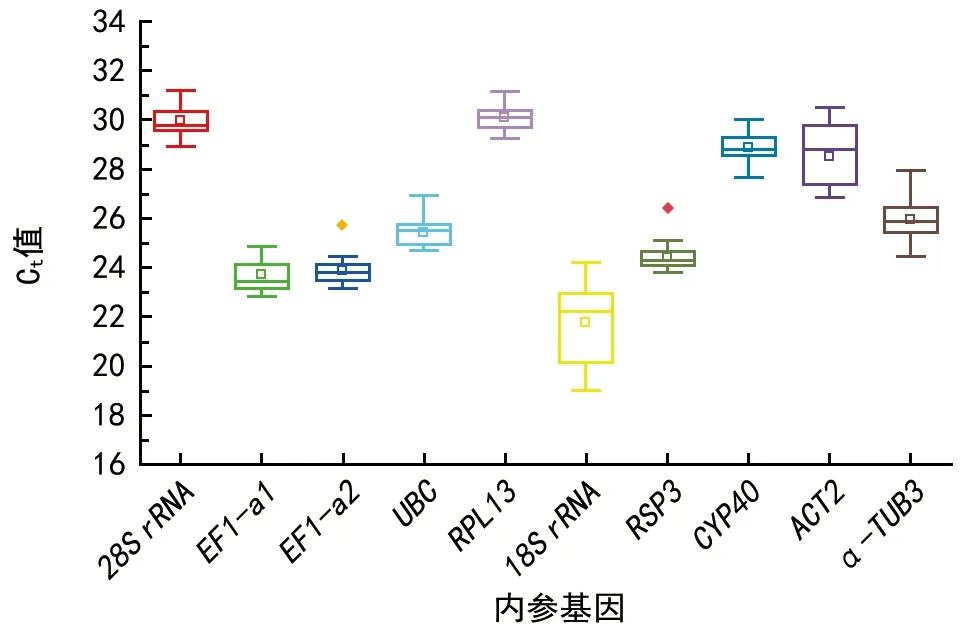
图3 10个候选内参基因Ct值的箱形图
2.4 候选内参基因稳定性分析
GeNorm是以Ct值为原始数据,通过计算各候选内参基因的表达稳定值M来衡量其表达稳定性。软件默认当候选内参基因的M值大于1.5时,不适于作为内参基因。M值越小,越稳定,越适合作为内参基因,反之则不适合作为内参基因。经比较,按M值由高到低的顺序排列依次为:18SrRNA>ACT2>α-TUB3>RPL13>28SrRNA>CYP40>EF1-a1>UBC>EF1-a2=RSP3。另外,10个候选内参基因的M值均小于1.5,以18SrRNA最大,为1.014;EF1-a2和RSP3最小,均为0.340,表明这些候选内参基因均适合作为内参基因。其中EF1-a2和RSP3最佳,其次为UBC、EF1-a1、CYP40、28SrRNA、RPL13、α-TUB3;相对而言,18SrRNA和ACT2表达最不稳定。此外,GeNorm还通过计算配对变异值Vn/n+1来确定最适宜的内参基因个数。该程序以0.15为阈值,当Vn/n+1<0.15时,表明最适合的内参基因有n个。GeNorm计算结果表明,V2/3为0.110,小于0.15,表明最适合的内参基因有2个。
NormFinder是以Ct值为原始数据,计算出表达稳定性值M,根据M值的大小判断其是否适合做内参基因,判断标准为M值越小,越适合作为内参基因,反之则不适合作为内参基因。经计算,UBC和CYP40表达稳定值最小,分别为0.164和0.196,即表达稳定性最好;而18SrRNA和ACT2的表达稳定值最大,分别为1.251和0.819,说明18SrRNA和ACT2表达稳定性最差(图4)。因此UBC和CYP40最适合作为内参基因,其次是RSP3和EF1-a1。

图4 NormFinder分析10个候选内参基因的表达稳定性
BestKeeper分析则主要通过内参基因的Ct值计算得到的SD和CV值来确定不同处理、不同发育时期下候选内参基因的稳定性。分析结果(表2)表明,EF1-a2和RSP3SD值最小,均为0.40,说明这2个内参基因表达稳定性最好,最适合作为内参基因,其次是RPL13、UBC和CYP40。
2.5 稳定性综合分析
经综合分析,甜樱桃花芽不同发育时期内参基因的稳定性由高到低依次为:EF1-a2>RSP3>UBC>CYP40>EF1-a1>RPL13>28SrRNA>α-TUB3>ACT2>18SrRNA;由排名可以看出,EF1-a2和RSP3为最稳定的内参基因。
2.6 内参基因稳定性验证
为验证本研究所筛选的EF1-a2、RSP3基因的稳定性,用生长素信号转导途径中的关键基因AUX1和ARF对筛选的内参基因稳定性进行验证。以EF1-a2、RSP3及EF1-a2+RSP3作为内参基因,对2个甜樱桃品种花芽发育过程中AUX1基因和ARF基因进行表达分析时发现,AUX1和ARF在EF1-a2、RSP3及EF1-a2+RSP3标定下表达趋势均一致(图5),可见EF1-a2和RSP3的稳定性较好。综上所述,一致选定EF1-a2和RSP3桑提娜和黔樱一号为甜樱桃不同发育时期花芽qRT-PCR分析基因表达的最佳内参基因。

图5 不同内参基因标定下甜樱桃花芽不同发育时期AUX1、ARF基因表达量
3 讨 论
研究表明,内参基因的选择不具有通用性,如盲目地使用内参基因,很可能会降低定量结果的精确性,甚至得出错误的结论[15]。因此,在对目标基因进行表达情况分析前,须对内参基因进行稳定性评价。基于转录组测序筛选内参基因是一种有效的方法[16-17],可为后续验证转录组数据,研究基因表达情况提供技术和线索。且在樱桃[18],莲雾[19],菊叶薯蓣[9]等多种植物中取得了成功[18]。理想的内参基因应在不同的品种、不同实验条件、不同组织、不同时期下均稳定表达。但实际上,并不存在这样理想化的内参基因[20]。且有研究指出,内参基因的表达量在不同的生理状态和细胞类型中表达并非绝对稳定[21]。
为了更准确的探究2个甜樱桃品种不同发育时期花芽中相关基因的表达情况,本研究对2个甜樱桃品种不同发育时期的花芽进行了内参基因筛选。GeNorm和BestKeeper分析表明,EF1-a2和RSP3表达最稳定,表明EF1-a2和RSP3是最适合的内参基因。Normfinder的分析结果显示,最稳定的为UBC和CYP40。可见,3种软件分析的结果其稳定性排序略有差异,推测是3个统计学软件算法的不同所致[22]。但3个软件所分析的稳定性排名前5名的内参基因中均有EF1-a2和RSP3,且经综合排序分析表明,EF1-a2和RSP3是最稳定的2个内参基因。另外,GeNorm分析内参基因的配对变异系数结果表明,2个内参基因就可满足校正目的基因的表达量[23-24]。经多种分析方法证明后,用生长素运输载体AUX1和生长素响应因子ARF对其进行验证,结果表明该2个基因表达趋势一致,说明EF1-a2和RSP3适合作为甜樱桃花芽发育过程中的内参基因。
在动植物体内,ACT基因编码的肌动蛋白,在维持细胞基本生理活动方面发挥着重要的作用,因此常被作为内参基因。在对柑橘[25]、核桃[26]、荔枝[27]等果树进行内参基因稳定性评价时,actin基因均表现出较好的稳定性。但在本研究中,3种软件的分析结果均显示ACT2基因在甜樱桃花芽中较不稳定,这可能与物种,组织或发育时期有关。在百合[28]、拟南芥[15]、马铃薯[29]和石蒜[30]等的研究结果中也发现ACT基因不适合作内参基因。类似地,18SrRNA在动植物整个生命活动中起着重要作用,在对杨树[18],柑橘[31],水稻[32]进行内参基因稳定性评价时,均发现18SrRNA适合作为内参基因。但在本研究中,18SrRNA表达丰度虽然较高,但在不同的样本中表达丰度跨度较大、极不稳定,不适合作为甜樱桃花芽不同发育时期的内参基因,其原因可能是不同发育时期的花芽中rRNA与mRNA的比例在不断变化所致[33];另外,RNA小量的降解对mRNA表达水平的影响可能要比18SrRNA的影响大[34]。因此,在实验过程中,需使用稳定表达的内参基因来增加试验的准确性及可信度,为后续获得相对准确的基因表达分析结果奠定基础。
在对苹果[6]、桃[35]、葡萄[36]等果树进行内参基因稳定性评价研究时,筛选出了UBQ、ACTB、Fe-SOD、GAPDH、EF1-a和SAND等几个相对稳定表达的内参基因,但不同果树中均有差异。本研究所选取的10个候选内参基因均参与生物体的基本生化代谢过程,在所有细胞和生理状态下都能较稳定地表达。经GeNorm、NormFinder和BestKeeper三个内参基因稳定性软件评估后,发现EF1-a2和RSP3最适合作为内参基因。EF1-a2是一类真核延伸因子,在蛋白质翻译过程中起着重要作用。在真核生物中参与翻译调控、凋亡、细胞骨架组成及信号转导等生命活动,编码的是一种普遍存在且具重要功能的蛋白[37]。在小麦不同器官[38]和苹果着色期的基因表达中EF1-a的表达稳定性较好[39]。在对荷花不同发育时期花瓣中基因表达情况的研究中,也选择EF1-a作为内参基因[40]。但在刺槐[41]、中国石蒜[30]和珙桐[7]中,EF1-a并不适合作为内参基因。RSP3是一类核糖体蛋白,参与蛋白质的合成,是真核生物中极为重要的一类蛋白,但该基因用作内参基因的研究较少。本研究从甜樱桃转录组数据中发现其表达量较高,同时也参与真核生物蛋白质的合成,因此将其作为候选内参基因,经一系列分析,最终表明RSP3基因适合作为甜樱桃不同发育时期花芽的内参基因。
4 结 论
EF1-a2和RSP3在2个甜樱桃品种花芽不同发育阶段中均表达稳定,可作为甜樱桃花芽不同发育时期的内参基因。进而可为研究单个品种或多个品种花芽发育相关基因的表达情况奠定基础。
