腹部无辅助切口经阴道取标本的全腹腔镜全胃切除术(GC-NOSES Ⅷ式)(附视频)
2020-03-11王松于刚赵旭刘金超
王松 于刚 赵旭 刘金超
众多研究结果显示,与开腹全胃切除术相比较,腹腔镜全胃切除术具有创伤小、恢复快、切口美观等优势,且在安全性和近、远期疗效方面并不劣于开腹手术,因此得到了广泛开展[1]。腹部无辅助切口经阴道取标本的腹腔镜全胃切除术(GCNOSES Ⅷ式)是经自然腔道取标本手术(natural ori fice specimen extraction surgery,NOSES)技术在腹腔镜全胃切除术中的应用,在全腔镜下完成全胃切除、淋巴结清扫及消化道重建,经自然腔道取出标本,避免腹壁切口,减轻手术创伤,且操作视野更加广阔,重建时更容易判断肠管远近端方向,可有效避免在辅助小切口下暴露不足、吻合后肠管扭转、吻合口张力过大等问题,在手术的安全性方面优势明显,得到业内广泛认可。《胃癌经自然腔道取标本手术专家共识(2019版)》于2019年8月正式发布,对胃癌NOSES的理论体系以及临床实践多个方面进行了全面阐述,为该技术的规范开展提供了参考依据和行业准则[2]。GC-NOSES手术需要熟练的腹腔镜操作技术及默契的团队配合,尤其是侵犯齿状线的食管胃结合部癌更具挑战性,能够常规开展此手术的医院较少。现将本中心行腹部无辅助切口经阴道取标本的腹腔镜全胃切除术经验以及其中一例病例报道如下。
一、患者资料
患者女性,66岁,因“进食梗噎感2月”入院,查体:BMI 19.8 kg/m2,腹肌软,上腹部压痛,无反跳痛,肠鸣音正常。胃镜示距门齿37 cm至40 cm见溃疡病变,管腔狭窄,超细胃镜勉强通过,40 cm达贲门,见一火山口样溃疡病变,表面溃烂,覆盖污苔,取活检(图1),病理结果示腺癌。CT示食管胃结合部、胃体癌(图2),未见肺部、腹腔等远处转移。上消化道造影示食管受累约3 cm(图3)。
完善术前检查后,提交MDT小组讨论,考虑患者无远处转移,建议行手术治疗。鉴于肿瘤下缘达胃体中下部,近端胃手术难以满足切除范围,需行全胃切除术;手术难点在于肿瘤侵犯食管下段,经腹膈肌食管裂孔路径行腹腔镜下食管空肠吻合难度大。
术中行腹部无辅助切口经阴道取标本的全腹腔镜全胃切除术,手术器械为常规腹腔镜器械,手术时间310 min。术中胃镜联合腹腔镜精确定位肿瘤上缘,保证上切缘安全。患者于术后第2天进流质饮食,逐渐过渡到正常饮食,术后第5天拔除引流管。术后腹部疼痛轻微(VAS评分3分),无阴道异常流血及分泌物,无腹胀等不适,无吻合口漏、出血、梗阻、感染等并发症发生,术后第10天出院。术后病理分期:pT3N2M0 IIIA。
二、手术操作方法
患者取分腿仰卧位,Trocar 的布置采用五孔法,术者站于患者左侧,助手站于右侧,扶镜手站于两腿之间。

图1 胃镜所见
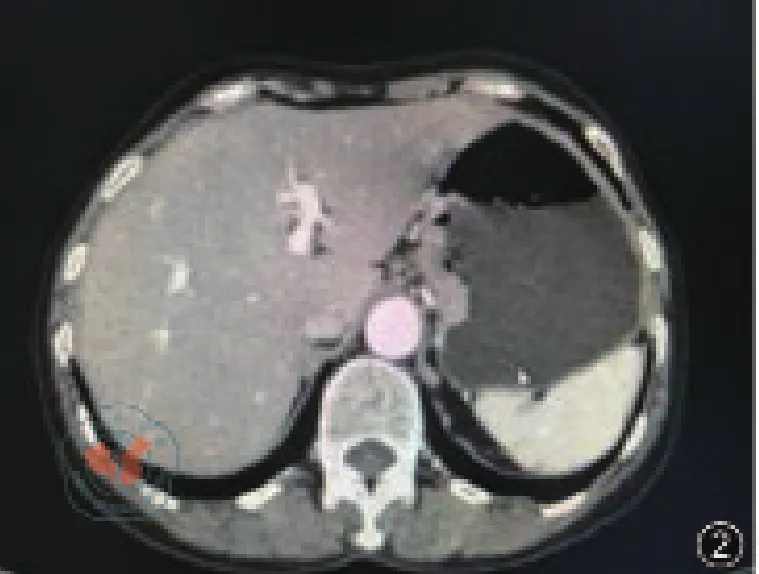
图2 CT
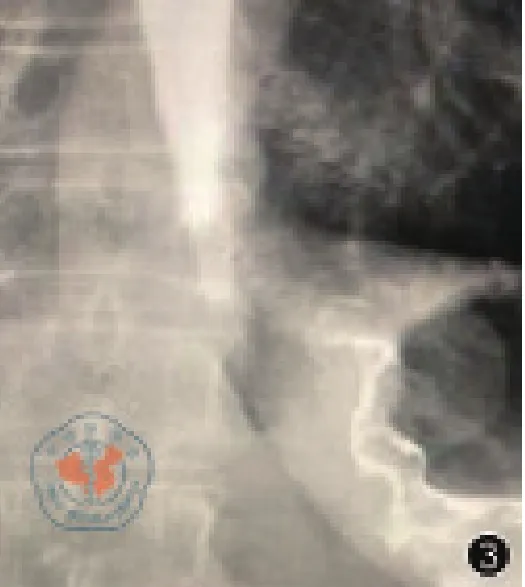
图3 上消化道造影
全腹腔镜全胃切除术具体操作步骤:
腹腔镜探查及淋巴结清扫操作:(1)腹腔镜探查,排除腹腔种植转移及其他病变;(2)剥离横结肠系膜前叶,分离胃结肠韧带;(3)清扫第6组淋巴结:将胃窦部向上提起,显露胃结肠静脉干,离断根部胃网膜右静脉;继续沿胰头表面分离,打开胃胰韧带,显露胃十二指肠动脉,裸化胃网膜右动脉,根部离断,清扫第6组淋巴结;(4)清扫第4、10组淋巴结:进入网膜囊,显露胰尾,定位脾血管,松解结肠脾曲,分离大网膜与脾下极的粘连,保护胰尾,显露胃网膜左动、静脉,在其发出供应脾下极的分支后离断,清扫第4sb组淋巴结,并进一步清扫脾门区淋巴结。将胃及大网膜向左侧牵拉,继续向上方分离,切断胃短血管,清扫4sa组淋巴结;(5)清扫第8a、12a、5组淋巴结:暴露肝总动脉,将胰腺向左下牵拉,沿肝总动脉前方及上缘分离,清扫第8a组淋巴结。沿胃十二指肠动脉及肝总动脉充分显露胃右动脉及肝固有动脉,继续向上分离肝固有动脉前方及外侧,清扫第12a组淋巴结。于胃右动、静脉根部夹闭后离断,清扫第5组淋巴结;(6)在幽门远端2 cm处用45 mm切割缝合器离断十二指肠,于肝总动脉、胃十二指肠动脉及胰腺上缘夹角处打开门静脉前方筋膜,显露门静脉,将肝总动脉向前腹壁挑起。沿门静脉前方分离,清扫门静脉与肝固有动脉间淋巴结。沿门静脉内缘向上分离至肝门部,将肝总动脉向右下牵拉,清扫肝固有动脉内侧及门静脉内侧淋巴脂肪组织;(7)清扫第11p、7、9组淋巴结:将大网膜置于肝脏下方,助手抓持胃胰皱襞,将胃翻向上方。紧贴胰腺上缘分离,暴露脾动脉近端,清扫第11p组淋巴结。由左向右清扫,显露腹腔动脉干,分离胃左动、静脉,在根部夹闭后离断,清扫第7、9组淋巴结;(8)沿脾动脉向远端分离,切断胃后血管,清扫第11d组淋巴结;(9)清扫胃小弯淋巴结:紧贴胃壁小弯侧,采用超声刀分层切开,清扫胃小弯淋巴结;(10)游离食管下段,沿胸主动脉前壁清扫110组、112组淋巴结。紧贴胃壁小弯侧,采用超声刀分层切开,切断迷走神经前干和后干,清扫第1组及第2组淋巴结;(11)术中胃镜定位肿瘤上缘,距离肿瘤上缘3 cm用45 mm切割缝合器切断食管,将标本置入标本袋中,暂置于左下腹,待经阴道取标本。
消化道重建:食管近断端左右两侧分别缝合一针倒刺线,用超声刀自食管断端中央切开,距Treitz韧带约20 cm处离断空肠,远端空肠与食管行Overlap法吻合。2针倒刺线连续缝合加固,关闭共同开口。食管-空肠吻合后,距离食管空肠吻合口40 cm空肠对系膜侧开孔,近端空肠与远端空肠使用45 mm直线切割闭合器行侧侧吻合,4-0可吸收线间断缝合关闭共同开口。
经阴道取标本操作:(1)改患者体位为头低足高右倾30°的膀胱截石位,调整腹腔镜显示器于患者足侧(如图4所示);观察孔调整为左侧腋前线肋缘下戳卡孔,方向调整为向足侧操作,术者站于患者右侧,术者操作孔更换为脐下戳卡孔和右侧锁骨中线平脐戳卡孔(如图5所示);(2)显露并消毒会阴部,用碘伏纱布反复消毒阴道;分别于阴道后穹窿切开前、切开后、标本取出后、缝合完毕后用蒸馏水、稀碘伏溶液(1 000 mg/L)、生理盐水彻底冲洗盆腔;(3)经阴道置入压肠板,将阴道后穹窿顶起,横行切开约5 cm;(4)自阴道或腹部戳孔置入切口保护套,表面用碘伏纱布擦拭润滑,用卵圆钳抓取标本,经切口保护套将标本拉出,注意保持气腹压力,后将切口保护套平稳拖出;(5)用3-0倒刺线2根,连续加固缝合阴道后穹窿切口,确保缝合严密。
图4 取标本时手术者站位及显示器位置
具体手术操作可见手术视频。图6为经阴道取标本,图7~8为术后标本照片,图9~10为术后腹部外观照片。
三、讨论
胃癌是全球最常见的恶性肿瘤之一,根据GLOBCAN的统计数据,2018年全球胃癌新发病例约103.3万例,死亡病例约78.3万例,中国胃癌发病例数和死亡例数分别占全球胃癌发病和死亡的42.6%和45.0%,在全球183个国家中发病率位于第5位、死亡率位于第6位[3]。我国胃癌患者Ⅰ期胃癌和Ⅳ期胃癌分别占19.5%和9.7%,Ⅱ~Ⅲ期胃癌占比高达70.8%。根据肿瘤直径大小分类,肿瘤直径小于5 cm的胃癌患者约占一半[4],因此适合行NOSES手术的胃癌患者约30%。但限于目前国内外胃癌NOSES的开展情况,实际接受胃癌NOSES的患者数量非常少。
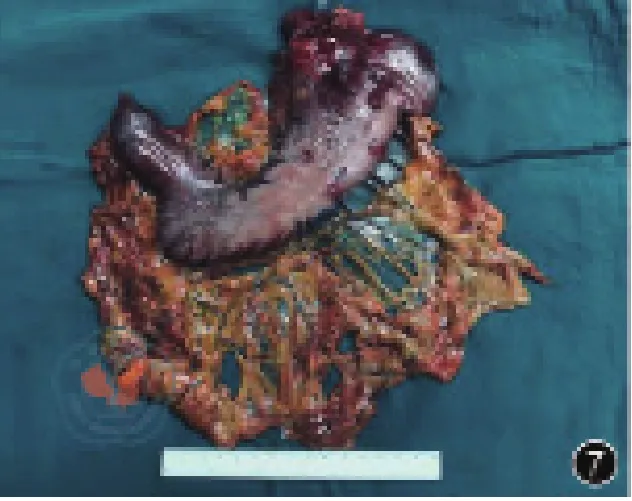
图7 术后标本照片
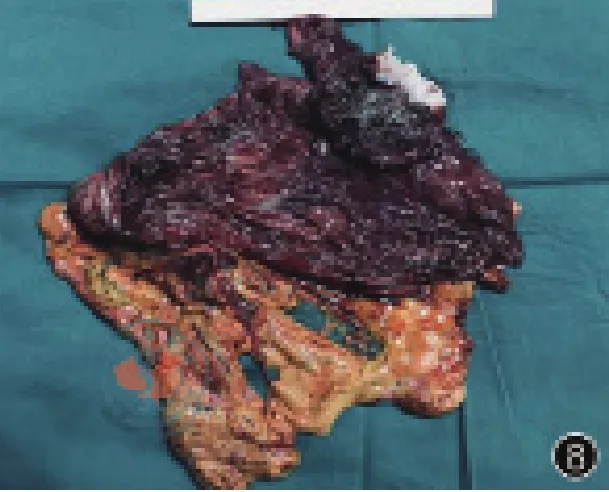
图8 术后标本剖开照片

图9 手术结束时腹部照片
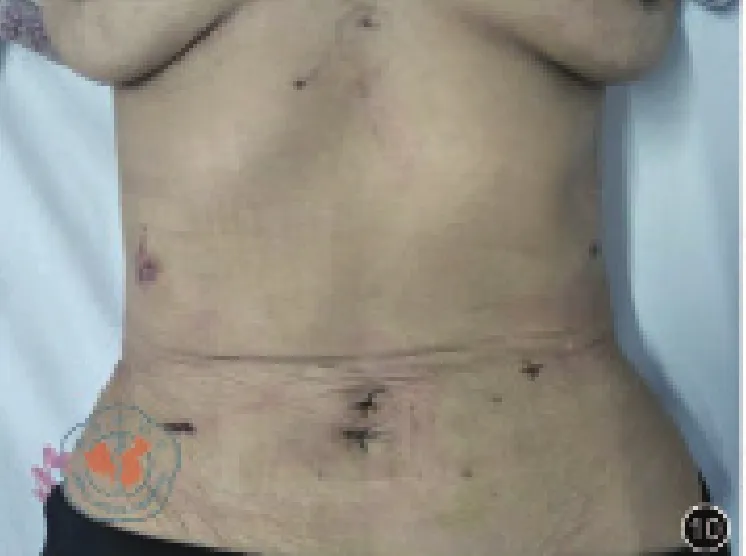
图10 术后10天腹部照片
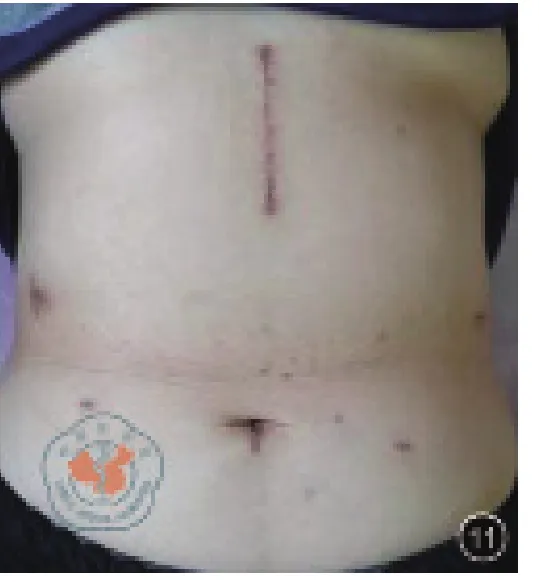
图11 腹腔镜辅助手术患者腹部照片
D2根治术是胃癌根治手术的金标准,随着外科切除重建技术的不断提高、腹腔镜设备的进步,目前腹腔镜胃癌手术已能达到与开腹手术相同的D2淋巴结清扫水平,消化道重建亦能在腔镜下完成(即全腹腔镜胃癌手术)。全腹腔镜下胃癌根治术消化道重建是近年来研究的热点之一,虽然其操作难度大,但具有创伤更小、视野更好、操作空间相对更大等优点,并且能够在腹腔镜下近距离观察吻合口,判断吻合质量、吻合口大小及有无出血等情况[5]。随着结直肠NOSES手术的逐渐成熟,胃癌NOSES可行性及安全性的初步探索也得到了越来越多的肯定。
全腹腔镜下全胃切除术难点有以下几方面:(1)肿瘤位置高,淋巴结清扫、消化道重建困难大,选择合适的手术路径尤其重要,《食管胃结合部腺癌外科治疗中国专家共识(2018版)》指出可选择的手术路径包括经左胸单切口、上腹右胸两切口、上腹左胸两切口、颈胸腹三切口、左胸腹联合切口以及经腹食管裂孔径路,专家组建议食管受累<3 cm者首选经腹膈肌食管裂孔路径,≥3 cm者经上腹右胸路径[6]。我们的经验是经腹食管裂孔径路,在悬吊肝脏的基础上,悬吊食管裂孔,保证充分显露极为重要;(2)由于食管空肠吻合口位置高,吻合的质量决定手术的成败,仔细分离、裁剪小肠系膜,在不损伤肠管血供的前提下,保证无张力吻合;(3)肿瘤位置高,术中胃镜可帮助准确定位肿瘤近端边界,保证上切缘的安全,吻合完成后检查食管空肠吻合的质量。
在全腹腔镜根治性全胃切除术的安全性有了充分的保障后,经自然腔道取标本与之相结合,没有增加手术难度,消除了腹壁取标本切口,微创优势进一步扩大。图11与图9、图10展示的腹腔镜辅助手术与NOSES手术腹部照片,明显可以看出NOSES手术在腹部外观方面的优势。NOSES手术主要强调经自然腔道完成标本取出,胃癌NOSES属于切除拖出式,没有改变常规经腹入路的手术操作,其实质是切口的移位,将腹壁切口移位至较为隐蔽且缺乏痛觉的阴道或直肠。与腹壁切口相比,阴道切口、直肠切口具有位置隐蔽、无可见疤痕、疼痛轻等多种优势,且减少了腹壁切口相关并发症风险、降低了患者心理负面影响,更符合损伤效益比原则[7]。与D2远端胃切除术、近端胃切除术相比,D2全胃切除术因不裁剪网膜,标本横径更大,因而取标本的难度相对更高,术前需精确评估,保证取标本过程的顺利进行。目前仍有不少医生心理上对经阴道取标本、经肛门取标本存在“偏见”,但是笔者认为只要掌握好适应证和术中操作技巧,经阴道取标本、经肛门取标本NOSES术有其存在的意义和价值。胃癌NOSES切除、重建操作位于上腹部,取标本过程需将标本转运至下腹部,标本转运过程中保证无瘤是至关重要的,笔者认为将切除标本置入无菌标本袋中转运是非常有必要的。经自然腔道取标本辅助工具的合理选择可以有效的保护好切口,降低自然腔道切开后的并发症发生风险,提高经自然腔道取标本的成功率。但目前尚无具有明显优势的工具可供选择,笔者团队使用的是自制软质的塑料通道。
阴道后穹窿在腹腔镜下容易暴露与识别,在解剖上无大的血管和神经通过,此处切开对性生活不会造成明显影响[8],经阴道更容易取出较大标本,且缝合后并发症发生率低,其安全性、损伤效益比更高。刘金超等[9]报道了38例经自然腔道取标本的完全腹腔镜胃肿瘤切除术的病例,并未发生直肠或阴道后穹窿切开后并发症,初步证实了该术式的安全性,其指出只要做好术前准备、熟练掌握手术技巧,NOSES与无菌、无瘤原则并无相悖之处。经阴道取标本主要限制在阴道后穹窿切开长度,而经肛门取标本主要限制在肛门。我们在取标本操作时,在保证无菌无瘤无瘤原则下,预先在无菌保护套内部涂抹碘伏溶液起润滑作用,用卵圆钳抓取距离肿瘤较远一侧的胃壁正常组织,循序渐进将胃标本沿纵轴向体外牵拉,这样可将切除胃组织牵拉成近似管状,并减少肿瘤破裂风险,利于标本的取出;当标本最大径通过自然腔道最狭窄的部分后,剩余部分及大网膜等组织则可顺利取出。经肛门取标本在无菌要求、取标本过程、缝合切口等方面比经阴道取标本操作要求更高,风险更大。经肛门取标本时,更容易发生直肠撕裂,应避免暴力牵拉。关闭直肠前壁切口时应用2条3-0倒刺线连续加固缝合,尽可能降低肠漏的风险,而阴道后穹窿切口连续全层缝合一次即可。
结直肠肿瘤NOSES目前已成熟开展,其优势明显,NOSES手术腹壁无辅助切口,最大程度保留腹壁功能,患者术后疼痛轻、恢复快,对腹部外观的满意度高,同时降低切口感染、切口裂开、切口疝等近远期并发症发生率[10]。胃癌NOSES可借鉴其成功的经验,对于食管胃结合部腺癌行经自然腔道取标本的全胃切除术,需严格掌握适应证,术前准确评估肿瘤位置、大小、浸润深度等,保证无菌无瘤操作及患者安全。NOSES手术正处于不断完善过程中,目前开展的D2全胃NOSES病例数量仍较少,随访时间短,尚无大宗病例报道,还需要更多的同道开展相关临床研究,观察其远期疗效。

扫码观看手术视频
