基于谷胱甘肽修饰的金纳米簇选择性检测铜离子
2020-03-10杜佩瑶卢小泉
安 春 杜佩瑶 张 振 卢小泉*,2
1(天津市分子光电科学重点实验室, 天津大学理学院化学系, 天津 300072)2(甘肃省生物电化学与环境分析重点实验室, 西北师范大学化学化工学院, 兰州 730070)
1 引 言
铜(Cu)被广泛应用于电子设备、机械、建筑等领域[1],同时也是人体所需的基本元素。Cu2+在动物和人体的多种代谢过程(如血红蛋白的形成、骨骼的发育、结缔组织的代谢及维持神经元的正常功能等)中发挥了重要作用[2,3],但过量的Cu2+会导致肠胃不适[4]、肾脏和肝脏损伤、红细胞形成异常、身体虚弱、帕金森综合症、威尔逊病等[5],对身体造成不良影响。因此,建立一种高选择性、快速、灵敏监测体内和环境中Cu2+含量的方法具有重要意义。目前,检测Cu2+的方法包括如电感耦合等离子体发射光谱法(ICP-OES)[6]、电化学法[7]、电感耦合等离子体质谱法(ICP-MS)[8]、原子吸收光谱法(AAS)[9]等。然而,测试时间长、复杂的样品制备过程、繁琐的分析程序限制了这些方法的广泛应用。
荧光检测技术是一种高灵敏度、高选择性、操作简便、快速响应的技术,可以快速准确地进行待测物的分析检测。Adinarayana等[10]通过在大环化合物中引入2,2-联吡啶单元,形成了单阴离子中心,可以稳定Zn2+,进而诱导荧光增强,且在所研究的金属离子中,只有Zn2+可以导致荧光增强,因此,可以选择性检测Zn2+。Pathan等[11]发现,As(III)与磁性石墨烯氧化物量子点结合,限制了分子内振动,导致荧光增强,从而可以定性与定量检测As(III),检出限低至5.1 μg/L。有机荧光染料[2]和荧光半导体量子点[12]可用于分析检测,但抗光漂白性差、尺寸大等问题限制了二者在生物体内的应用[13]。
目前,金属纳米簇(<2 nm)由于其独特的光学性质如斯托克斯位移大、荧光寿命长、生物相容性好、从紫外到近红外可调的宽带荧光发射和强的抗光漂白能力等[13~18]引起了广泛关注。Yuan等[19]采用一锅法合成了聚乙烯亚胺(PEI)包裹的蓝绿色发射的银簇,用于Cu2+的检测。Yu等[20]合成了万古霉素包裹的蓝绿色发射的金纳米簇(Gold nanoclusters, AuNCs),基于电子转移机制导致荧光猝灭, 可用于检测Fe3+。Roy等[21]合成了具有蓝色荧光的AuNCs,量子产率为41.3%,可用于检测As(III),检出限为53.7 nmol/L。Yuan等[22]通过相转移的方法制备了发射蓝色荧光的银簇,可以高选择性、免标记地检测Hg2+,检出限为5 nmol/L。Li等[23]通过配体交换的方法制备了发射蓝绿色荧光的AuNCs,可以高选择性地检测Cu2+,检出限为71.24 nmol/L。Zhang等[24]通过刻蚀方法在水溶液中合成了pH依赖的、发射绿色荧光的银簇,该银簇具有良好的稳定性,可以高选择性地检测Hg2+,检出限低至4 nmol/L。Deng等[25]通过主客体效应制备了发射绿色荧光的AuNCs,量子产率高达65%。Zhou等[26]通过组氨酸还原制备出发射绿色荧光的AuNCs,具有双光子效应,可以选择性检测Fe3+; 在5~125 μmol/L 较宽的浓度范围内,其荧光强度与浓度之间呈现出较好的线性关系。虽然金属纳米簇的研究已经取得了很大进展,但是其通常发射蓝绿色的荧光,限制了其在生物体内的应用。
本研究利用谷胱甘肽(GSH)作为还原剂和稳定剂,制备了发射红色荧光的AuNCs,在pH=5.5的条件下,可快速、灵敏、高选择性地检测水中痕量Cu2+。GSH包裹的AuNCs水溶性好、毒性低,便于制备和使用。AuNCs的红色荧光可避免复杂生物基质背景荧光的干扰,提高Cu2+检测的准确性。利用本方法检测水中Cu2+,检出限低至23 nmol/L,低于我国饮用水Cu2+限量标准(15.6 μmol/L)[30],为水中Cu2+的检测提供了一种简便快捷的方法。
2 实验部分
2.1 仪器与试剂
JEOL Model JEM-2100透射电子显微镜(200 kV,日立高新技术有限公司); T6 New Century 紫外-可见分光光度计(北京普析通用有限责任公司); F-7000 荧光光谱仪(日本日立公司); Nicolet-iS50 傅里叶红外光谱仪(美国赛默飞公司); XD-3A X-射线衍射仪(40 kV,λ=0.15406 nm, 10°~80°,日本岛津公司); Axis Ultra Dld X-射线光电子能谱(英国Axis Ultradld 公司)。
HAuCl4·3H2O,L-GSH(上海阿拉丁试剂有限公司); K2HPO4、KH2PO4(3A化学试剂公司); 乙二胺四乙酸二钠(EDTA)、NaCl、KCl、CaCl2、MnCl2、CoCl2·6H2O、NiCl2·6H2O、CdCl2·5/2H2O、ZnCl2、HgCl2、CuCl2·2H2O、FeCl2·4H2O、MgSO4、BaCl2·2H2O、FeCl3·6H2O、Al(NO3)3·9H2O、Pb(NO3)2、Cr(NO3)3·9H2O(上海阿拉丁试剂有限公司)。实验用水为超纯水。自来水样品取自实验室,实验用鼠为Wistar大鼠。
2.2 AuNCs的制备
AuNCs的合成参照文献[18]的方法并略作改进。HAuCl4(101.566 mmol/L,0.0985 mL)和GSH(100 mmol/L,0.15 mL)依次加入到4.7 mL超纯水中,在N2保护下,70℃反应24 h。得到的亮黄色AuNCs溶液于4℃条件下储存,备用。
2.3 pH值的优化
取20 μL AuNCs原液与980 μL不同pH值的PBS缓冲液(10 mmol/L,由K2HPO4、KH2PO4、KCl配制)混匀,反应3 min,测量荧光光谱,激发波长365 nm,狭缝宽度10 nm; 取20 μL AuNCs原液、3 μL Cu2+(1 mmol/L)溶液与977 μL不同pH值的PBS缓冲液(10 mmol/L)混匀,反应3 min,测量荧光光谱,激发波长365 nm,狭缝宽度10 nm。
2.4 Cu2+的检测
配制1 mmol/L Cu2+溶液,逐步稀释成不同浓度的Cu2+溶液,备用。取3 μL不同浓度的Cu2+溶液、20 μL AuNCs原液与977 μL PBS缓冲液(10 mmol/L,pH 5.5)混匀,反应3 min,测量荧光光谱。
2.5 选择性和抗干扰测试
配制10 mmol/L(Co2+、Fe2+、Ni2+、Al3+、Zn2+、Cd2+、Na+、Mg2+、Mn2+、Ca2+、K+、Ba2+)、5 mmol/L (Fe3+、Hg2+、Cr3+)和4 mmol/L Pb2+金属离子的溶液。取3 μL不同金属离子的溶液、20 μL AuNCs原液与977 μL PBS(10 mmol/L,pH 5.5)缓冲液混匀,反应3 min,测量荧光光谱。
先取3 μL不同金属离子的溶液,加入20 μL AuNCs原液和977 μL PBS(10 mmol/L,pH 5.5)混合溶液中,反应3 min。随后,在混合液中再加入3 μL Cu2+(1 mmol/L)溶液,反应3 min,测定加入Cu2+前后的荧光强度。
2.6 实际样品处理和分析
取10 mL自来水,煮沸,除去其中的氯气,备用。取5 mL大鼠全血置于抗凝管中,静置30 min, 3000 r/min离心10 min,取上层清液,于-80℃保存,备用。为了评估本方法的实用性,在自来水或血清样品中,添加不同浓度的Cu2+(200、 500和2000 nmol/L)。随后,加入AuNCs原液,反应3 min,测定荧光光谱。
3 结果与讨论
3.1 材料表征


图1 (A,B) AuNCs的高分辨透射电镜图; (C)AuNCs的紫外-可见吸收谱图(a)和荧光发射谱图(激发波长为365 nm)(b),插图为AuNCs在可见光下的照片(左)和365 nm紫外灯下的照片(右); (D)红外谱图: (a)谷胱甘肽,(b)AuNCs; (E)AuNCs的X-射线电子衍射谱图; (F)Au 4f的X-射线光电子能谱Fig.1 (A, B) High-resolution transmission electron microscope images of gold clusters (AuNCs); (C) UV-vis absorption spectrum (a) and fluorescence spectrum (λex=365 nm) (b) of AuNCs, inset is the photograph of AuNCs solution under daylight (left) and 365 nm UV-light irradiation (right); (D) Fourier transform infrared spectra of (a) glutathione (GSH) and (b) AuNCs; (E) X-ray diffraction spectrum of AuNCs; (F) X-ray photoelectron spectroscopy of Au 4f
3.2 可行性测试及检测条件的优化
如图2A所示, Cu2+可导致AuNCs荧光猝灭,且荧光猝灭程度随着Cu2+浓度的逐渐增大而增强。考虑到溶液pH值和反应时间对AuNCs的荧光强度均有影响,对影响AuNCs荧光强度的因素进行了考察。结果表明,AuNCs的荧光强度对pH值具有依赖性,如图2B所示,随着pH值从3.0增加到10.0, AuNCs的荧光强度逐渐增强。Cu2+对AuNCs荧光的猝灭效果同样与pH值有关,如图2C所示,溶液pH值从3.0变化到5.5,Cu2+对AuNCs的荧光猝灭程度随着pH值升高而急剧增大,pH>5.5时, Cu2+对AuNCs的荧光猝灭程度略有减小。在pH=5.5时, 荧光猝灭程度最大。因此, 检测Cu2+的实验均在pH=5.5条件下进行。
对反应时间进行了优化,如图2D所示,在1 min内, AuNCs的荧光几乎被Cu2+完全猝灭, 3 min后保持不变。
综上,实验条件确定为: pH=5.5; 反应时间3 min; 激发波长为365 nm。

图2 (A)AuNCs检测Cu2+可行性实验: (a)AuNCs,(b)AuNCs + Cu2+(200 nmol/L)和(c)AuNCs + Cu2+(1 μmol/L)的荧光光谱; (B)AuNCs随pH变化的荧光光谱曲线(pH值(a~h): 3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0); (C)在pH 3.0~11.0之间AuNCs中加入3 μmol/L Cu2+荧光强度变化情况(F、F0分别表示有和无Cu2+时AuNCs荧光强度); (D)Cu2+(3 μmol/L)猝灭AuNCs荧光强度随时间变化Fig.2 (A) Feasibility test of AuNCs for detection of Cu2+: (a) AuNCs, (b) AuNCs+Cu2+ (200 nmol/L) and (c) AuNCs+Cu2+ (1 μmol/L); (B) Fluorescence spectra of AuNCs at different pH values (from a to h: 3.0, 4.0, 5.0, 6.0, 7.0, 8.0, 9.0, 10.0); (C) Fluorescence intensity of AuNCs in the presence of Cu2+ (3 μmol/L) in pH 3.0-11.0 (F and F0 stand for the fluorescence intensity of AuNCs with and without Cu2+, respectively); (D) Fluorescence intensity of AuNCs varies with time after addition of 3 μmol/L Cu2+
3.3 AuNCs检测Cu2+的灵敏性和选择性
测定了不同Cu2+浓度下AuNCs的荧光光谱,如图3A所示,AuNCs对Cu2+表现出超灵敏的响应特性,随Cu2+浓度从0 μmol/L增加到6 μmol/L,610 nm处AuNCs的荧光强度逐渐减弱,当Cu2+浓度为6 μmol/L时,荧光几乎完全猝灭。如图3B所示,随着Cu2+的浓度从25 nmol/L增加到6.0 μmol/L,在610 nm处F0/F值(F0和F分别代表不存在和存在Cu2+时AuNCs的荧光强度)逐渐增大,并在两段浓度范围内均呈现良好的线性关系。在25 nmol/L~1.2 μmol/L之间的线性关系如图3C所示,F0/F=0.9831+0.0007908[Cu2+] (R2=0.9963),检出限为23 nmol/L(S/N=3)。在1.2~6.0 μmol/L之间的线性关系如图3D所示,F0/F=0.0047[Cu2+]-4.7913 (R2=0.9845)。本方法的检出限低于美国环境保护署(EPA)规定饮用水中Cu2+的最高限量(20 μmol/L)[1],也低于我国生活饮用水卫生标准对Cu2+的限量水平(15.6 μmol/L)[30]。相比于其它文献报道,本研究合成的AuNCs对Cu2+的检测具有更高的灵敏度,如表1所示。

图3 (A)不同浓度Cu2+时AuNCs荧光发射光谱图, Cu2+浓度(a~o): 0、100、200、300、400、600、800、1000、1100、1300、1500、2000、3000、4000和6000 nmol/L; (B)AuNCs荧光猝灭程度随Cu2+浓度变化曲线; (C、D)Cu2+浓度与AuNCs荧光强度之间线性曲线(B、C、D中F和F0分别代表有和没有Cu2+时AuNCs荧光强度)Fig.3 (A) Changes of AuNCs fluorescence emission spectra with different concentrations of Cu2+ (from a to o: 0, 100, 200, 300, 400, 600, 800, 1000, 1100, 1300, 1500, 2000, 3000, 4000 and 6000 nmol/L); (B) Change of fluorescence quenching degree of AuNCs with different concentrations of Cu2+; (C, D) Linear curves of concentration of Cu2+ and fluorescence intensity of gold cluster (F and F0 stand for the fluorescence intensity of AuNCs with and without Cu2+ in B, C and D, respectively)
测试了AuNCs对多种常见的金属离子(Co2+、Fe2+、Ni2+、Al3+、Zn2+、Cd2+、Fe3+、Na+、Mg2+、Mn2+、Ca2+、Hg2+、K+、Cr3+、Pb2+、Ba2+和Cu2+)的荧光响应。由图4A可见,只有Cu2+能够急剧猝灭AuNCs的荧光,而其它金属离子对AuNCs的荧光强度几乎没有影响。抗干扰实验结果如图4B所示,将多种常见金属离子(Co2+、Fe2+、Ni2+、Al3+、Zn2+、Cd2+、Fe3+、Na+、Mg2+、Mn2+、Ca2+、Hg2+、K+、Cr3+、Pb2+、Ba2+)分别加入到AuNCs中,随后加入Cu2+,其它金属离子的加入对AuNCs的荧光强度影响较小,表明AuNCs可以高选择性地检测Cu2+,而不受其它离子的干扰。以上实验结果表明,所合成的AuNCs可以高选择性、高灵敏性检测Cu2+。
表1 基于不同纳米材料的分析方法检测Cu2+的性能比较
Table 1 Comparison of analytical performance of analytical methods based on different nanomaterials for detection of Cu2+
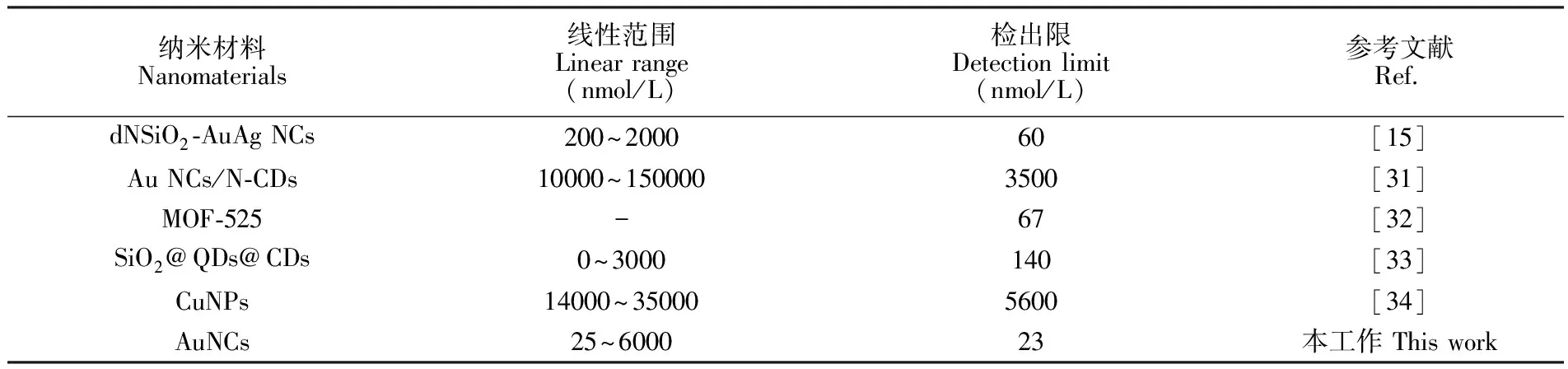
纳米材料Nanomaterials线性范围Linear range(nmol/L)检出限Detection limit(nmol/L)参考文献Ref.dNSiO2-AuAg NCs200~200060[15]Au NCs/N-CDs10000~1500003500[31]MOF-525-67[32]SiO2@QDs@CDs0~3000140[33]CuNPs14000~350005600[34]AuNCs25~600023本工作 This work

图4 (A)AuNCs对不同金属离子的响应情况; (B)干扰离子存在时, AuNCs对Cu2+的响应情况(Cu2+: 3 μmol/L; Hg2+、Cr3+、Fe3+: 15 μmol/L; Pb2+: 12 μmol/L; 其它离子: 30 μmol/L)Fig.4 (A) Response of AuNCs to different metal ions; (B) Fluorescence response of AuNCs in the presence of interfering metal ions to Cu2+ (Cu2+: 3 μmol/L; Hg2+, Cr3+ and Fe3+: 15 μmol/L; Pb2+: 12 μmol/L; others: 30 μmol/L)
3.4 检测机理
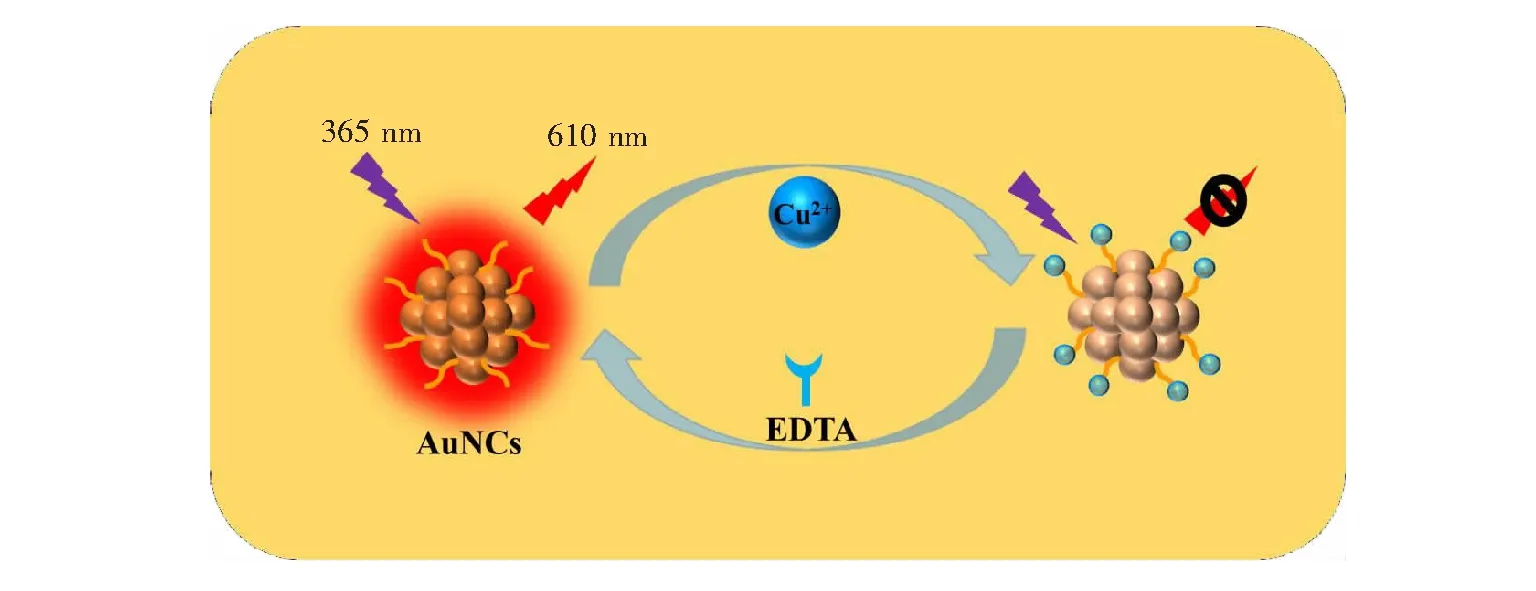
图5 AuNCs检测Cu2+示意图Fig.5 Schematic illustration of detection of Cu2+ with AuNCs

图6 (a)AuNCs、(b)AuNCs + Cu2+(2.5 μmol/L)和(c)AuNCs + Cu2+(2.5 μmol/L)+ EDTA的荧光谱图Fig.6 Fluorescence spectra of (a) AuNCs, (b) AuNCs+Cu2+ (2.5 μmol/L) and (c) AuNCs+Cu2+ (2.5 μmol/L) + EDTA
据文献[18]报道,由于配体-金属间电子转移或配体-金属-金属间电子转移,金属中心的三重态产生辐射跃迁,使AuNCs产生荧光。如图5所示,谷胱甘肽表面包含有大量的氨基和羧基,它们与Cu2+之间有强的配位作用[35],可以将Cu2+络合到AuNCs表面形成复合物,阻断配体-金属间或者配体-金属-金属间的电子转移,导致非辐射跃迁增强,AuNCs的荧光猝灭[36~38],而EDTA与Cu2+之间配位作用强于AuNCs与Cu2+之间配位作用,可将Cu2+从AuNCs表面移除,AuNCs荧光再次恢复。由图6可见,加入Cu2+,使AuNCs的荧光急剧猝灭(曲线b); 加入EDTA后,AuNCs的荧光再次恢复(曲线c)。此实验结果证明,Cu2+阻断配体-金属间电子转移或配体-金属-金属间电子转移,导致AuNCs的荧光猝灭。
3.5 实际样品中Cu2+的检测
为更进一步评估AuNCs荧光纳米传感器在实际样品中检测Cu2+的准确性和可靠性,测定了自来水、血清中Cu2+含量。AuNCs对空白样品没有明显的荧光响应,表明空白样品中不存在或存在的Cu2+含量低于本方法的检出限。实验结果如表2所示,自来水和血清中Cu2+的加标回收率在96.2%~100.1%范围内,表明基于AuNCs荧光纳米传感器可检测实际样品中Cu2+的含量。
表2 实际样品中 Cu2+的测定结果
Table 2 Determination results of Cu2+in real samples

样品Sample加入值Added(nmol/L)测定值Found(nmol/L)回收率Recovery(%)相对标准偏差RSD(%, n=3)自来水Tap water0ND——200.0192.496.21.6500.0496.899.40.42000199699.82.3样品Sample加入值Added(nmol/L)测定值Found(nmol/L)回收率Recovery(%)相对标准偏差RSD(%, n=3)大鼠血清Rat serum0ND——200.0196.098.02.9500.0500.3100.11.02000198499.22.6ND 未检出 Not detectable
4 结 论
制备了一种特异性识别Cu2+的AuNCs荧光纳米传感器。此纳米传感器利用AuNCs表面的氨基和羧基与Cu2+存在强配位作用,阻断AuNCs中的电子转移,猝灭AuNCs的荧光,实现特异性检测Cu2+的目标。AuNCs因其毒性小、水溶性好,在生物成像、生物标记方面具有良好的应用前景。AuNCs发射红色的荧光可避免复杂生物基质背景荧光的干扰,在pH=5.5的条件下, 可实现对Cu2+快速、灵敏、高选择性地检测,提供了一种简便、快速、可靠的检测Cu2+的方法。本方法有望被拓展到疾病诊断、生物成像、生物标记、水质分析等领域。
