基于聚苯胺纳米孔的DNA分析
2020-03-10石晓雨姚付军亢晓峰
赵 怡 石晓雨 孙 红 姚付军 亢晓峰
(西北大学 化学与材料科学学院 合成与天然功能分子化学教育部重点实验室, 西安 710069)
1 引 言
作为一种简单、快速、免标记的生物传感技术[1],纳米孔单分子分析在分析化学[2]、生物物理[3,4]、环境化学[5]等领域受到越来越广泛的关注。纳米孔单分子分析的原理是基于纳米孔阻塞电流变化的幅度和频率,实现对分析对象的分子尺寸、分析物浓度等物理化学性质的定性和定量分析[6]。目前,生物和固态纳米孔已被广泛应用于单分子化学反应、单分子检测以及单分子DNA测序等领域,涉及的研究对象包括金属离子[7,8]、有机小分子[9]、多肽[10]、酶[11]、蛋白质[11]、DNA[12]、RNA[13]等。目前,纳米孔DNA分析面临两个主要挑战: (1) DNA的穿孔速率过快; (2) DNA的穿孔几率较低,限制了纳米孔核酸检测的灵敏度和选择性。为解决这一问题,研究者发展了多种策略,以提高纳米孔对DNA的捕获率或延缓DNA的穿孔速率,包括电压控制、温度控制、盐梯度、pH值调控、采用高粘度缓冲溶液等[14~16]。本研究组以往的研究表明,采用四甲基氯化铵(TMACl)替代传统的KCl溶液,能够有效降低DNA的穿孔速率,并增加纳米孔对DNA的捕获效率[17]。但这些策略多集中于对实验条件的改变,而且会对生物孔所依赖的磷脂双分子层膜的稳定性带来较大的影响。因此,发展一种可进行化学修饰的固体纳米孔分析技术,并将其应用于对DNA的分析检测是非常必要的。
聚苯胺(PANI)是目前研究最广泛的一种导电聚合物。由于具有较好的电化学活性、化学稳定性及生物相容性等特点,PANI成为一种适宜的基底材料制备化学、生物传感器和纳米器件[18,19]。近年来,基于PANI纳米结构和复合材料构建的生物传感器在小分子、DNA和微生物分析检测中展现出良好的信号放大效应和抗干扰特性[20~22]。
2 实验部分
2.1 仪器与试剂
Axopatch 200B膜片钳放大器和1440A A/D数字转换器(美国Axon Instruments公司); 4040A函数发生器(美国BK Precision公司); 6487型皮安计(美国Keithlay公司)。
苯胺(分析纯, ≥99.5%,成都科龙化工试剂厂); (NH4)2S2O8(分析纯, ≥99%,国药集团化学试剂有限公司); 单离子径迹聚碳酸酯膜(PC膜,德国GSI研究所); DNA(上海生物工程股份有限公司); HCl(分析纯,36%~38%, 四川西陇科学有限公司); NaCl(分析纯≥99.5%,国药集团化学试剂有限公司); KCl(分析纯, ≥99.0%,国药集团化学试剂有限公司); LiCl(分析纯, ≥99.5%,天津市科密欧化学试剂开发中心); 三羟甲基氨基甲烷(分析纯, ≥99.5%,北京鼎国昌盛生物技术有限公司); NaOH(分析纯, ≥99.5%, 重庆茂业化学试剂有限公司); 实验用水为超纯水(18.25 MΩ·cm)。DNA序列见表1。
2.2 实验方法
2.2.1 PC膜的刻蚀[24]分别用95%乙醇、水洗涤单离子径迹PC膜。将PC膜固定在电解池中间,用紫外灯在254 nm波长下照射膜的两面各2 h,向电解池两端均加入5 mol/L NaOH刻蚀液。Ag/AgCl作为工作电极,插在PC膜两侧的电极槽中。施加1 V恒定电压,以实时表征单孔的通道电流随刻蚀时间的变化。达到所需电流值时停止刻蚀,并用1 mol/L HCl和超纯水清洗膜,得到单孔PC膜。
表1 本研究所用的DNA序列
Table 1 DNA sequences used in this study
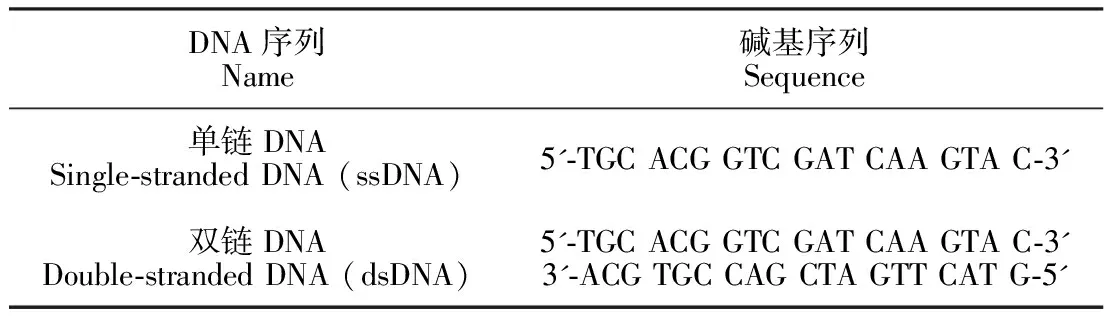
DNA序列Name碱基序列Sequence单链DNASingle-stranded DNA (ssDNA)5'-TGC ACG GTC GAT CAA GTA C-3'双链DNADouble-stranded DNA (dsDNA)5'-TGC ACG GTC GAT CAA GTA C-3'3'-ACG TGC CAG CTA GTT CAT G-5'
2.2.2 聚苯胺修饰单孔PC膜移取275 μL苯胺单体(An)溶于10 mL 1 mol/L HCl溶液中,搅拌均匀后得An-HCl溶液; 向反应池两端各加入2 mL An-HCl溶液,浸泡12 h; 称取0.2282 g (NH4)2S2O8(APS)溶于10 mL 1 mol/L HCl中,搅拌均匀,得到APS-HCl溶液; 吸出反应池一端的An-HCl溶液,并用水洗涤数次后,加入APS-HCl溶液。反应4 h后,依次用乙醇、水清洗,于室温下干燥24 h。
2.2.3 聚苯胺纳米孔的电化学性能检测将单孔PC膜、修饰有聚苯胺的单孔PC膜分别固定在电解池中,Ag/AgCl为工作电极,电解池两端均加入2 mL电解质溶液,用皮安计以扫场方式输出-1~1 V电压,得通道I-V曲线。
2.2.4 DNA的预处理ssDNA、dsDNA粉末样品分别以3000~4000 r/min的转速离心1 min; 向DNA样品离心管中均加入灭菌水,配制浓度为100 μmol/L DNA母液; 高速涡旋2~3 min使DNA溶液混匀; DNA样品加热到95℃,自然冷却至室温; dsDNA需将互补链混匀; 将所得样品于4 ℃保存。
2.2.5 聚苯胺纳米孔DNA分析向电解池两端均加入缓冲液(cis端接地,另一端为trans端),在cis端加入适量DNA,用膜片钳放大器采集穿孔信号,仪器采样频率为100 kHz,滤波频率为3 kHz。使用pClamp10.3和Origin 8.5软件对数据进行统计和分析,平均滞留时间直方图(τoff)满足单指数分布,平均阻塞电流直方图(ΔI)满足高斯分布。
3 结果与讨论
3.1 聚苯胺纳米孔的制备及电化学表征

图1 (A)聚苯胺(PANI)纳米孔检测DNA穿孔过程的示意图,灰色部分为基底-单离子径迹聚碳酸酯膜(PC膜),绿色表示PANI涂层; (B)PANI的化学结构; (C)PC纳米孔刻蚀过程的电流-时间变化,插图为刻蚀电流为0~0.5 nA时的电流-时间曲线; (D)PC纳米孔修饰PANI前后,通道I-V曲线的对比,插图为放大后的PANI纳米孔的通道I-V曲线。实验条件: 1 mol/L KCl, 10 mmol/L Tris-HCl,pH= 7.0Fig.1 (A) Schematic of DNA analysis by polyaniline (PANI) nanopore, Single-ion track polycarbonate membrane (PC membrane) is shown as gray section, PANI is shown as green section; (B) Chemical structure of PANI; (C) The current-time changing for the PC nanopore etching process, the inset is current-time curve between 0 and 0.5 nA; (D) Comparison of single-channel I-V curves between bare nanopore and PANI nanopore, the inset shows I-V curve of PANI nanopore. Experimental condition: 1 mol/L KCl, 10 mmol/L Tris-HCl, pH=7.0
3.2 PANI纳米孔对ssDNA的穿孔行为的研究
采用未修饰且具有相似孔径大小的PC膜纳米孔开展了ssDNA穿孔实验,研究表明,在0.1 mol/L KCl溶液中, +900 mV 电压作用下, 未检测到ssDNA的穿孔信号(图2A)。这可能是由于ssDNA穿孔速率太快,超出了单通道仪器检测的分辨率。然而,将ssDNA加入到聚苯胺纳米孔的检测池中,可以看到明显的电流阻塞信号。修饰聚苯胺后的纳米孔基线波动较大,这可能是由于孔内壁聚苯胺涂层不均匀引起。对照实验结果表明,在ssDNA不存在时,或施加-900 mV电压,无电流阻塞信号产生,证明此信号确实是由ssDNA与聚苯胺纳米孔相互作用产生。图2B为ssDNA穿孔滞留时间柱状图,通过单指数拟合发现,其值为τoff=(1.14 ± 0.05) ms,因此ssDNA的平均穿孔速率约为48.2 μs/base。同其它纳米孔相比(DNA穿孔速率约1~20 μs/base)[17,25~28],DNA在聚苯胺纳米孔的穿孔速率减小2.4~48倍。这是由于带正电荷的聚苯胺与带负电荷的DNA存在着静电相互作用,延缓了DNA的穿孔时间。图2C为ssDNA阻塞电流的柱状图,符合高斯分布,其统计值ΔI= (7.01 ± 0.14) pA。为了验证聚苯胺对ssDNA存在着静电相互作用,进行了聚苯胺纳米孔对ssDNA的静态吸附实验。向缓冲液加入ssDNA(终浓度0.5 μmol/L),经10 h静态吸附后,对PANI纳米孔进行电化学I-V表征。如图2D所示,相比于未进行吸附实验的聚苯胺纳米孔,吸附DNA后的聚苯胺纳米孔在正电压下的电流值变小,而在负电压下电流值变大,并且吸附DNA后,PANI纳米孔几乎不具有整流效应。这是由于PANI纳米孔对DNA的静电吸附作用使得内部的电荷分布发生了变化,孔壁中原本带正电荷的PANI被吸附的DNA覆盖后,表面的电荷发生中和,导致孔壁的净电荷密度减小,因此纳米通道无明显的整流效应。通过研究不同电压下ssDNA的穿孔行为发现,穿孔时间随着电压的增加而逐渐减少,据此可推断ssDNA穿过了聚苯胺纳米孔(图2E)。电压依赖性实验发现,ssDNA的穿孔频率随电压的增加而接近线性增大,表明扩散控制的捕获过程起主导作用(图2F)。进一步的研究表明,在0.1 mol/L KCl溶液中,当施加电压V<700 mV, 几乎检测不到DNA的穿孔信号,这可能是因为ssDNA受到的电场力不足以克服聚苯胺对其的静电吸引力,难以使DNA从管壁内部脱附下来,并穿过纳米通道。另外一个可能的因素是由于低电压产生的电渗流较小,未能驱动ssDNA进入聚苯胺纳米孔,因而也未产生阻塞电流。

图2 ssDNA在PANI纳米孔中的穿孔分析: (A)PANI修饰前后的PC纳米孔对ssDNA分析的trace及特征穿孔信号; (B、C) ssDNA穿孔信号的滞留时间柱状图和振幅柱状图; (D)加入DNA前后,PANI纳米孔通道I-V曲线的变化(使用的电解液为1 mol/L KCl, 10 mmol/L Tris-HCl, pH=7); (E)在PANI纳米孔中,ssDNA的平均滞留时间随电压的变化; (F)聚苯胺纳米孔对ssDNA的捕获率随电压的变化。实验条件: 0.1 mol/L KCl, 10 mmol/L Tris-HCl, pH=7.0; 电压: + 900 mVFig.2 Translocation behavior of ssDNA in PANI nanopore: (A) Current trace and characteristic translocation signal of ssDNA in the nanopore before and after PANI modification (voltage: +900 mV); (B, C) Histograms of dwell time (τoff) and amplitude for ssDNA (0.1 mol/L KCl, 10 mmol/L Tris-HCl, pH=7.0; voltage: +900 mV); (D) I-V curves of PANI nanopore before and after the DNA adsorption experiments (1 mol/L KCl, 10 mmol/L Tris-HCl, pH=7.0); (E) Relationship between mean dwell time of ssDNA with voltage; (F) Capture rate of ssDNA vs voltage
在纳米孔DNA分析中,多采用KCl或NaCl作为电解质溶液,但其穿孔速率过快或穿孔几率过低的缺点影响了纳米孔单分子分析的灵敏度和分辨率。Kowalczyk等[25]研究发现,采用Li+作为ssDNA的抗衡离子,能够有效减小其所带电荷,增加其穿孔时间,分辨率至少提高10倍。最近,Hu等[29]研究表明,Li+可减少蛋白纳米孔对长链ssDNA的捕获能垒,使其穿孔几率增强了10.23倍。
在0.1 mol/L LiCl溶液中,向检测池cis端加入50 nmol/L ssDNA并施加+900 mV的电压后,单通道电流trace及特征阻塞信号如图3A所示。研究表明,相比于0.1 mol/L KCl溶液(τoff=(1.14 ± 0.05) ms),ssDNA在0.1 mol/L LiCl溶液中阻塞电流信号的平均滞留时间统计值(τoff=(1.55 ± 0.14) ms)是其的1.36倍(图3B)。当Li+浓度增加到1 mol/L和3 mol/L时,ssDNA穿孔时间分别增加了2.35倍和8.91倍,其统计值分别为(3.64 ± 0.16) ms和(13.82 ± 0.76) ms。这是因为相比于K+,Li+与ssDNA具有更强的键合作用[27],能有效降低ssDNA链上所带的负电荷,因此,在相同电压下,ssDNA在Li+溶液中受到较小的电泳力作用,导致其穿孔速率减慢。而且随着Li+浓度增加,ssDNA的表面会结合更多的电荷抗衡离子,导致受到的电场驱动力更小,因而穿孔时间更长。虽然DNA表面负电荷的减少使其受到聚苯胺静电作用减小,导致穿孔速率增加,但电场力的主导作用使得ssDNA的滞留时间延长。研究还发现,高浓度Li+能产生更大的ssDNA电流阻塞幅度。ssDNA在不同浓度LiCl中穿孔频率如图3D所示,在0.1 mol/L LiCl(+900 mV)中,ssDNA的穿孔频率为(83.25 ±2.69) s-1,是同浓度KCl溶液中的1.30倍((64.07± 0.05) s-1)。在纳米孔单分子分析中,电渗流(EOF)的大小影响分析物的穿孔频率,当EOF和EP的方向相同时,EOF越大,穿孔频率越大。而EOF的强度依赖于施加在纳米孔两端的电压、电解质的浓度、电解质的类型等因素。以往的研究表明,EOF在LiCl中的强度比在KCl中大[27,30]。因此,在本研究中,施加相同电压(+900 mV)时,ssDNA在0.1 mol/L LiCl中穿孔几率比在同浓度KCl中大。进一步的研究发现,随着Li+浓度增加,ssDNA的穿孔频率降低,这与文献[30]一致[30]。这可能是由于随着盐浓度增加,聚苯胺纳米孔内壁的正电荷受到的屏蔽效应增大,导致孔的离子选择性降低,进而使EOF降低。总之,采用LiCl作为电解质溶液可明显增加聚苯胺纳米孔对ssDNA的捕获率,同时增加ssDNA的穿孔时间。
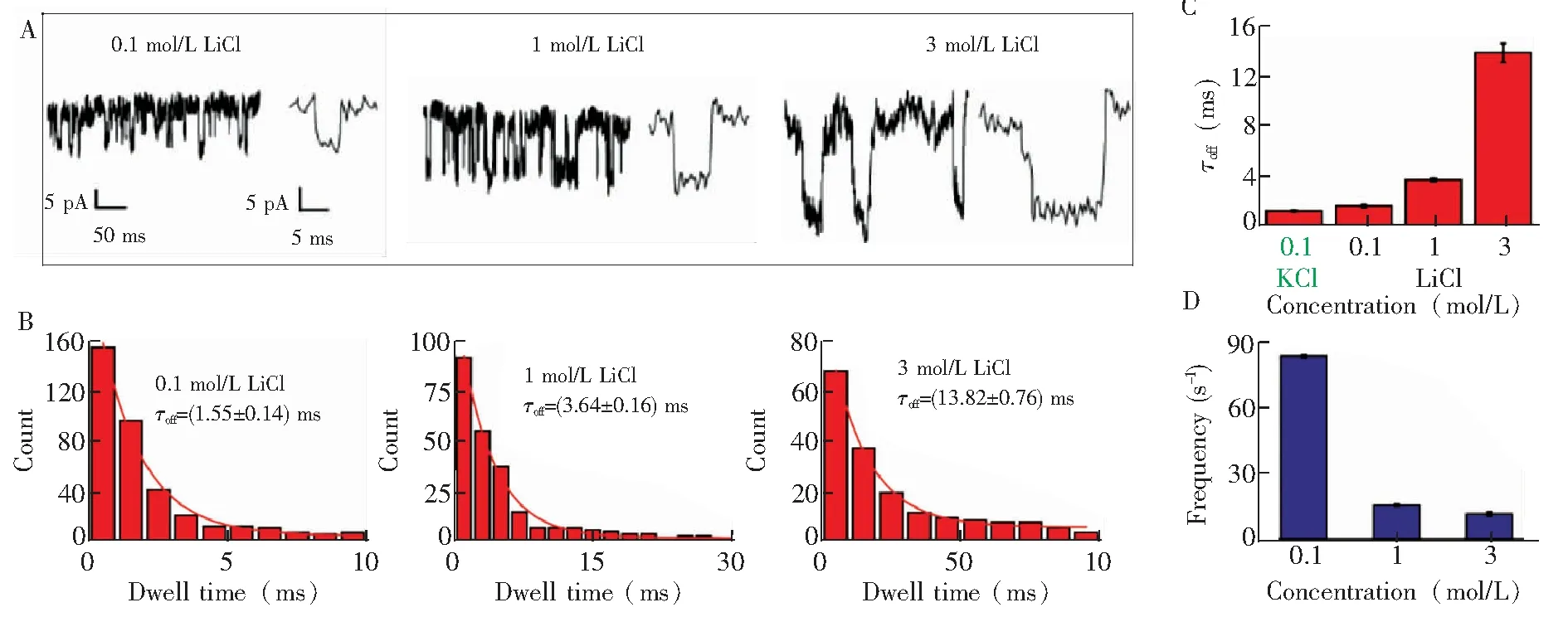
图3 (A,B) ssDNA在不同浓度LiCl盐中穿孔行为、特征阻塞信号及滞留时间柱状图; (C)在0.1 mol/L KCl以及不同浓度的LiCl中,ssDNA穿孔信号的平均滞留时间对比; (D)不同浓度的LiCl中,PANI纳米孔对ssDNA捕获率的比较。检测电压: +900 mVFig.3 (A,B) Typical current trace, characteristic event and dwell time histogram of ssDNA in different concentrations of LiCl; (C) Comparison of mean dwell time of ssDNA in 0.1 mol/L KCl and LiCl; (D) The capture rate of PANI nanopore in various concentrations of LiCl. Detection voltage: +900 mV
3.3 PANI纳米孔对dsDNA穿孔行为的研究
为了进一步拓展聚苯胺纳米孔的应用范围,考察了dsDNA在0.1 mol/L LiCl中的穿孔行为。向检测池中加入50 nmol/L dsDNA后,在电场力的作用下(+900 mV),产生了类似ssDNA的阻塞电流信号(图4A)。图4B和4C是dsDNA滞留时间柱状图和振幅柱状图,分别经单指数拟合和高斯拟合后,获得的统计值为τoff=(1.25 ± 0.11) ms、ΔI=(13.34 ± 0.17) pA。随着电压的增加,dsDNA的穿孔时间逐渐减小,可推断dsDNA也能穿过聚苯胺纳米孔(图4D); 且dsDNA的平均滞留时间比ssDNA短(图4E), 这是因为dsDNA所带负电荷比ssDNA多,受到较强的电场力; 同时,dsDNA的刚性螺旋结构减弱了其与聚苯胺的亲和力,因而能以更快的速率穿过纳米孔。比较二者振幅大小发现(图4F),dsDNA穿过聚苯胺纳米孔产生的阻塞电流幅度大于ssDNA,这是因为dsDNA的直径大于ssDNA的直径,因此,由dsDNA“体积排阻效应”造成的振幅比ssDNA大。由于ssDNA和dsDNA能很好的区分, 因而可以采用聚苯胺纳米孔构建生物传感器,通过设计合适的DNA探针,实现与病理相关的目标DNA的灵敏且快速的检测。
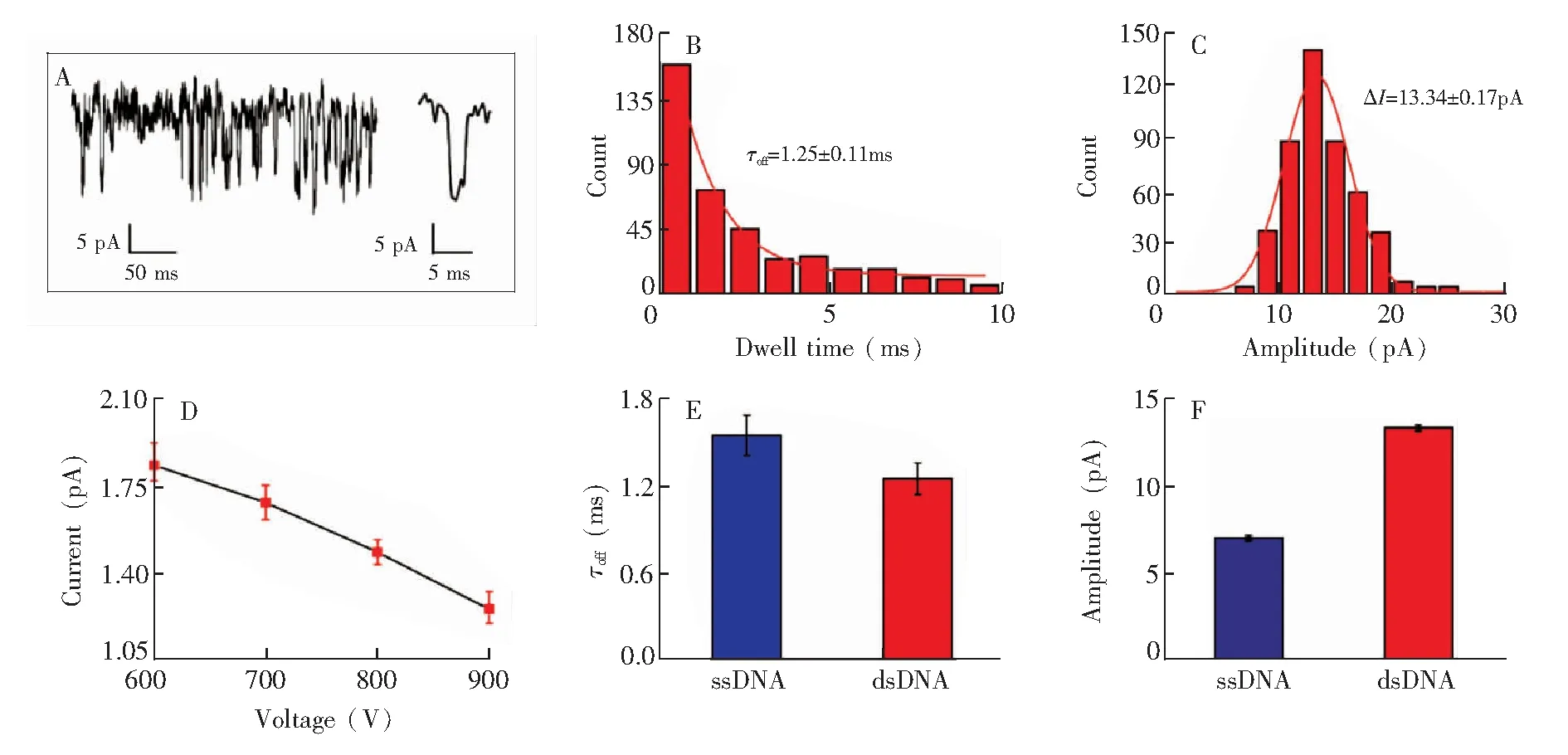
图4 PANI纳米孔对dsDNA分析: (A)dsDNA 穿孔trace图和特征信号; (B)dsDNA的滞留时间柱状图; (C)dsDNA的振幅柱状图; (D)dsDNA 平均滞留时间随电压的变化; (E、F) dsDNA和ssDNA穿孔信号的比较。实验条件为: 0.1 mol/L LiCl (10 mmol/L Tris-HCl, pH=7), 检测电压: +900 mVFig.4 Analysis of dsDNA by PANI nanopore: (A) Current trace and characteristics signal of dsDNA; (B) Dwell time histogram of dsDNA; (C) Amplitude histogram of dsDNA; (D) Relationship between mean dwell time of dsDNA with voltage; (E, F) Comparison of dsDNA and ssDNA. Experimental conditions: 0.1 mol/L LiCl buffered with 10 mmol/L Tris-HCl, pH=7. The applied voltage was +900 mV
4 结 论
采用化学合成法将聚苯胺修饰在固态纳米通道的内壁,研究了ssDNA和dsDNA的穿孔行为究。结果表明,聚苯胺涂层对DNA的静电相互作用是纳米孔对DNA分析具有较高分辨率的主要原因。对电解质类型和浓度的影响的进一步研究发现,LiCl能够延缓DNA的滞留时间,并提高聚苯胺纳米孔的捕获率。本研究提供了一种控制DNA穿孔行为的方法,具有操作简单、价格低廉的优势。
