高效液相色谱/三重四极杆质谱联用法测定血浆和尿液中鹅膏肽类毒素
2020-03-10魏佳会吴弼东陈作红吴剑峰谢剑炜
魏佳会 陈 佳 吴弼东 陈作红 吴剑峰* 谢剑炜*
1(军事科学院军事医学研究院毒物药物研究所, 抗毒药物与毒理学国家重点实验室, 北京 100850)2(中国人民解放军第五医学中心, 北京 100071) 3(湖南师范大学生命科学学院, 长沙 410081)
1 引 言
每年因误食毒蘑菇导致中毒死亡的事件在世界各国时有发生,也是我国食物中毒事件中导致死亡的重要因素之一。可导致中毒的蘑菇种类较多,但引起死亡的主要是鹅膏菌,所占比例高达90%以上[1~4]。致死原因是其中含有的剧毒鹅膏肽类毒素,主要包括3类(鹅膏毒肽、鬼笔环肽、毒伞肽)[5]。鹅膏毒肽为慢性毒素,其主体结构为双环八肽,已鉴定的天然毒素有9种,人的致死剂量约为0.1 mg/kg[6]。其中,α-鹅膏毒肽(α-Amanitin)、β-鹅膏毒肽(β-Amanitin)在鹅膏菌中含量高、毒性强,是主要致死毒素,它们能选择性抑制细胞RNA聚合酶的活性,阻止蛋白质合成,最终导致肝脏等器官坏死[7~9]。鬼笔环肽为双环七肽,属于速效毒素,能专一性地打破丝状肌动蛋白与球状肌动蛋白之间的解聚与装配平衡,动物静脉或腹腔注射后,一般2~5 h后死亡。毒伞肽为单环七肽,其中毒机制与鬼笔环肽一致[10],但目前围绕毒伞肽的相关研究较少。
误食含有鹅膏肽类毒素的毒蘑菇后,其中毒症状具有一定潜伏期,常在肝肾等细胞大量损坏后才出现[11],且鹅膏毒肽在血浆及尿液中代谢快、浓度低,导致常用的检测方法(如荧光检测技术[12,13]、紫外-可见吸收光谱检测技术[14]、放射免疫法[15~18]和酶联免疫吸附法[19,20]等)无法进行有效检测。因此,建立快速、有效的生物样本中毒素的检测方法,对于食物中毒的毒源鉴定和中毒病人的针对性治疗具有重要意义。高效液相色谱(HPLC)因其具有灵敏度高、快速、准确、重现性好等优点,是蘑菇毒素分析检测最常用的检测技术。Maurer 等[21]最先将高效液相色谱(HPLC)应用于毒蘑菇中鹅膏毒肽的分析检测。为提高检测灵敏度,Maurer等[22]采用免疫亲和提取方法分析尿液中的α-Amanitin和β-Amanitin,有效减少了组分之间的相互干扰。陈作红等[23]利用HPLC 对9种主要的肽类毒素(鹅膏毒肽和鬼笔毒肽)进行同时检测,基于各组分色谱峰的保留时间与标样比较以及峰面积与毒素含量之间的线性关系获得肽类毒素的种类和含量。但毒蘑菇样品因其种类较多,所含化学成分复杂,多种毒素同时有效分离困难, 而且仅依赖保留时间比对易出现假阳性结果。液相色谱-质谱联用尤其是串联质谱(Tandem mass spectrometry,MS-MS)联用技术因其具有样品需要量少、高灵敏度、高精确度、高分辨率鉴定和量化目标分析物等突出优势,有效解决了多种蘑菇毒素同时检测及确证等难点问题,已逐渐成为食品与生物样品分析中的主流技术,并被应用于中毒患者体液及生物样本中鹅膏毒肽的检测[3,14, 24~31]。如Filigenzi 等[32]采用液相色谱-多级线性离子阱质谱联用法对中毒后人和动物的血清和肝脏蕈菌毒素进行定性与定量检测,以MS/MS/MS 模式测定血清和肝脏中α-鹅膏毒肽的含量,方法的检出限低于1 ng/g。 Tomková等[33]采用超高效液相色谱-串联质谱(UPLC-MS/MS)检测尿液中α-鹅膏毒肽、β-鹅膏毒肽,检出限可达1 μg/L; Zhang等[34]等采用UPLC-MS/MS测定血浆、血清及尿液中的鹅膏毒肽和鬼笔环肽,检出限低于0.5 μg/L,并通过引入PRiME微洗脱技术,节省了人力和费用。魏佳会等[35]等通过收集12 种剧毒鹅膏菌子实体,优化毒素提取方法, 采用 HPLC 法建立了12 种鹅膏菌的特征指纹图谱, 并引入泼尼松为内标, 比较了各子实体中毒素的相对含量差异; 基于高效液相色谱-电喷雾离子化-四极杆飞行时间质谱(UPLC-ESI-QTOF/MS) 技术对各毒素进行了鉴定。相关文献报道中,检测对象主要为鹅膏毒肽和鬼笔环肽,较少涉及毒伞肽。
本研究基于多种蘑菇毒素对照品,采用高效液相色谱/三重四极杆质谱联用法,通过优化样品前处理方法和分析条件,有效解决了血液和尿液样本中各类毒素提取回收率低的问题, 建立了一种可同时测定血浆和尿液中α-鹅膏毒肽、β-鹅膏毒肽、二羟鬼笔环肽、丙氨酸羟毒伞肽及二羟毒伞肽共3类重要鹅膏肽类毒素的分析方法。本方法具有快速、准确、灵敏和回收率高的优势,每个样品分析时间在10 min内, 可用于鹅膏菌中毒患者生物样本的定性与定量分析,为临床准确识别毒蘑菇中毒提供了技术支持。
2 实验部分
2.1 仪器与试剂
Agilent 1200 HPLC色谱仪、Agilent 6430 三重四极杆质谱仪(美国Aglient公司); RVC 2-33 CD离心浓缩仪(德国Christ公司); KQ 250E超声仪(昆山市超声仪器厂); R200D电子天平(德国Sartorius公司); 3k30高速冷冻离心机(美国Sigma公司); RE-52AA旋转蒸发仪(上海亚荣生化仪器厂); 固相萃取仪(上海科哲仪器有限公司); Oasis HLB固相萃取柱、Oasis WCX固相萃取柱、Oasis Prime uElution HLB 96孔板均购自美国Waters公司。
α-鹅膏毒肽、β-鹅膏毒肽、二羟鬼笔环肽(Phalloidin)均购自美国Sigma公司,纯度>95%; 二羟毒伞肽(Viroidin)、丙氨酸羟毒伞肽(Ala-viroidin)由本实验室制备,纯度>95%[35]; 微囊藻毒素LR Microcystin-LR(分析纯,百灵威科技有限公司); 乙酸铵(98%,美国Acros Organics公司); 甲酸(分析纯,国药集团化学试剂有限公司); 甲醇、乙腈(色谱纯,德国Merck公司).实验用水为超纯水(电阴率为18.2 MΩ cm),由MilL-Q 10 超纯水机(美国Millipore公司)制备。中毒患者血尿样品由湖南省湘雅医院和湖南省人民医院采集提供,0℃冰包运至本实验室后,于-20℃保存,备用。
2.2 样品前处理
采用固相萃取对样品进行预处理[32],具体操作步骤如下:选用固相萃取小柱HLB (1 mL,30 mg),用1 mL甲醇、1 mL水依次活化,静置平衡; 取500 μL样品(血浆或尿样)用超纯水稀释至1 mL,上样,缓慢通过萃取柱,1 mL 5%甲醇(V/V)淋洗,2 mL 100%甲醇(V/V)分步洗脱,洗脱液在60℃下旋转蒸发至干。加入内标微囊藻毒素(浓度为 1 μg/mL)10 μL,以90 μL 10%甲醇(V/V)复溶,14000 r/min离心,取上清液进行检测。
2.3 毒素对照品的提取与分离
将采自云南、贵州、湖南等地的毒蘑菇干子实体研磨成粉末状(部分样品由湖南师范大学陈作红教授提供),参照文献[35]中所述毒素提取方法处理样品: 称取2 g粉末于50 mL离心管中,加30 mL 含0.5%甲酸的50%(V/V)甲醇,室温下,240 r/min振摇12 h,14000 r/min离心10 min,沉淀加入30 mL提取液,超声30 s,同法离心,合并两次上清液,旋转蒸发至近干,加入1 mL水复溶,同体积石油醚去脂,再次旋干后,用50%甲醇溶液复溶,过滤,得样品提取液。采用制备液相色谱对提取液进行分离,色谱柱为Unisil 10-120 C18(21.2 mm×250 mm,21.2 μm); 流动相A为水,B为甲醇,采用梯度洗脱(0~40 min, 10%~50% B; 40~60 min, 50% B; 60~65 min, 50%~10% B); 流速15 mL/min; 柱温: 40℃; 进样量:1 mL; 检测波长:295 nm。将收集的各组分经液相色谱-质谱联用鉴定后,旋转蒸发至近干,再进行冷冻干燥,获得毒素参考品。采用液相色谱及核磁共振对纯度进行表征,纯度不低于95%。
2.4 鹅膏肽类毒素的液相色谱分离条件
色谱柱:Capcell Core C18(2.1 mm×100 mm, 2.7 μm),保护柱:F3643 EXP Guard Cartridge Capcell Core C18S-2.7(2.1 mm×5 mm, 2.7 μm); 流动相A为10 mmol/L乙酸铵溶液,B为甲醇,采用梯度洗脱(0~0.5 min,15%B; 0.5~5.0 min,15%~60% B; 5.0~6.0 min,60%~70% B; 6.0~9.5 min, 70% B; 9.5~9.6 min, 70%~15% B); 流速为 0.3 mL/min; 柱温40℃; 进样量10 μL。
2.5 鹅膏肽类毒素的质谱检测条件
电喷雾离子源(ESI); 正离子多反应监测(MRM)模式; 离子源温度: 100℃; 雾化气温度: 325℃; 雾化气气流; 10.0 L/min; 喷雾电压: 275 kPa; 毛细管电压: 4 kV; 其它参数见表1。
表1 质谱的MRM 参数
Table 1 Mass spectrometry (MS) parameters for multiple reaction monitoring

毒素Toxins监测离子对Mass transitions(m/z)碎片电压Fragmentor(V)碰撞能Collision energy(eV)β-鹅膏毒肽 β-Amanitin920.4/259920.4/862505080α-鹅膏毒肽 α-Amanitin919.4/259919.4/862505080丙氨酸羟毒伞肽 Ala-viroidin869.4/237869.4/1582505080二羟鬼笔环肽 Phalloidin789.3/330789.3/1572504565二羟毒伞肽 Viroidin897.4/40897.4/237897.4/158250405080微囊藻毒素LR Microcystin-LR995.3/218995.3/1341807075
3 结果与讨论
3.1 内标的选择
为建立鹅膏肽类毒素的定量检测方法,参照文献[36~40],首先对内标进行了筛选和优化。考虑到鹅膏肽类毒素为环状多肽,且一般宜选结构类似物作为内标。本研究选取了利福平、微囊藻毒素RR(MC-RR)、微囊藻毒素LR(MC-LR)等主体结构均为大环多肽的化合物作为内标候选对象。 实验结果表明,MC-LR的提取回收率、色谱保留时间及质谱离子化效率均优于利福平和MC-RR,因此,最终选择MC-LR作为校正内标。
3.2 样品前处理方法优化
由于血浆及尿液中鹅膏肽类毒素含量较低,一般较难进行直接检测,需对其中所含的肽类毒素进行富集净化处理。参照文献[34,41~44]中的样品预处理方法,对于血浆样品,首先考察了直接以乙腈为沉淀剂的提取效果,结果表明,α-鹅膏毒肽和β-鹅膏毒肽的回收率均低于50%。固相萃取柱是生物样本分析中最常用的分离富集方法,本研究比较了Prime HLB μElution 96孔板、Waters Oasis HLB和Waters Oasis WCX共3种萃取小柱的提取效果,结果表明,Waters Oasis HLB对鹅膏毒肽、鬼笔环肽及毒伞肽的提取回收率均可达93.0%以上。分别考察了淋洗液和洗脱液对鹅膏肽类毒素净化效果的影响,结果表明,淋洗液和洗脱液分别为甲醇-水(5∶95,V/V)和甲醇时,各毒素提取回收率最高,为使提取完全,最终选用2 mL甲醇进行分步洗脱。优化后的前处理条件为:Waters Oasis HLB萃取小柱分离,淋洗液为5%甲醇溶液,洗脱液为2 mL甲醇,优化提取效率的结果如图1所示。基于上述前处理方法,对于尿液样本,还考察了微孔滤膜过滤-直接进样的方式,结果表明,基质干扰严重而且毒素损失多,故最终血浆、尿液都采用固相萃取分离方法对样品进行净化。

图1 4种提取方法的提取效果对比图Fig.1 Comparison of extration efficiency of four kinds of extraction methods
3.3 高效液相色谱分离条件优化
分别采用水-甲醇、水-乙腈、10 mmol/L乙酸铵-甲醇作为流动相,在CAPCELL PAK C18(2.1 mm ×100 mm, 2.7 μm)、CAPCELL PAK AQ(2.1 mm ×100 mm, 2.7 μm)色谱柱上进行分离,结果表明,采用CAPCELL PAK C18(2.1 mm ×100 mm, 2.7 μm)色谱柱时,各毒素分离效果最佳。流动相中含一定比例乙腈时,其洗脱能力过强,导致β-鹅膏毒肽、α-鹅膏毒肽保留时间过于集中,色谱峰无法完全分离; 而将乙腈更换为10 mmol/L乙酸铵溶液时,有效改善了各鹅膏毒肽色谱峰形,分离效果明显改善,最终确定流动相A为10 mmol/L乙酸铵溶液,流动相B为甲醇; 通过优化梯度洗脱程序,实现了5种鹅膏类毒素的完全分离,且一次梯度洗脱分析仅需10 min, 5种毒素分离的总离子流色谱图如图2所示。

图2 5种毒素分离的总离子流色谱图1. α-鹅膏毒肽; 2. β-鹅膏毒肽; 3. 二羟鬼笔环肽; 4. 丙氨酸羟毒伞肽; 5. 二羟毒伞肽MC-LR微囊藻毒素-LRFig.2 High performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS) chromatograms of five amanita peptide toxins1, α-Amanitin; 2, β-Amanitin; 3, Phalloidin; 4, Ala-viroidin; 5, Viroidin; MC-LR: Microcystin-LR
3.4 质谱条件优化
在电喷雾正离子模式MRM多反应监测模式下,优化各项质谱参数,使目标分析物离子的信号达到最佳。确定各毒素以及内标的母离子, 根据离子对的丰度确定最佳碎片电压(Fragmentor)以及碰撞电压(CE)等。各毒素均监测两对特征离子对,其中丰度最大的作为定量离子对。 优化后的质谱参数见表1。
3.5 线性范围、检出限及定量限
以空白血浆及尿液配制浓度分别为5、20、50、100、250和500 μg/L的样品,采用HPLC-MS/MS检测,根据信噪比(S/N)大于3的标准确定检出限(LOD),信噪比(S/N)大于10的标准确定定量下限(LLOQ)。如表2所示,α-鹅膏毒肽和β-鹅膏毒肽在血浆和尿液中的检出限均为0.5 μg/L,定量下限均为5 μg/L,线性范围均为5~500 μg/L; 丙氨酸羟毒伞肽、二羟鬼笔环肽以及二羟毒伞肽在血浆、尿液中的检出限均为0.2 μg/L,在血浆、尿液中的定量下限分别为2 和1 μg/L,其定量上限均为500 μg/L; 5种鹅膏毒肽在各自浓度范围内均呈良好线性关系,相关系数(r)为0.9990~0.9998。本方法可同时测定血浆/尿液基质中包括鹅膏毒肽、鬼笔环肽以及毒伞肽在内3类鹅膏肽类毒素,灵敏度高、线性范围宽, 能够满足公共卫生突发事件、法医毒物学和临床毒物学检测的需要。
表2 血浆与尿液样品中鹅膏毒肽分析方法的线性方程、检出限及定量下限
Table 2 Calibration curves, detection limits and quantitation limits for amainta peptide toxins in plasma and urine sample

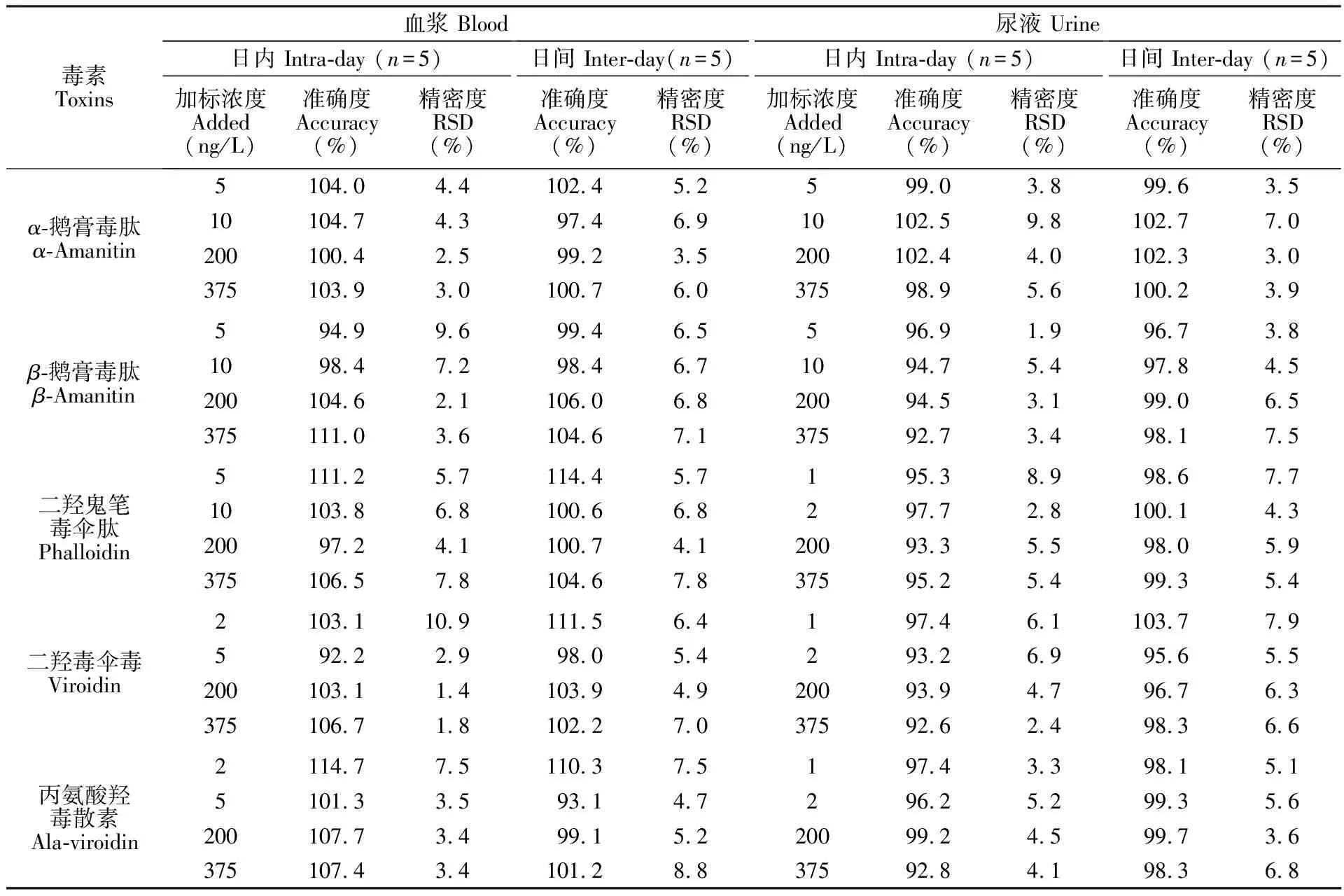
3.6 准确度和精密度
采用人空白血浆和尿液进行准确度和精密度实验,按照生物分析方法学指导原则[45],回收率和精密度采用定量下限(LLOQ)样品和质控样品进行评估,包括批内回收率、精密度和批间回收率、精密度。每个分析批次包括4个浓度水平分别为定量下限(LLOQ)、低浓度质控样品(LQC)、中浓度质控样品(MQC)和高浓度质控样品(HQC),每个浓度点由5份独立样品组成,在血浆及尿液中分别加入5种毒素的混合标准溶液以及内标溶液,处理后进样检测。根据线性范围配置4点不同浓度的质控(QC)样品,混合均匀后,再按样品前处理方法进行操作,色谱分析结果见表3,血浆中各毒素的准确度为92.2%~114.7%, RSD在1.4%~10.9%之间; 尿液中的准确度为92.6%~103.7%,RSD在1.9%~9.8%之间。上述结果表明,所建立的液相色谱质谱联用分析方法准确、可靠,符合分析方法的要求。
表3 血浆和尿液样品中鹅膏毒肽分析方法的准确度和精密度
Table 3 Accuracy and precision of this method for detection of Amainta toxins in plasma and urine
毒素Toxins血浆 Blood日内 Intra-day (n=5)加标浓度Added(ng/L)准确度Accuracy(%)精密度RSD(%)日间 Inter-day(n=5)准确度Accuracy(%)精密度RSD(%)尿液 Urine日内 Intra-day (n=5)加标浓度Added(ng/L)准确度Accuracy(%)精密度RSD(%)日间 Inter-day (n=5)准确度Accuracy(%)精密度RSD(%)α-鹅膏毒肽α-Amanitinβ-鹅膏毒肽β-Amanitin二羟鬼笔毒伞肽Phalloidin二羟毒伞毒Viroidin丙氨酸羟毒散素Ala-viroidin5104.04.4102.45.2599.03.899.63.510104.74.397.46.910102.59.8102.77.0200100.42.599.23.5200102.44.0102.33.0375103.93.0100.76.037598.95.6100.23.9594.99.699.46.5596.91.996.73.81098.47.298.46.71094.75.497.84.5200104.62.1106.06.820094.53.199.06.5375111.03.6104.67.137592.73.498.17.55111.25.7114.45.7195.38.998.67.710103.86.8100.66.8297.72.8100.14.320097.24.1100.74.120093.35.598.05.9375106.57.8104.67.837595.25.499.35.42103.110.9111.56.4197.46.1103.77.9592.22.998.05.4293.26.995.65.5200103.11.4103.94.920093.94.796.76.3375106.71.8102.27.037592.62.498.36.62114.77.5110.37.5197.43.398.15.15101.33.593.14.7296.25.299.35.6200107.73.499.15.220099.24.599.73.6375107.43.4101.28.837592.84.198.36.8
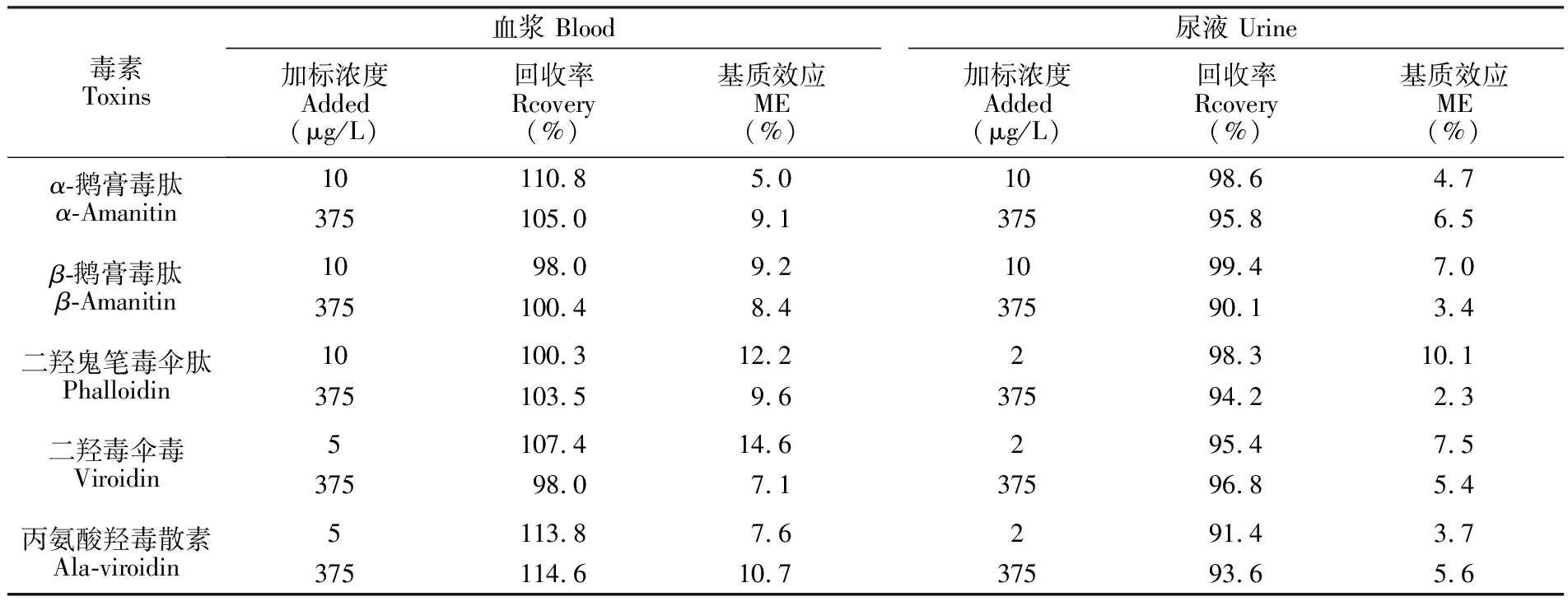
3.7 基质效应和回收率
当采用液相色谱质谱法对生物样品进行检测时,常存在较严重的基质干扰。考察了6批来自解放军总医院第五医学中心的正常血浆,以及低质控(LQC)、高质控(HQC)两个浓度水平,每个浓度水平独立配制3份。将5种混合标准溶液配制在初始比例的流动相中得到样品A; 对空白血浆、尿液进行处理得到空白基质,再在空白基质中加入5种毒素混合标准溶液得到样品B; 在空白的血浆、尿液中加入5种毒素混合标准溶液后再进行处理得到样品C; 对样品A和B同时进行检测,响应值[(B-A)/A×100%]即为基质效应(ME),对B和C同时进行检测,响应值C/B即为回收率(RE)。结果如表4所示, 血浆和尿液中5种毒素的回收率为90.1%~114.6%,除个别添加浓度稍有基质效应外,其它条件下基质不影响血浆或尿液中各种鹅膏肽类毒素的检测,满足测定要求。
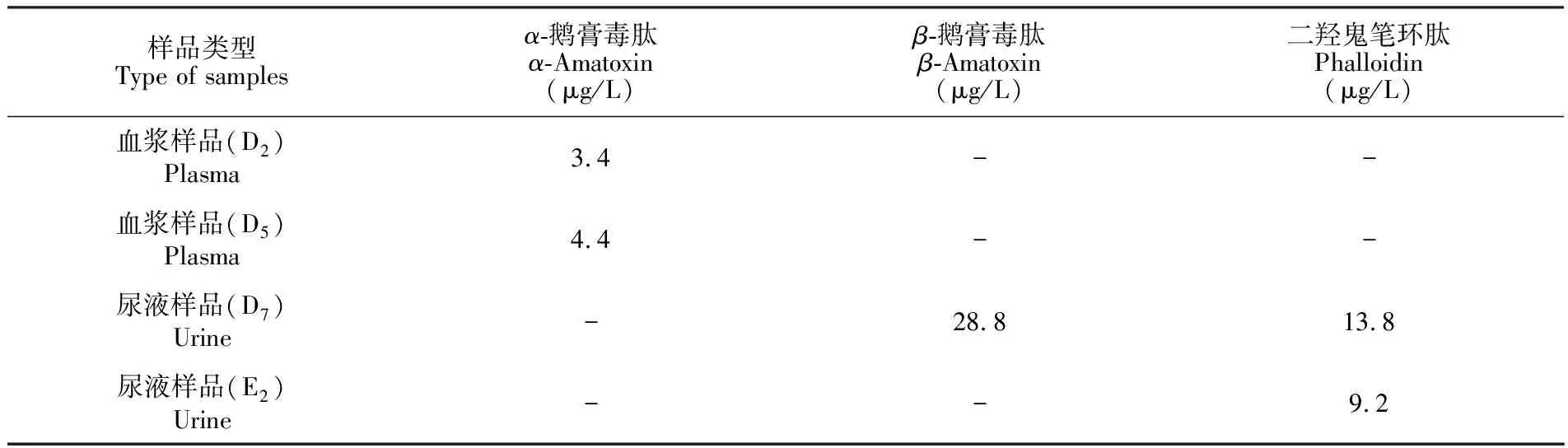
3.8 实际中毒样品分析
采用优化的液相色谱质谱方法对9名疑似毒蘑菇中毒患者的血浆及尿液样品进行了分析。样品采样时间在食用后48~72 h,在不同时间点采集了11份血浆与18份尿液样品,按人员以A至M进行编号(如D1~Dn为同一人的样品),检测结果如表5所示,仅在一位中毒患者不同时间点采集的两份血浆样品中检出α-鹅膏毒肽(D2与D5),含量分别为3.4和4.4 μg/L,其尿液样品中还检出β-鹅膏毒肽和二羟鬼笔环肽,含量分别为28.8和13.8 μg/L; 另一患者仅在其尿液样品中检出二羟鬼笔环肽,含量为9.2 μg/L。所采集的血浆及尿液样品中均未检出毒伞肽。
表4 血浆及尿液样品的回收率与基质效应
Table 4 Recoveries and matrix effect (ME) of amainta peptide toxins in urine and plasma sample(n=3)
毒素Toxins血浆 Blood加标浓度Added(μg/L)回收率Rcovery(%)基质效应ME(%)尿液 Urine加标浓度Added(μg/L)回收率Rcovery(%)基质效应ME(%)α-鹅膏毒肽α-Amanitinβ-鹅膏毒肽β-Amanitin二羟鬼笔毒伞肽Phalloidin二羟毒伞毒Viroidin丙氨酸羟毒散素Ala-viroidin10110.85.01098.64.7375105.09.137595.86.51098.09.21099.47.0375100.48.437590.13.410100.312.2298.310.1375103.59.637594.22.35107.414.6295.47.537598.07.137596.85.45113.87.6291.43.7375114.610.737593.65.6
表5 9名疑似毒蘑菇中毒患者的血浆及尿液中毒样品的检测结果
Table 5 Detection results of plasma and urine samples from 9 suspected poisoning patients by mushroom
样品类型Type of samplesα-鹅膏毒肽α-Amatoxin(μg/L)β-鹅膏毒肽β-Amatoxin(μg/L)二羟鬼笔环肽Phalloidin(μg/L)血浆样品(D2)Plasma3.4--血浆样品(D5)Plasma4.4--尿液样品(D7)Urine-28.813.8尿液样品(E2)Urine--9.2
4 结 论
基于高效液相色谱/三重四极杆质谱联用技术,采用固相萃取前处理方式,建立了可同时检测血浆及尿液中α-鹅膏毒肽、β-鹅膏毒肽、二羟鬼笔环肽、二羟毒伞肽、丙氨酸羟毒伞肽共3类5种鹅膏肽类毒素的分析方法。本方法具有净化效果好、回收率和灵敏度高、涉及毒素范围广和适用性强等优势,能够满足鹅膏肽类毒素定性与定量分析的要求,为毒蘑菇中毒事件的诊断及救治提供了重要的技术支持。
