醚基高铼酸盐离子液体的催化性能研究
2020-03-10马晓雪梁坤豪魏杰宋宗仁肖传佑巩璐房大维
马晓雪,梁坤豪,魏杰,宋宗仁,肖传佑,巩璐,房大维
(辽宁大学化学院,稀散元素研究所,辽宁沈阳110036)
引 言
随着绿色化学与催化化学的不断发展,新型绿色溶剂——离子液体凭借着蒸气压低、不易燃、热稳定性好、溶解能力强等[1-7]优良特性,在化学反应[8-10]、萃取分离[11-14]、气体吸收[15-18]、材料科学[19-20]和电化学[21-22]等方面显示出了良好的特性和广阔的应用前景。此外,离子液体具有可设计性,根据需要可以通过改变阴阳离子的种类或引入特定官能团来制备具有特殊功能的离子液体,如向离子液体的阳离子上引入烷氧基,不仅可以降低黏度[23-25],还可以降低熔点[26],增大极性[27]。
环氧化合物是一类极其重要且用途很广的有机合成中间体,广泛应用于石油化工、精细化工、制药和高分子合成材料等领域。烯烃的环氧化[28-30]是合成环氧化合物的重要途径,但是现阶段使用的金属络合物催化剂存在选择性低、催化剂自身稳定性低、易氧化降解,不易回收等缺点。
近年来,不可再生资源过度消耗,环境污染日趋严重,人们越来越注重绿色生产与可持续发展。因此,设计合成一种兼具离子液体和稀散金属独特催化性能的新型功能材料,并将其应用于催化反应,这样不仅可以缩短反应时间,还能提高反应的转化率和选择性,为创建绿色化学反应提供了新机遇[31]。
1 实验部分
1.1 化学试剂
N-乙基咪唑、2-氯乙基甲基醚、2-氯乙基乙基醚、高铼酸铵、氯仿、乙酸乙酯、顺式环辛烯、过氧化脲(UHP)和正己烷均为AR 级试剂,717 型阴离子交换树脂,均采购自上海国药集团化学试剂有限公司(中国)。
1.2 [C22O1Im][ReO4]和[C22O2Im][ReO4]离子液体的合成及表征
首先,根据文献方法[32]合成1-(2-甲氧基乙基)-3-乙基咪唑氯盐([C22O1Im]Cl)和1-(2-乙氧基乙基)-3-乙基咪唑氯盐([C22O2Im]Cl)前体。利用阴离子交换法,制备中间体1-(2-甲氧基乙基)-3-乙基咪唑氢氧根盐([C22O1Im]OH)和中间体1-(2-乙氧基乙基)-3-乙基咪唑氢氧根盐([C22O2Im]OH),将摩尔比为1:1.1 的中间体[C22O1Im]OH 或[C22O2Im]OH 与NH4ReO4混合,在70℃反应6 h,产物用氯仿洗涤3次,多余溶剂旋蒸除去,干燥,最终制得淡黄色透明液体。合成过程如图1所示。
最终产物分别用核磁共振氢谱(1H NMR)、核磁共振碳谱(13C NMR)、拉曼光谱(Raman)、电喷雾电离质谱(ESI-MS)、差示扫描量热(DSC)等分析手段进行表征,验证产物的结构和纯度。
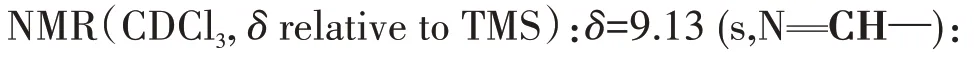
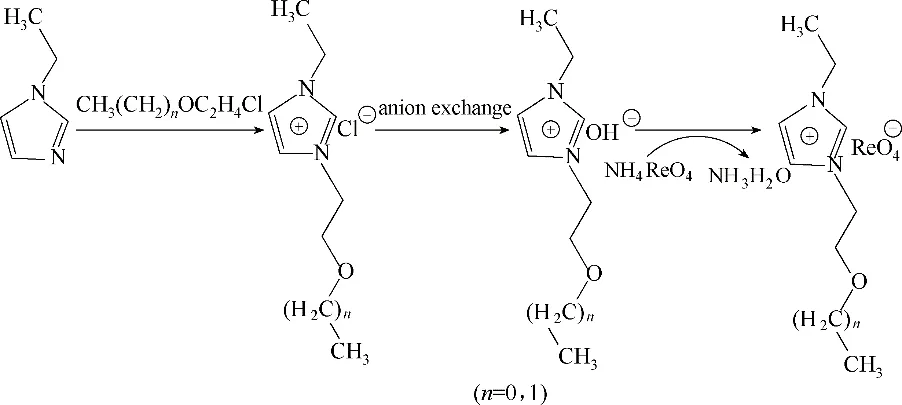
图1 离子液体[C22O1Im][ReO4]和[C22O2Im][ReO4]的合成路线Fig.1 Synthetic route of ionic liquids[C22O1Im][ReO4]and[C22O2Im][ReO4]

综上,最终产物为目标离子液体[C22O1Im][ReO4]和[C22O2Im][ReO4],纯度均大于99.5%。
1.3 催化反应产物分析
通过气相色谱(GC,SP-2100,北分华谱分析仪器有限公司)对反应产物进行检测。气相色谱条件:氢火焰检测器(FID),弱极性毛细管柱(30 m ×0.32 mm × 0.25 μm),初始温度50℃,以20℃/min 速率升温至190℃。
2 实验结果与讨论
2.1 离子液体[C22O1Im][ReO4]和[C22O2Im][ReO4]催化环辛烯环氧化反应体系建立
在催化评价反应装置中,以环辛烯作为反应底物,过氧化脲为氧化剂,离子液体[C22O1Im][ReO4]和[C22O2Im][ReO4]作为反应的催化剂兼溶剂,建立环辛烯环氧化反应体系(图2),利用归一化法测得反应中环氧化物的产率。
2.2 离子液体[C22O1Im][ReO4]和[C22O2Im][ReO4]催化环辛烯环氧化反应的单因素实验
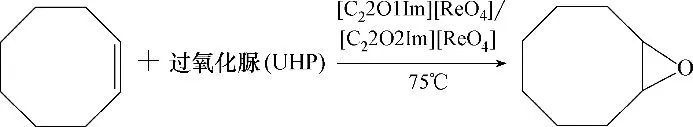
图2 离子液体[C22O1Im][ReO4]和[C22O2Im][ReO4]催化环辛烯环氧化Fig.2 Epoxidation of cyclooctene catalyzed by ionic liquids[C22O1Im][ReO4]and[C22O2Im][ReO4]
在环辛烯环氧化生成环氧环辛烷的反应中,由环辛烯为反应底物,过氧化脲为氧化剂,铼离子液体作为反应的催化剂兼溶剂,组成均相催化体系。主要考察离子液体用量、反应温度、反应时间、氧化剂用量和离子液体循环次数等因素对反应产率和反应选择性的影响。
2.2.1 催化剂对产率的影响 底物环辛烯与氧化剂过氧化脲的摩尔比为1∶2.7,反应温度75℃,分别考察了[C22O1Im][ReO4](反应时间为10 h)和[C22O2Im][ReO4](反应时间5 h)催化剂用量对反应产率的影响,结果如图3所示。

图3 催化剂用量对催化产率的影响Fig.3 Effect of amount of catalyst on catalytic yield
随着离子液体[C22O1Im][ReO4]和[C22O2Im][ReO4]用量的不断增加(0.6、0.7、0.8、0.9、1.0 ml),环辛烯环氧化的催化产率先升高后略有降低。当[C22O1Im][ReO4]和[C22O2Im][ReO4]用量为0.8 ml 时,环氧环辛烷的产率分别为85.95%、93.62%,均为最大值。随着离子液体用量的增加,反应速率不再加快,催化产率略有减小。因此,选择该反应体系的最佳离子液体用量为0.8 ml。
实验结果表明,加入较少量离子液体时,催化剂浓度较小,所含活性中心也较少,催化效果较差。同时离子液体兼作反应体系的溶剂,溶剂量较少,导致反应体系中的各物质溶解不充分,反应速率较慢,产率较低。随着离子液体用量的不断增加,反应体系内的催化剂浓度增大,体系中各物质接触充分,进而提高反应速率,实现产率最大化。但是,当离子液体用量增大到一定程度,催化剂的浓度达到了饱和状态,产率将不再受催化剂浓度的影响,且溶剂过多也稀释了反应体系,使得各物质浓度降低,从而导致反应速率降低,催化产率略有减少。
2.2.2 反应时间对催化产率的影响 底物环辛烯与氧化剂过氧化脲的摩尔比为1∶2.7,催化剂兼溶剂的离子液体[C22O1Im][ReO4]和[C22O2Im][ReO4]用量分别为0.8 ml,75℃条件下,考察反应时间对环辛烯环氧化反应的催化产率的影响,结果如图4所示。
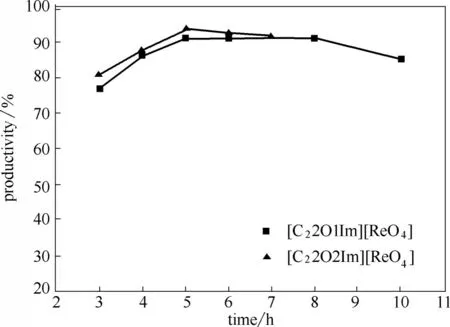
图4 反应时间对催化产率的影响Fig.4 Effect of reaction time on catalytic yield
[C22O1Im][ReO4]体系的反应时间为3、4、5、6、8、10 h,[C22O2Im][ReO4]体系的反应时间为3、4、5、6、7 h。由图4可知,两个体系分别随着反应时间的不断增加,环辛烯环氧化的催化产率均呈现先增大后减小。
实验结果表明,反应时间较短时,催化剂活性不高,反应体系中的各物质混合得不够均匀,随着反应时间的延长,整个反应体系的各物质混合程度不断提高,接触程度不断增大,催化剂催化效率不断提高,反应速率加快。随着反应时间的不断延长,生成的部分环氧环辛烷发生开环反应生成了副产物,导致产率略有下降。
2.2.3 反应温度对催化产率的影响 底物环辛烯与氧化剂过氧化脲的摩尔比为1∶2.7,催化剂兼溶剂的离子液体[C22O1Im][ReO4]和[C22O2Im][ReO4]用量分别为0.8 ml,反应时间5 h,考察反应温度对环辛烯环氧化反应的催化产率的影响,结果如图5所示。
随着反应温度的升高(65、70、75、80、85℃),环辛烯环氧化的产率先升高后降低。当反应温度升高到75℃时,两个体系的产率均达到最大值,分别为91.18%和93.62%。因此,该反应体系的最佳反应温度为75℃。
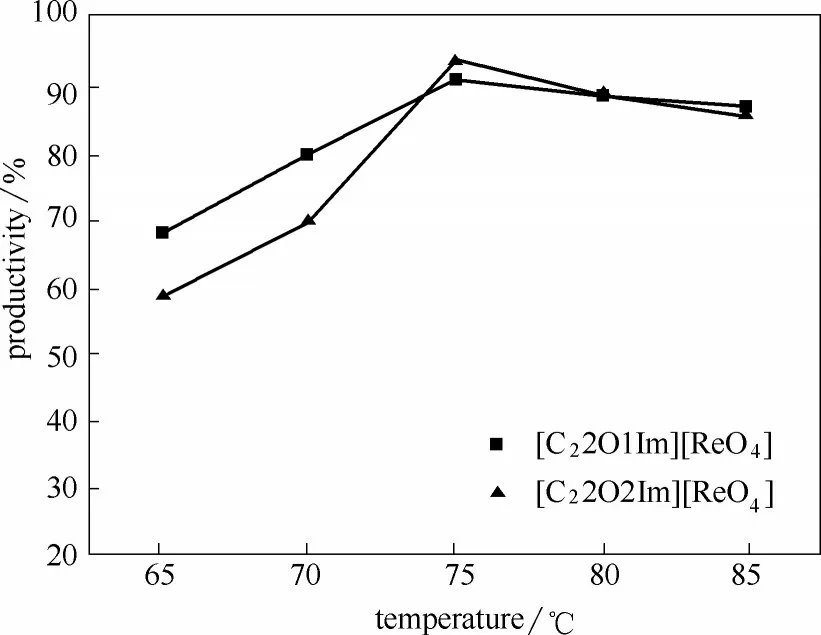
图5 反应温度对催化产率的影响Fig.5 Effect of reaction temperature on catalytic yield
实验结果表明,当催化体系的反应温度较低时,催化剂的活性较低,随着温度不断升高,催化剂的非活性中心被激发转化为活性中心,其催化活性逐渐提高,反应产率不断增大。当温度达到75℃时,该反应体系的活化性能最高,催化效果最好,产率最高。随着温度继续升高,反应体系的平衡被破坏,影响了催化剂在体系中的催化活性,导致催化产率开始降低。
2.2.4 氧化剂用量对催化产率的影响 催化剂兼溶剂的离子液体[C22O1Im][ReO4]和[C22O2Im][ReO4]用量分别为0.8 ml,75℃条件下反应时间5 h,反应底物环辛烯用量1 mmol,考察反应温度对环辛烯环氧化反应的催化产率的影响,结果如图6所示。
随着氧化剂过氧化脲用量的不断增加(1.5、2.1、2.5、2.7、3.3、3.9 mmol),环辛烯环氧化的产率先大幅升高然后略有下降。当氧化剂用量为2.7 mmol时,两个体系的催化产率均为最大,分别为91.18%和93.62%。因此,确定两个体系的氧化剂最佳用量为2.7 mmol。
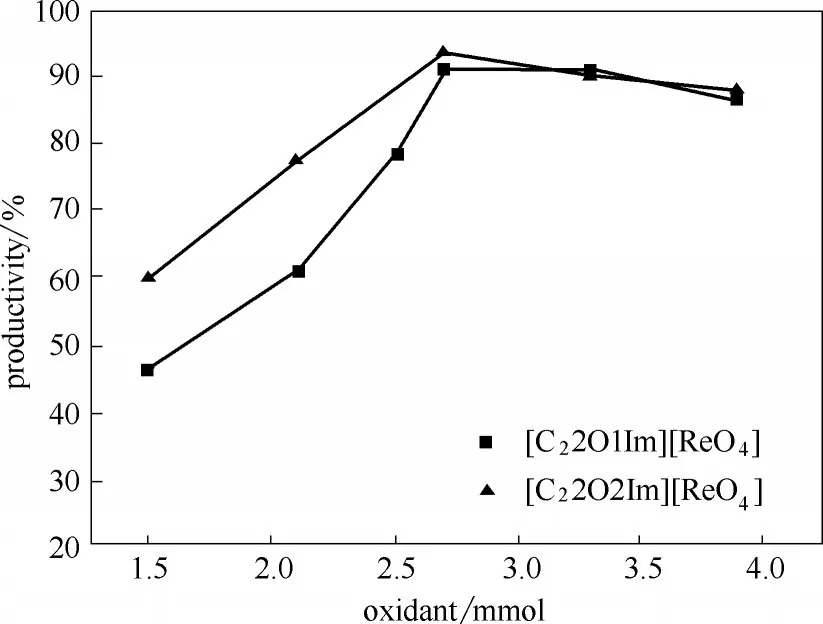
图6 氧化剂过氧化脲用量对催化产率的影响Fig.6 Effect of amount of oxidant urea peroxide on catalytic yield
实验结果表明,氧化剂用量较少时,不能给反应体系提供充足的“氧”源,随着氧化剂用量的不断增加,体系内氧化剂的浓度逐渐增大,使得反应速率迅速提高,产率达到最大。但是当氧化剂的浓度继续增大到一定程度时,体系中的“氧”需求达到了饱和状态,过多的氧化剂反而稀释了反应底物的浓度,且反应生成的尿素积累过多影响了反应的进行,导致产率有所下降。
2.2.5 离子液体循环使用次数对催化产率的影响离子液体是一种稳定性高,不易挥发的绿色溶剂,此反应体系中离子液体[C22O1Im][ReO4]和[C22O2Im][ReO4]作为溶剂兼催化剂,可以循环使用大大降低生产成本。分别用正己烷和氯仿作为萃取剂,将萃取后的离子液体[C22O1Im][ReO4]和[C22O2Im][ReO4]循环使用,在上述反应的最佳条件下,考察萃取后的离子液体循环使用次数对环辛烯环氧化反应的催化产率的影响,结果如图7所示。
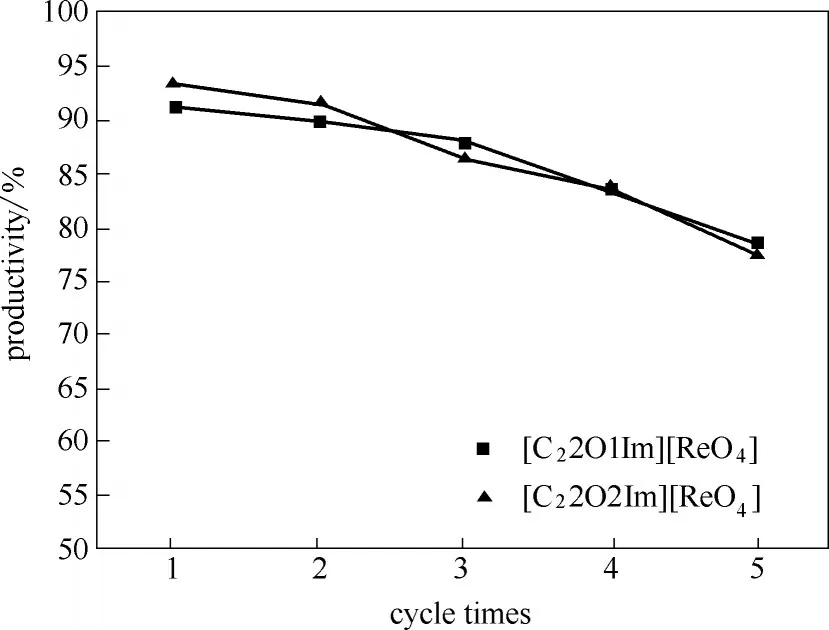
图7 离子液体循环次数对催化产率的影响Fig.7 Effect of cycle times of ionic liquid on catalytic yield
实验结果表明,随着离子液体循环使用次数的增加,环辛烯环氧化的产率逐渐降低。在此催化体系中,催化剂兼溶剂的离子液体[C22O1Im][ReO4]和[C22O2Im][ReO4]循环使用4 次,产率均保持在80%以上。循环使用5 次时,其催化产率分别仍达到了78.39%和77.13%。造成催化产率略有减小的原因是回收利用离子液体[C22O1Im][ReO4]和[C22O1Im][ReO4]时,可能人为造成了离子液体的损失,导致循环使用时离子液体的用量略有减小,导致产率略有降低。整个反应体系中,离子液体[C22O1Im][ReO4]的催化活性几乎没有改变,可以循环使用,且具有良好的催化效果。
综上所述,离子液体[C22O1Im] [ReO4] 和[C22O2Im][ReO4]催化环辛烯环氧化的最佳条件为:离子液体用量0.8 ml,反应时间5 h,反应温度75℃,过氧化脲用量2.7 mmol。
3 结 论
合成了两种低黏度新型醚基高铼酸盐离子液体[C22O1Im][ReO4]和[C22O2Im][ReO4],并利用核磁共振氢谱/碳谱、拉曼光谱、质谱和差示扫描量热等方法表征,表明是目标产物,纯度均大于99.5%。将自合成的两种新型铼离子液体作为一种新型的催化剂兼溶剂,成功地应用于环辛烯环氧化成环氧环辛烷的均相催化反应体系中。通过单因素实验,确定反应的最佳条件,即离子液体用量0.8 ml,反应时间5 h,反应温度75℃,过氧化脲用量2.7 mmol。在此条件下,两种离子液体的催化产率均超过了90%,选择性高达99%,催化剂循环5 次,产率无明显下降。此反应体系,具有反应条件温和,操作简便,反应速率快,催化剂循环使用效果较好,催化效率高且选择性好等优点。选择离子液体作为催化剂,不仅充分发挥了离子液体稳定性高、溶解性强、挥发性低等优点,而且在均相催化过程中,有效提高了产率和选择性,大大缩短了反应时间,降低了成本,进而在催化剂分离与回收过程中,更加方便于实际生产。
