四元体系CaCl2-CaSO4-CaB6O10-H2O 308.15 K相平衡研究
2020-03-10袁菲宋江涛胡佳音郭亚飞王士强邓天龙
袁菲,宋江涛,胡佳音,郭亚飞,王士强,邓天龙
(天津科技大学化工与材料学院,天津300457)
引 言
柴达木盆地的南翼山地区储藏着大量的富钾、钙、硼的油田卤水和地下卤水[1-4],其卤水组成属于复杂六元体系(K+, Na+, Ca2+, Mg2+//Cl-, borate-H2O)。众所周知,卤水中盐类物质的开发利用往往通过太阳能进行蒸发、结晶、加热和冷却等工艺过程,而水盐体系相图具有重要的指导作用[5-9]。为了充分地开发和利用这一宝贵的卤水资源,对涉及该复杂六元体系相应的子体系已有报道。Lei 等[10]研究了三元体系(CaCl2+CaB6O10+H2O)在308.15、323.15 K 时的稳定相平衡;Deng 等[11]对三元体系(KCl+ CaCl2+H2O)在288.15和308.15 K下的介稳相平衡进行了研究;孟令宗等[12]和罗炳威等[13]分别对三元体系(Mg2+//Cl-,Borate-H2O)在308.15 K 和323.15 K 的稳定相平衡进行了研究;Wang 等[14]报道了交互四元体系(Na+,Ca2+//Cl-, Borate-H2O)在288.15 K 下的稳定相平衡;桑世华等[15-16]报道了三元体系(Na+, K+//B4O2-7-H2O)和四元体系(Mg+, K+//Cl-, B4O2-7-H2O)在288.15 K 下的固液相平衡研究;曾英等[17]对四元体系(Na+, K+//Cl-, B4O2-7-H2O)在273.15 K 的介稳相平衡进行了研究。
氯化钠和氯化钾在蒸发结束时几乎会完全从卤水中结晶出来,硼和钙在母液中高度浓缩,因此,含钙、硼体系相平衡的研究对开发利用该地区卤水资源尤为重要。同时,硼酸钙是一种低成本的化合物,可用于陶瓷添加剂原料、润滑油添加剂、发光材料等方面,而目前对其的研究仍然不足[18-22]。根据2005~2014 年的统计数据,每年6~8 月油田卤水区的温度在303.35~313.05 K 之间[23-24],平均温度为308.15 K。因此,本文对四元体系CaCl2-CaSO4-CaB6O10-H2O 在308.15 K 时的相平衡进行了研究。对该体系稳定相平衡的研究不仅可以对卤水体系溶解度数据库进行补充,而且可以为油田卤水中钙、硼资源的综合开发和高效利用提供重要的基础数据。
1 实验材料和方法
1.1 仪器与药品试剂
主要仪器:HXG-500-12A型恒温水浴磁力搅拌槽(北京惠城佳仪,控温精度±0.01℃),Abbemat 550高精度折光率仪(安东帕,精度±0.0002),DMA4500型高精度密度计(安东帕,精度±0.05 mg/cm3),PH 7310 精密pH 计(WTW,精度± 0.02);CC-K6 恒温水浴(Huber,控温精度± 0.01℃);X 射线粉晶衍射仪(MSALXD-3,北京普析);艾科浦超纯水机(AWL-0502-U,重庆)。
主要药品试剂:CaCl2和CaSO4(国药集团化学试剂有限公司),纯度均为A.R.级,经重结晶后备用;由于尚无商用高硼钙石(CaB6O10·5H2O),本实验根据文献方法采用CaO 和H3BO3实验室合成[25-26],经重结晶后进行化学组成分析和X 射线粉晶衍射鉴定,结果见表1 和图1,纯度≥99.5%;使用去离子蒸馏水(DDW)来配制实验所需溶液和离子分析测定,其电导率小于1×10-4S·m-1,pH=6.60。

表1 CaB6O10·5H2O化学分析数据Table 1 Chemical analysis data of CaB6O10·5H2O
1.2 实验方法
本研究采用了等温溶解平衡法[27-28]。即先在200 ml 硬质塑料瓶中配制三元体系共饱点,再依次加入第三种盐,搅拌至平衡[29]。例如:从三元体系CaCl2-CaSO4-H2O 的共饱点A,在不同的硬质塑料瓶中,依次加入CaB6O10·5H2O 配制成一系列复体点,将配制好的溶液放置于温度为(308.15±0.01)K 的恒温水浴槽中,以120 r·min-1搅拌。持续搅拌约90 d,并定期取液相进行化学分析,直至溶液中化学组成不变,即达到溶解平衡。将溶液静置沉淀,固液分离后分析液相组分,并在(308.15±0.01) K 恒温条件下测定平衡液相的物化性质(密度、折射率、pH),平衡固相采用X射线粉晶衍射法进行鉴定。

图1 CaB6O10·5H2O的XRD谱图Fig.1 XRD pattern of gowerite(CaB6O10·5H2O)
1.3 分析方法
液相中Cl-的测定采用汞量法[30],即在二苯偶氮碳酰肼和溴酚蓝混合指示剂的作用下,用Hg(NO3)2溶液滴定至待测溶液由黄色突变为紫蓝色,误差≤±0.3%;SO2-4的测定采用硫酸钡质量法[30],用过量的BaCl2溶液使SO2-4完全沉淀,将沉淀洗涤,烘干恒重,误差≤±0.05%;B6O2-10的测定采用改进的甘露醇质量法[30],在甲基红和酚酞双指示剂的作用下,用NaOH 溶液滴定待测液由亮黄色突变为橙黄色,误差≤±0.05%;Ca2+的测定采用EDTA 滴定法[30-31],在少量5%指示剂固体混合物(5 g 钙指示剂和95 g 氯化钠混合)的作用下,用EDTA 溶液滴定至溶液由酒红色突变为天青色,即为反应终点,其误差≤±0.3%。每组分析测定均进行三次平行实验,其平均值为最终实验结果。
2 实验结果与讨论
2.1 稳定相平衡研究
该四元体系溶解度数据(wB/%,质量分数)及干基组成(ZB/[g·(100 g·S)-1])见表2。根据表2中干基组成绘制了相应的干基图及水图,分别见图2、图3。
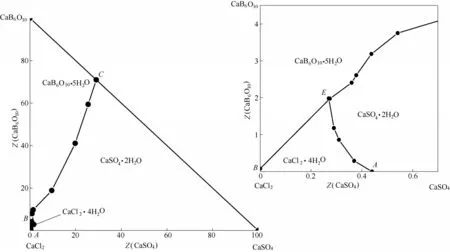
图2 四元体系CaCl2-CaSO4-CaB6O10-H2O在308.15 K下的干基图及局部放大图Fig.2 Dry-salt phase diagram and part enlargement of phase diagram for quaternary system (CaCl2-CaSO4-CaB6O10-H2O)at 308.15 K
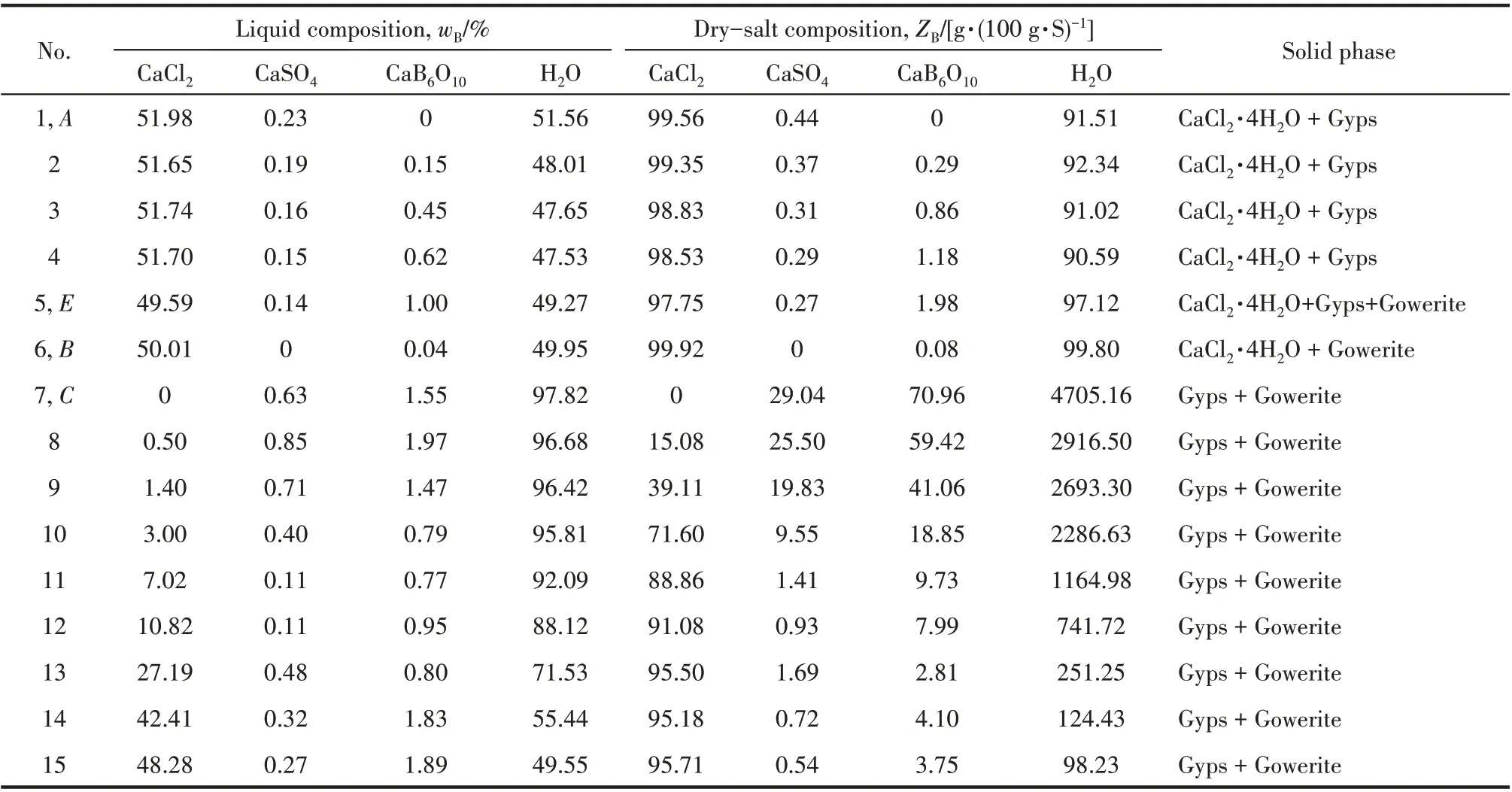
表2 四元体系CaCl2-CaSO4-CaB6O10-H2O在308.15 K下溶解度数据Table 2 Solubilities of quaternary system(CaCl2-CaSO4-CaB6O10-H2O)at 308.15 K

图3 四元体系CaCl2-CaSO4-CaB6O10-H2O在308.15 K下的水图及局部放大图Fig.3 Water-phase diagram and part enlargement of water-phase diagram for quaternary system (CaCl2-CaSO4-CaB6O10-H2O)at 308.15 K
由图2 可见,四元体系CaCl2-CaSO4-CaB6O10-H2O 在308.15 K 时既无复盐也无固溶体生成,属于简单水合物I 型。该四元体系干基图的3 个边界点A、B和C分别对应于3个三元子体系的共饱点,依次是:①CaSO4-CaCl2-H2O 共饱点A的平衡固相为CaSO4·2H2O + CaCl2·4H2O;②CaCl2-CaB6O10-H2O,共 饱 点B的 平 衡 固 相 为CaCl2·4H2O + CaB6O10·5H2O;③CaB6O10-CaSO4-H2O,共饱点C的平衡固相为CaB6O10·5H2O + CaSO4·2H2O;该干基图由1 个共饱 点E(组 成 为:w(CaCl2) = 49.59%,w(CaSO4) =0.14%,w(CaB6O10) = 1.00%),对应的平衡固相为CaCl2·4H2O+CaSO4·2H2O+CaB6O10·5H2O、3条单变量溶解度曲线(AE、BE和CE)、3 个单盐结晶区(分别对应于为CaCl2·4H2O、CaSO4·2H2O 和CaB6O10·5H2O)组成。取共饱点E的平衡固相用X 射线粉晶衍射仪(XRD)进行表征,结果见图4。从图4 中可以看出平衡固相的峰位与标准图谱一致,证明该点确实为该四 元 体 系 的 共 饱 点E(CaCl2·4H2O + CaSO4·2H2O +CaB6O10·5H2O)。由表2 和图2 中可见,CaSO4溶解度最小,硬石膏CaSO4·2H2O结晶区面积最大,CaB6O10·5H2O 结 晶 面 积 次 之,而CaCl2溶 解 度 最 大,CaCl2·4H2O的结晶区最小。
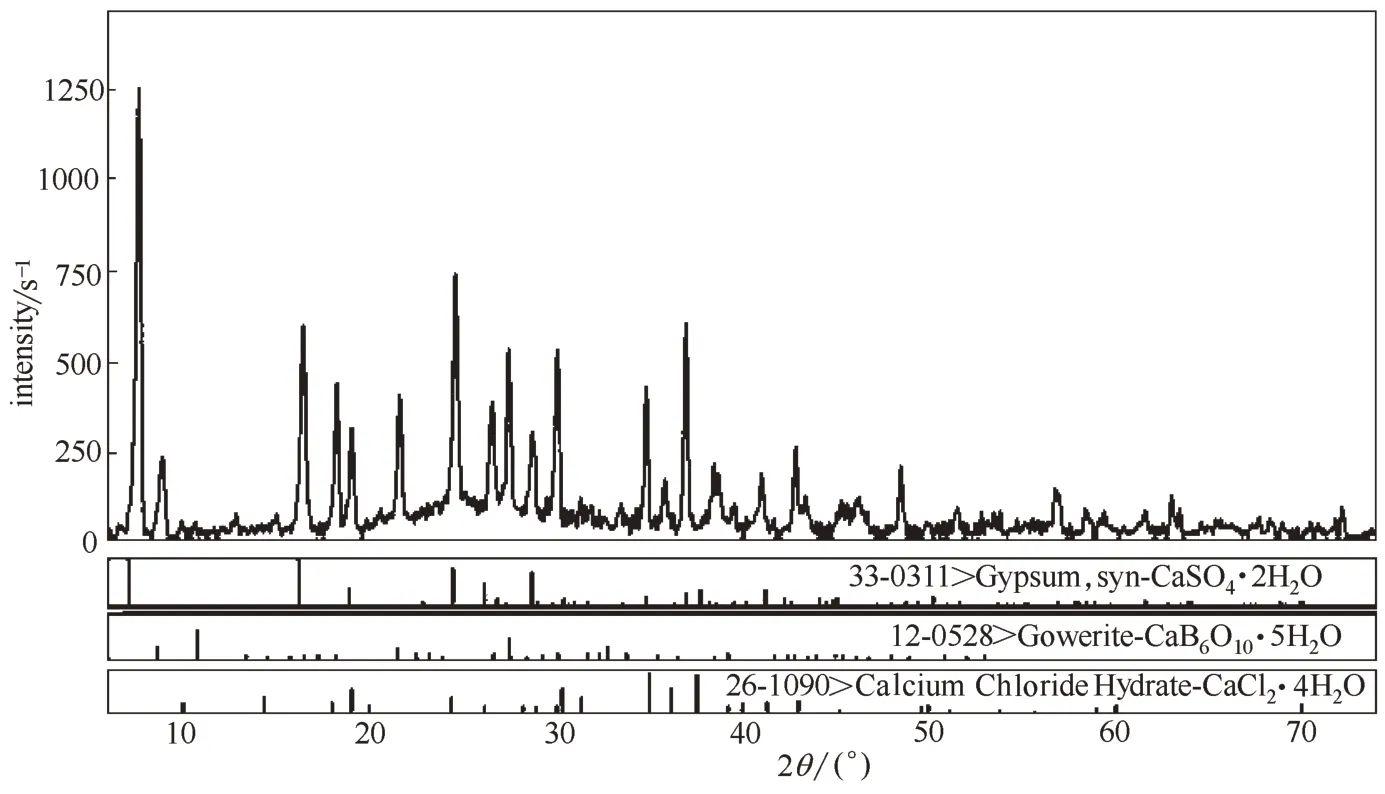
图4 共饱点E(CaCl2·4H2O+CaSO4·2H2O+CaB6O10·5H2O)的XRD谱图Fig.4 XRD pattern of invariant point E(CaCl2·4H2O+CaSO4·2H2O+CaB6O10·5H2O)
2.2 稳定相平衡物化性质研究
平衡液相的折射率、密度和pH 测定结果见表3。由表3 物化性质数据绘制了物化性质-组成图(图5)。由图可以看出:①图5(a)是折射率nD与氯化钙(CaCl2)浓度组成图。从图中可以看出,随着氯化钙浓度的增加,溶液折射率整体呈逐渐增大的趋势,且在共饱点E处发生转折,此点的折射率为1.470097。随后从E点到B点的过程中折射率逐渐增加,在B点处达到最大值1.473100;从E点到A点折射率又逐渐减小,最终至A点降至1.466014。②图5(b)是密度ρ与氯化钙(CaCl2)浓度组成图。同折射率的变化规律相近,随着氯化钙浓度的增加溶液密度先增大,在共饱点E处发生转折,该点的密度为1.51522 g·cm-3。随后在B点达到最大值1.52760 g·cm-3;到A点降至1.50209 g·cm-3。③图5(c)是pH 与氯化钙(CaCl2)浓度组成图,从图中可以看出,pH 随着氯化钙浓度的变化呈先减小后增大的趋势,同样在共饱点E处发生转折,该点的pH为2.80,共饱点E到A点逐渐增大至4.87,E点至B点过程中逐渐减小,到B点处达到最小值2.01。

表3 四元体系CaCl2-CaSO4-CaB6O10-H2O在308.15 K的物化性质Table 3 Physicochemical properties of quaternary system(CaCl2-CaSO4-CaB6O10-H2O)at 308.15 K
3 结 论

图5 四元体系CaCl2-CaSO4-CaB6O10-H2O在308.15 K下物化性质与组成Fig.5 Physiochemical property versus composition diagram of titled quaternary system at 308.15 K
本文采用等温溶解平衡法研究了四元体系CaCl2-CaSO4-CaB6O10-H2O 在308.15 K 下 的 稳 定 相平衡。测定该体系液相各组分的平衡溶解度及主要物化性质,包括折射率、密度和pH。且根据实验数据绘制了相应的干基图、水图和物化性质组成图。通过分析该四元体系的干基图可知:该体系在308.15 K 时 有1 个 共 饱 点(CaCl2·4H2O + CaSO4·2H2O + CaB6O10·5H2O)、3 条单变量溶解度曲线和3个 单 盐 结 晶 区,分 别 对 应 于CaCl2·4H2O、CaSO4·2H2O 和CaB6O10·5H2O。其中,由于CaCl2的溶解度较大,导致CaCl2·4H2O 的结晶区远小于CaSO4·2H2O和CaB6O10·5H2O 的结晶区。此外,该体系在308.15 K下没有复盐和固溶体生成,属于简单化合物Ⅰ型。该四元体系的物化性质随着氯化钙浓度增加呈现规律性变化。折射率和密度随着氯化钙浓度的增加变化规律一致,pH随着氯化钙浓度的增加呈现不同的变化规律。对该体系的稳定相平衡研究,将填补钙硼酸盐溶解度数据空白,同时为综合开发盐湖卤水资源提供重要的基础数据。
