发芽条件对西兰花芽苗菜总黄酮富集的影响
2020-03-09柏夏琼陈介南张林詹鹏
柏夏琼,陈介南,张林,詹鹏
(中南林业科技大学国家林业局生物乙醇研究中心,湖南省木本生物质转化工程技术研究中心,生物资源环境研究所,湖南长沙410004)
西兰花(Brassica oleracea L.var.italic Planch.),又名花椰菜、球花甘蓝,一年生草本植物,是十字花科芸薹属绿色花球的变种[1]。原产于意大利,19 世纪末传入中国。西兰花营养丰富且全面,主要包括蛋白质、多糖、脂肪、矿物质、维生素C 和胡萝卜素等[2-3]。西兰花还含有硫代葡萄糖苷的酶解产物或衍生物以及丰富的抗坏血酸和黄酮类化合物[4-6]。黄酮类化合物是植物体中重要的天然物质,因其独特的化学结构而具有抗炎症、抗过敏、抗病毒、抗肿瘤、抗化学毒物、防治血管疾病及心脑血管疾病等功能[7-8],在化妆品、功能食品及医药领域深受关注[9]。
在生产实践中,发芽处理常被用作改善种子营养质量的有效方法。利用现代生物技术控制种子萌发,不仅能转化其中的营养物质,还可以富集对人体有益的活性物质,提高加工产品的营养价值和保健功能[10]。发芽过程中的营养成分富集方法可分为两类:生物诱导法与非生物诱导法。在现代食品加工中,利用非生物诱导富集功能性营养成分的方法较多,而生物诱导法较少。非生物诱导法包括物理法、化学法和物理化学联合法。一般物理法有外加电场、超声波、辐射诱导、控制发芽过程中的湿度、种子浸泡时间等方法,化学法则是多采用不同的缓冲溶液、pH 值等手段实现富集[11]。白青云等[12]通过物理化学联合法确定了发芽大豆富集多肽的最适培养条件:以pH 5.2 的柠檬酸缓冲(5 mmol/L)为培养液,在29 ℃时培养6 d 后,发芽大豆中多肽含量达到159.38 mg/g,是原料大豆中的3.83 倍。国内外关于发芽谷物功能性成分富集的研究大多集中在大豆和糙米方面[13-16],而对发芽西兰花中功能性成分富集的研究报道仍为空白,且有文献报道西兰花无公害栽培技术,但未讨论其最适消毒方法。本研究通过对西兰花种子进行消毒处理,筛选出适宜的消毒方法,并对西兰花发芽过程总黄酮富集条件进行优化,获得了较优质的西兰花芽苗菜,以期为我国西兰花苗菜产业的生产技术体系提供一定的参考。
1 材料与方法
1.1 材料与试剂
绿霸王西兰花:菏泽朔宁果蔬有限公司;芦丁、Murashig-Skoog 培养基(murashig and skoog medium,MS)试剂(硝酸铵、硝酸钾、七水硫酸镁、磷酸二氢钾、二水氯化钙、碘化钾、硼酸、四水硫酸锰、七水硫酸锌、四水钼酸钠、五水硫酸铜、六水氯化钴、乙二胺四乙酸二钠、七水硫酸亚铁、甘氨酸、肌醇、盐酸硫胺素、烟酸、盐酸吡哆醇)、2,4-二氯苯氧乙酸、激动素KT、萘乙酸、6-苄基氨基腺嘌、氢氧化钠、浓盐酸、无水乙醇、琼脂、蔗糖、硝酸钠、硝酸铝:国药集团化学试剂有限公司。
1.2 仪器与设备
UV-2450 型紫外分光光度计:岛津企业管理有限公司;CJ-ID 洁净工作台、250 数显光照培养箱:天津市泰斯特仪器有限公司;FD-1C 冷冻干燥机:北京市德天佑科技发展有限公司。
1.3 试验方法
1.3.1 种子消毒方法筛选
1.3.1.1 不同物理消毒方法处理西兰花种子
采用清水漂浮法对西兰花进行选种,弃漂浮的豆种,选取底部颗粒饱满、大小一致的种子待试验用。采用不同物理方法处理西兰花,每个处理随机选取100粒种子,操作方法[17-19]如下:
1)空白对照(control check,CK):种子不作任何处理,直接催芽;2)温汤浸种法:种子用 50 ℃~55 ℃热水浸种10 min;3)干热处理法:种子在70 ℃的恒温箱中处理48 h;4)紫外杀菌法:利用无菌操作台单人超净工作台紫外灯分别照射10、20、30 min。
1.3.1.2 种子处理后在培养箱中的管理
将处理后的种子用无菌水浸泡6 h,均匀地平铺在垫有3 层湿润育苗纸的育苗盘内,上盖1 层湿润育苗纸作为保湿材料,于24 ℃光照培养箱中,避光培养,每天喷水2 次~3 次,以盘内不积且不滴水为宜。以种子胚部破裂为萌动,以胚根突破种皮的下胚轴长超过种子自身的长视为发芽[17]。
1.3.1.3 消毒效果检测
将处理后的种子接种于MS 培养基,置于24 ℃光照培养箱中,避光培养,并每天观察种子上是否有杂菌长出,若有则记下污染数[18]。
1.3.1.4 二次消毒处理
试验结果显示物理消毒杀菌不完全,需食品级消毒剂奥克泰士D10 进行二次消毒。将奥克泰士D10 分别稀释为0.5%、1%、1.5%、2%、2.5%的种子消毒浸泡液,备用。将1.3.1.1 中最优物理消毒处理后的种子用不同浓度的奥克泰士 D10 分别浸泡 2、4、6、8、10、12、14 h,以无菌水为对照。通过对比发芽率及污染率确定最适浓度和最低耗时。
1.3.2 单因素试验
1.3.2.1 浸泡温度对总黄酮含量的影响
将物理消毒处理的种子用20 倍1%奥克泰士D10浸泡,在浸泡温度分别为 20、25、30、35、40 ℃浸泡 6 h,发芽温度24 ℃的条件下发芽5 d,测定总黄酮含量。
1.3.2.2 浸泡时间对总黄酮含量的影响
将物理消毒处理的种子用20 倍1%食品级奥克泰士 D10,在浸泡温度 30 ℃分别水浴 6、8、10、12、14 h,发芽温度24 ℃的条件下发芽5 d,测定总黄酮含量。
1.3.2.3 发芽温度对总黄酮含量的影响
将物理消毒处理的种子用20 倍1 %奥克泰士D10 浸泡,在浸泡温度30 ℃,浸泡时间6 h,发芽温度分别为 16、20、24、28、32 ℃的条件下发芽 5 d,测定总黄酮含量。
1.3.2.4 发芽时间对总黄酮含量的影响
将物理消毒处理的种子用20 倍1 %奥克泰士D10 浸泡,在浸泡温度30 ℃,浸泡时间6 h,发芽温度24 ℃的条件下分别发芽 1、2、3、4、5 d,测定总黄酮含量。
1.3.3 正交试验
在单因素试验的基础上,选用浸泡温度(A)、发芽温度(B)、发芽时间(C)3 个因素,每个因素选择 3 个水平,采用L9(33)正交表进行试验设计优选,以期获得高含量总黄酮的西兰花芽苗。正交试验未选用浸泡时间的原因是西兰花种子体积小,萌发所需水分可在短时间内达到饱和,且试验浸泡时间范围内指标值变化不大。正交试验因素水平见表1。

表1 L9(33)正交试验因素水平表Table 1 The level of L9(33)orthogonal experiment factors
1.3.4 总黄酮含量测定
1.3.4.1 标准曲线绘制
对芦丁标准液进行紫外图谱扫描,确定出最大吸收波长,并在此波长下采NaNO2-Al(NO3)3比色法[20]测定不同质量浓度芦丁标准液的吸光度,绘制出芦丁质量浓度C 与吸光度A 关系的标准曲线,得回归方程:A=0.014 91C-0.002 91(R2=0.999 8)。
1.3.4.2 西兰花总黄酮的测定
样品处理:-20 ℃预冷冻2 h,真空冷冻干燥48 h,粉碎,过 40 目筛,密封保存[21-23]。
含量测定:取一定量冷冻粉碎样品于50 mL 三角瓶中,加入 60%乙醇溶液,料液比 1 ∶30(g/mL),加稀碱调至pH 8,80 ℃水浴振荡1.5 h,冷却,10 000 r/min离心10 min 后收集上清液。精密量取1 mL 上清液分别置于25 mL 容量瓶中,加入5%NaNO2溶液0.3 mL 静置10 min 后,加10%Al(NO3)3溶液0.3 mL 静置10 min,再加入1 mol/L NaOH 溶液4 mL,分别用30%乙醇定容至25 mL,摇匀,放置15 min,在510 nm 处测定吸光度值[24-27]。并代入回归方程计算总黄酮的含量,试验均重复3 次,结果取平均值。
1.3.5 西兰花不同生长情况下总黄酮含量测定
准确称量相同质量的自然生长的芽苗、最适发芽条件生长的芽苗和成熟西兰花花球,根据1.3.4 的步骤分别测定总黄酮含量。
1.3.6 数据处理
利用Origin7.5 对试验数据进行处理及相关分析,所有的试验平行3 次。
2 结果与分析
2.1 种子消毒结果分析
2.1.1 不同物理消毒对西兰花种子发芽时间的影响不同消毒方法对种子发芽时间的影响见图1。
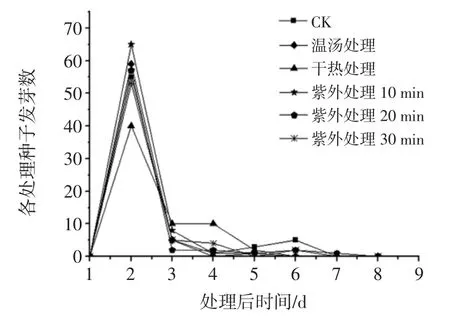
图1 不同消毒方法对种子发芽时间的影响Fig.1 Effect of different sterilizing methods on seed germination time
从图1 可以看出,物理消毒方法与对照组均在处理后的第2 天达到发芽高峰期,且CK、温汤处理、干热处理、紫外处理10 min、紫外处理20 min、紫外处理30 min 的发芽数分别为 55、59、40、65、57、53。故紫外处理10 min>温汤处理>紫外处理20 min>CK>紫外处理30 min>干热处理。
2.1.2 不同物理方法处理对西兰花的影响
不同消毒处理对西兰花发芽率、污染率的影响见表2。

表2 不同消毒处理对西兰花发芽率、污染率的影响(7 d)Table 2 Effect of different sterilizing methods on germination rate and contamination rate of broccoli(7 d)
由表2 可知,除紫外消毒处理10 min 外,其他处理均会使得西兰花发芽率降低,且干热处理发芽率最低;而发芽7 d 内的消毒效果:紫外消毒处理30 min 最优,紫外消毒处理20 min 次之,干热处理最差。综合发芽率、污染率两者来看,污染率对发芽率的影响较小,可能原因是西兰花在萌发第2 天达到发芽高峰期而此时微生物少且生长速率慢。故适宜的物理消毒处理应选紫外消毒处理10 min。
2.1.3 二次消毒对西兰花的影响
消毒剂不同使用情况下西兰花发芽率及污染率的变化见图2。

图2 消毒剂不同使用情况下西兰花发芽率及污染率的变化Fig.2 Changes of germination rate and contamination rate content of broccoli under different use of disinfectant
由图2 可知,与对照组相比,消毒剂的使用降低了污染率同时也抑制种子萌发。随着消毒剂浓度的增大,西兰花发芽率呈下降趋势,原因可能是该消毒剂超过一定浓度具有漂白作用,影响了种子萌发;而相同浓度消毒剂使用时间对发芽率影响不显著。原因可能是在使用一段时间后,消毒剂有效成分过氧化氢基本消耗。消毒剂浓度增大,使得污染率随着时间延长而降低;浓度为0.5%时,1%~3%范围内,浸泡6 h 可消毒完全,4%~5%时则只需4 h。在消毒不完全的情况下,杂菌污染并不能影响西兰花发芽率,可能原因是发芽前期微生物繁殖速度慢,不能抑制西兰花萌发,但后期大量的微生物会致使幼苗发病,造成弱苗、死苗的现象。综合发芽率、污染率两者考虑,最适的消毒处理为紫外消毒处理10 min 联合1%食品级奥克泰士消毒剂处理6 h。
2.2 富集总黄酮西兰花发芽条件优化结果分析
2.2.1 单因素试验结果与分析
2.2.1.1 浸泡温度对总黄酮含量的影响
浸泡温度对发芽西兰花总黄酮含量的影响见图3。

图3 浸泡温度对发芽西兰花总黄酮含量的影响Fig.3 Individual effect of soaking temperature on total flavonoids content in germinated broccoli
如图3 所示,随着浸泡温度的升高,总黄酮含量先升高后降低,浸泡温度为30 ℃时达到最大值10.09 mg/g;在浸泡温度30 ℃~40 ℃条件下,总黄酮含量略有下降。原因可能是在一定温度范围内,温度越高,西兰花中的酶系更易被激活,促进黄酮类化合物的合成,而超过这个温度范围则抑制酶系活力使总黄酮含量降低。因此,确定最佳浸泡温度为30 ℃。
2.2.1.2 浸泡时间对总黄酮含量的影响
浸泡时间对发芽西兰花总黄酮含量的影响见图4。

图4 浸泡时间对发芽西兰花总黄酮含量的影响Fig.4 Individual effect of soaking time on total flavonoids content in germinated broccoli
由图4 可知,在浸泡时间6 h~10 h 范围内,总黄酮含量先下降后升高,10 h 时总黄酮含量达到最大值10.71 mg/g。此后总黄酮含量略有下降。然而整个浸泡时间段的总黄酮含量变化区间在0.1 mg/g 以内,原因可能是西兰花种子个体小,萌芽所需水分少,短时间浸泡即可达到饱和,短时间内破坏细胞壁,释放结合性黄酮类化合物,使其含量达到一定值。考虑时间消耗和消毒剂最低有效时间6 h,故确定最佳浸泡时间为6 h 且该因素不做正交试验。
2.2.1.3 发芽温度对总黄酮含量的影响
发芽温度对发芽西兰花总黄酮含量的影响见图5。

图5 发芽温度对发芽西兰花总黄酮含量的影响Fig.5 Individual effect of germinal temperature on total flavonoids content in germinated broccoli
由图 5 可知,在发芽温度 16 ℃~24 ℃范围内,总黄酮含量随发芽温度的升高而略微增加,发芽温度为24 ℃时达到最大值 10.62 mg/g;但是在 24 ℃~32 ℃范围内,总黄酮含量迅速下降。原因可能是:1)在25 ℃浸泡后,降至16 ℃培养,较大的温差致使植物细胞区室化增强,从而使莽草酸途径和多酮化途径中的关键酶活性变大,引起总黄酮含量增加;2)随着温度升高,细胞内酶活性提高,加快了某些反应的进行,促进了总黄酮的积累,但当总黄酮含量积累到一定量时,被降解使含量降低。因此,确定最佳发芽温度为24 ℃。
2.2.1.4 发芽时间对总黄酮含量的影响
发芽时间对发芽西兰花总黄酮含量的影响见图6。

图6 发芽时间对发芽西兰花总黄酮含量的影响Fig.6 Individual effect of germinal time on total flavonoids content in germinated broccoli
由图6 可知,第1 天~第4 天,总黄酮含量随发芽时间的延长而迅速增加,原因可能是在发芽初期,碳水化合物和蛋白质被降解,单糖和游离氨基酸增加,使得黄酮类化合物生物合成增加;第4 天~第5 天总黄酮含量增加量为0.02 mg/g,其含量为10.64 mg/g,原因可能是随着时间延长,黄酮类化合物增加到一定量后会被降解,降解后又合成,最终维持适当含量。考虑发芽时间,因此,选择最佳发芽时间为4 d。
2.2 正交试验结果与分析
正交试验结果见表3。
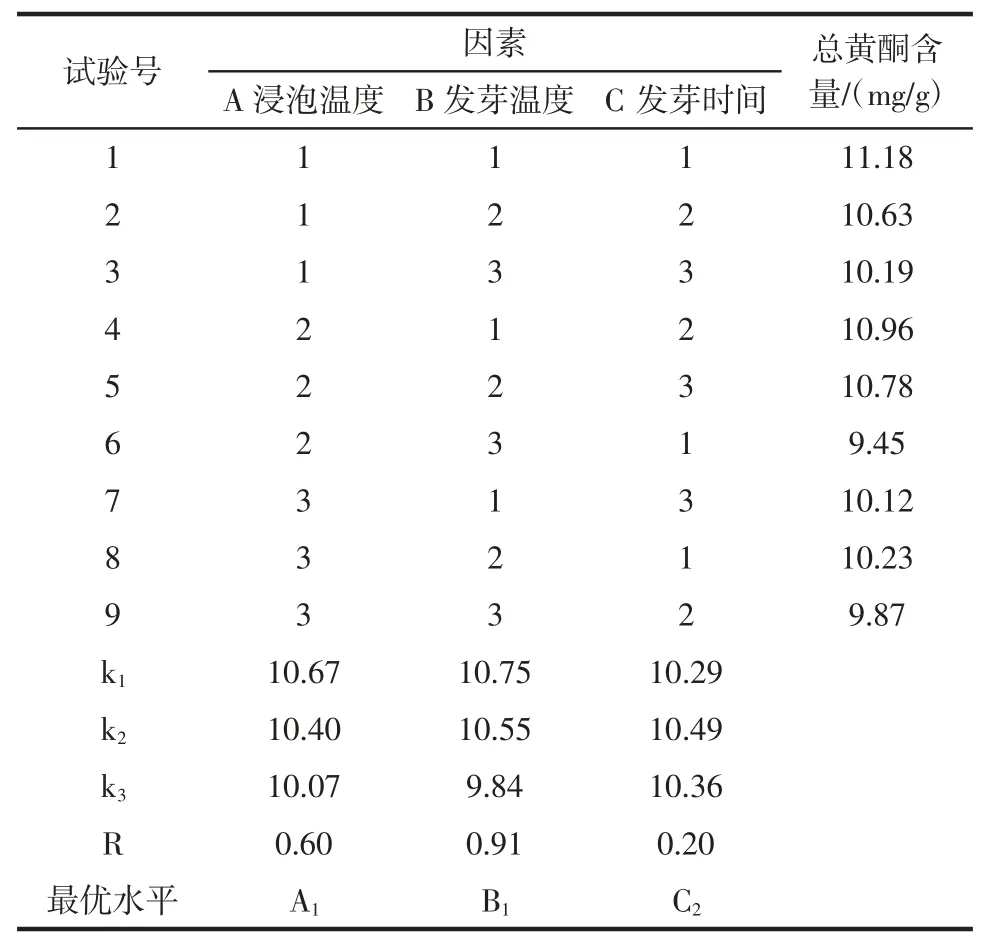
表3 正交试验结果Table 3 The results of the orthogonal experiment
根据表3 正交试验数据可知,西兰花发芽富集总黄酮的最优条件为:浸泡温度25 ℃、浸泡时间6 h、发芽温度20 ℃、发芽时间4 d。由极差分析结果可知,影响程度:发芽温度>浸泡温度>发芽时间。按最佳试验条件进行了3 次验证试验,得西兰花芽苗总黄酮含量平均为11.33 mg/g。
2.3 各生长情况下西兰花总黄酮的比较
不同生长情况下西兰花总黄酮含量的比较见表4。

表4 不同生长情况下西兰花总黄酮含量的比较Table 4 Comparison of total flavonoids content in broccoli under different growth conditions
由表4 可知,优化条件下生长的芽苗总黄酮含量最高,是自然环境生长的西兰花芽苗的1.47 倍,是成熟西兰花花球的4.43 倍。
3 结论
试验对西兰花进行了多种消毒处理,发现采用紫外消毒10 min 联合1%食品级奥克泰士D10 消毒效果好,且能提高发芽率。
通过考察多种因素对西兰花芽苗中总黄酮含量的影响,利用单因素试验、正交试验及验证性试验得到了浸泡温度、发芽温度、发芽时间均对西兰花芽苗中总黄酮含量均有一定影响,确定的最佳发芽条件为:浸泡温度25 ℃、浸泡时间6 h、发芽温度20 ℃、发芽时间4 d。此条件下西兰花总黄酮为11.33 mg/g,其总黄酮含量是自然环境生长的西兰花芽苗的1.47 倍,是成熟西兰花花球的4.43 倍。
