钛表面铜离子注入对细菌和细胞行为的影响
2020-03-09李昆强乔玉琴刘宣勇
李昆强, 乔玉琴, 刘宣勇
钛表面铜离子注入对细菌和细胞行为的影响
李昆强1,2, 乔玉琴1, 刘宣勇1,2
(1. 中国科学院 上海硅酸盐研究所, 高性能陶瓷和超微结构国家重点实验室, 上海 200050; 2. 中国科学院大学 材料科学与光电子工程中心, 北京 100049)
医用钛及其合金被广泛用作骨组织替换材料, 但缺乏抗菌性, 易导致细菌感染。铜具有良好的抗菌性能, 将其引入到钛表面, 可改善医用钛的抗菌性能; 然而铜含量过高对细胞具有毒性。因此, 需要调节铜的含量, 实现铜的抗菌性能和细胞相容性之间的平衡。本研究采用等离子体浸没离子注入技术对医用钛进行表面改性, 获得表面含铜量不同的样品, 并研究改性钛表面对细菌和细胞行为的影响。结果表明, 钛表面含铜量较低的样品能够促进大鼠骨髓间充质干细胞(rBMSCs)和人脐静脉内皮细胞(HUVECs)的增殖, 但对大肠杆菌和金黄色葡萄球菌没有抑制能力; 随着离子注入时间的延长, 钛表面含铜量较高的样品抗菌能力显著提高, 同时也未产生明显细胞毒性。因此, 通过控制钛表面的铜含量, 可以获得兼具良好抗菌性能和生物相容性的钛植入材料。
离子注入; 生物相容性; 铜; 抗菌
钛及其合金具有良好的力学性能、较好的耐腐蚀性能和生物相容性, 因而被广泛地用作骨组织替换材料[1-2]。尽管钛植入体在临床上已经取得较高的成功率, 但是依然存在失效的风险, 因为, 钛材料缺乏抗菌能力, 手术处组织易被细菌感染[3]。目前, 临床上主要是通过全身抗生素治疗解决植入体术后感染的问题。由于抗生素的过度使用会导致细菌产生耐药性。因此, 有必要开发有应用前景的表面改性方法, 以提高其抗菌性。利用无机元素提高生物材料的抗菌性是当前的研究重点, 如Zn[4-5]、Ag[6-7]、Mn[8]和Cu[9-10]等。
铜具有良好的抗菌性, 广泛用于生物材料的改性, 例如, 生物陶瓷[11-12]、钛合金[13-16]等。铜能够捕获细菌表面的电子, 并破坏细菌的膜结构[17]。此外, 铜与细菌内的呼吸链酶结合, 可以诱导细菌功能紊乱[17]。然而, 铜含量过高会破坏细胞内的平衡并产生细胞毒性。Liu等[18]利用熔融法制备了Mg-Cu合金, 研究表明, 铜含量较高的Mg-0.57Cu合金会抑制细胞的成骨分化和血管再生能力, 并且具有细胞毒性。Wang等[19]研究表明铜含量过高会导致3T3成纤维细胞死亡。由此可见, 铜在生物材料中的掺杂量与其生物学性能之间具有密切关联。合理控制Ti表面的Cu掺入量, 有望获得兼具杀菌和良好生物相容性的表面。
等离子体浸没离子注入(Plasma Immersion Ion Implantation PIII)技术是一种快速且有效的表面改性技术。PIII技术可以在不改变基体的块体性质的情况下, 对材料表面的化学成分及结构进行修饰; 通过调节离子注入的工艺, 可以控制元素在基体表面的含量以及深度分布; 另外, 离子注入后, 改性层与基体无明显界面, 结合牢固[20]。本研究利用PIII技术在钛表面注入铜, 通过调节注入时间制备出三组不同含铜量的钛表面, 并研究其对细菌和细胞行为的影响。
1 实验方法
1.1 样品制备
将尺寸为1 cm×1 cm×1 mm和2 cm×1 cm×1 mm的Ti用混酸(体积比为HF : HNO3: H2O=1 : 5 : 4)处理, 然后用超纯水超声清洗, 并干燥。对Ti进行铜等离子体浸没注入改性(Cu-PIII)。注入参数见表1, 注入时间为1、2和3 h的样品分别命名为Cu-1h、Cu-2h和Cu-3h。
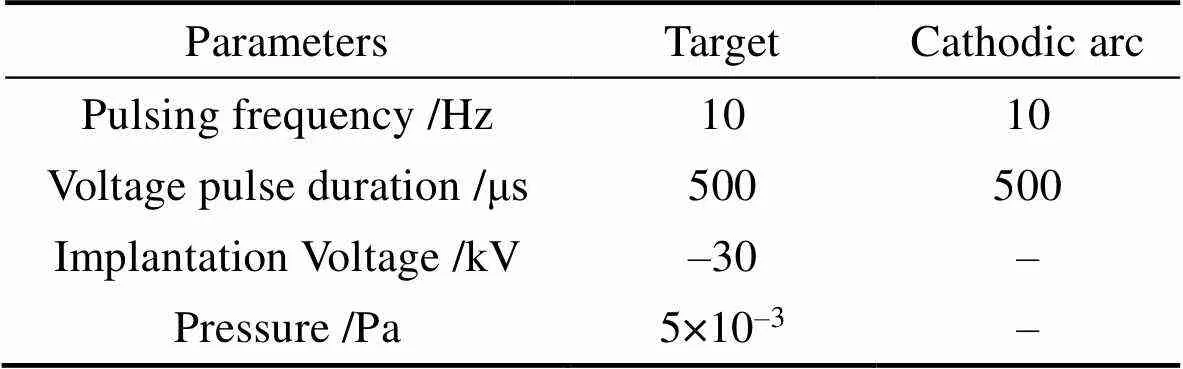
表1 铜等离子体浸没离子注入的主要参数
1.2 表面结构和化学成分表征
利用钨灯丝扫描电子显微镜(S-3400, HITACHI, Japan)观察不同样品的表面形貌, 加速电压为15 kV。利用X射线光电子能谱仪(XPS, PHI-5000C ESCA System PerkinElmer, USA)测定不同样品表面铜的含量及化学价态。
1.3 表面润湿性测试
采用接触角仪(Automatic Contact Angle Meter Model SL200B, Solon, China)测试不同样品表面的润湿性。
1.4 表面腐蚀性能测试
利用电化学工作站(CHI760, Chenhua, China)测试样品表面的塔菲尔(Tafel)曲线。选择0.9wt% NaCl作为测试溶液, 具体流程见先前的研究[21]。
1.5 表面铜离子释放测试
将样品放入10 mL磷酸盐缓冲溶液(PBS)中浸泡1、4、7和14 d。每个时间节点, 收集浸提液并加入新的PBS溶液。利用电感耦合等离子体原子发射光谱仪(ICP-AES, Varian Liberty 150, USA)测试浸提液中铜离子的含量。
1.6 体外抗菌性能
本研究使用金黄色葡萄球菌()和大肠杆菌()作为菌源。利用细菌涂板法分析细菌在琼脂板上培养后的菌落数量; 扫描电镜分析样品表面细菌的形貌; 并采用阿尔玛蓝试剂测试细菌的活性。具体流程见先前的研究[22]。
1.7 生物相容性
利用人脐静脉内皮细胞(HUVECs)和大鼠骨髓间充质干细胞(rBMSCs)来评价不同样品的生物相容性。利用阿尔玛蓝试剂测试细胞在样品表面的增殖情况。细胞接种和增殖测试的流程见先前的研究[22-23]。
1.8 统计学分析
使用GraphPad Prism统计分析软件进行数据分析, 通过一维方差分析和Tukey多组对比实验分析不同组实验变量间是否有显著差异。<0.05表示数据在统计学上存在显著差异。
2 结果与讨论
2.1 表面结构和化学特征
图1为Ti、Cu-1h、Cu-2h和Cu-3h的SEM形貌。在低倍下, 铜等离子体注入后, 样品的形貌没有明显变化。在高倍下, 酸洗Ti表面形成均匀的沟壑状。经过Cu-PIII处理后, 酸洗Ti表面的沟壑结构逐渐消失(图1(f~h)), 且随着注入时间的延长, 样品表面愈加平整。这可能是由于铜等离子体的高能轰击所致[24]。
表2是不同样品表面铜的百分含量。Cu-1h、Cu-2h和Cu-3h表面的含铜量分别是2.54at%、5.12at%和5.99at%。这表明控制离子注入时间, 可以调控样品表面的含铜量。
图2是不同样品表面及表层30 nm深度处的Cu 2p的高分辨XPS图谱。如图2(a)所示, Cu-1h表面的高分辨XPS谱共有六个拟合峰, 其中位于953.23和932.60 eV处的峰分别属于单质铜的2p1/2和2p3/2峰; 位于954.85和934.73 eV处的峰属于氧化铜的2p1/2和2p3/2峰; 而位于944.10和941.48 eV处的峰属于铜离子的伴峰[25-28]。如图2(c, e)所示, Cu-2h和Cu-3h表面的Cu 2p高分辨XPS图谱与Cu-1h相似, 铜在钛表面的存在形式是单质铜和氧化铜。图2(b, d, f)表明, Cu-1h、Cu-2h和Cu-3h在钛表层30 nm深度处的Cu 2p的高分辨XPS图谱只有两个峰, 且均位于952和932 eV附近, 为单质铜的2p1/2和2p3/2峰。这说明铜在钛的内部以单质铜的形式存在, 在表面以单质铜和氧化铜的形式存在。
2.2 表面理化性能
图3(a)是不同样品表面的接触角。与酸洗Ti相比, 铜离子注入后, 样品表面的接触角增大; 并且随着注入时间延长, 样品表面接触角也随之增大。接触角与样品表面的形貌密切相关[29]。由图1和图2可知, 铜离子注入后, 钛表面结构和组成发生变化, 导致接触角发生变化。
图3(b)为不同样品的Tafel曲线。铜离子注入后, 样品表面的腐蚀电位提高。铜的标准电极电势为+0.34 eV, 高于Ti的电极电势(–1.63 eV)。因此, 铜的引入能够提高钛表面的腐蚀电位, 从而改善钛表面的耐腐蚀性能。然而, 当测试电压超过样品的腐蚀电位后, 形成Ti-Cu电偶使腐蚀速率加快。
图3(c)为不同样品在PBS中浸泡14 d的铜离子释放曲线。Cu-2h和Cu-3h的铜离子释放量相近, 且略高于Cu-1h。三组样品都有稳定的铜离子释放速率。前7 d铜离子的释放速率相对较大; 随着浸泡时间延长, 铜离子的释放速率放缓。这说明铜在钛表面能够稳定地存在和释放。
2.3 体外抗菌性能
通过观察细菌形貌、菌落数量和细菌的增殖情况判断不同样品的抗菌性能。图4(a, c, e)分别是大肠杆菌在不同样品表面培养后细菌的SEM形貌、菌落数量及增殖情况。与酸洗Ti相比, Cu-1h表面细菌的形貌和数量没有显著变化; 在琼脂板上再培养后, 细菌在琼脂板上菌落数量有所增加; 定量分析也表明细菌数量无明显变化。随着样品表面铜的含量增加, Cu-2h和Cu-3h的抗菌能力显著提高, 样品表面的细菌数量显著减少, 同时细菌形貌也被破坏, 琼脂板上未发现菌落, 定量分析表明细菌基本死亡。如图4(b, d, f)所示, 金黄色葡萄球菌在不同样品表面培养后, 细菌形貌、菌落数量及增殖的变化规律与大肠杆菌的结果相似。即铜含量较低时, 样品无显著抗菌性; 而铜含量较高时, 具有明显的抗菌性。
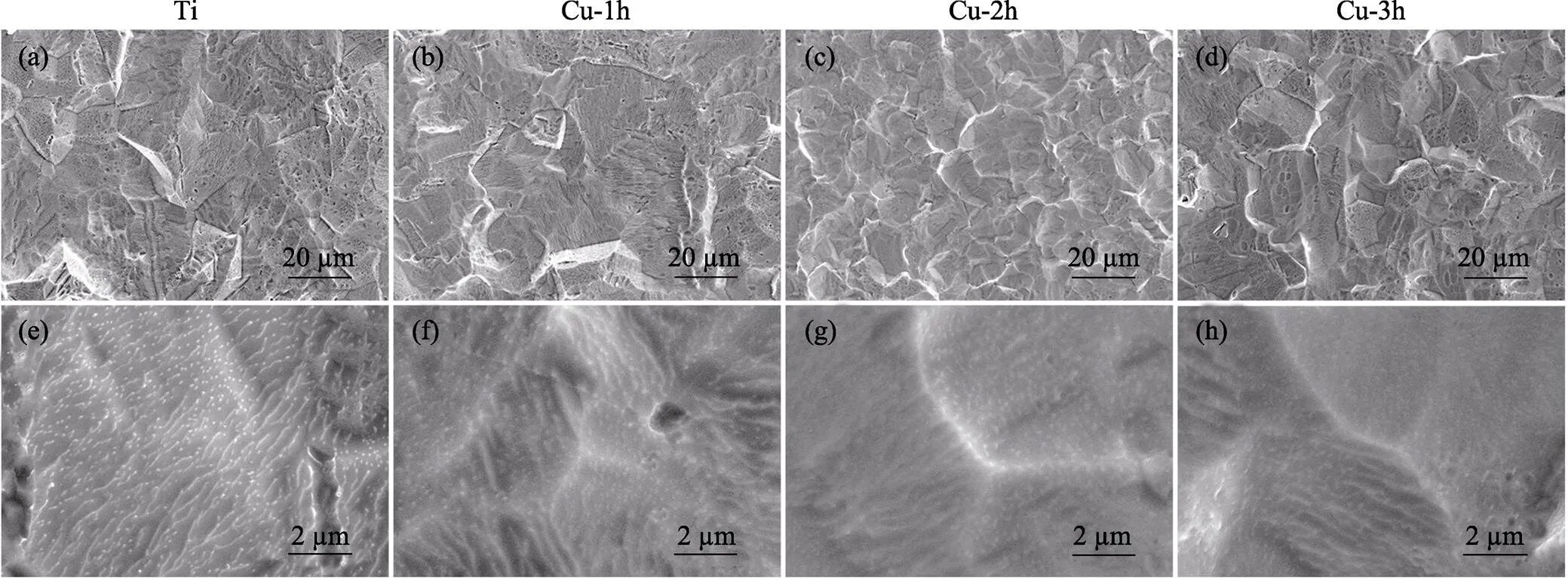
图1 不同样品表面在低倍(a~d)和高倍(e~h)镜下的SEM形貌

表2 不同样品表面铜的含量
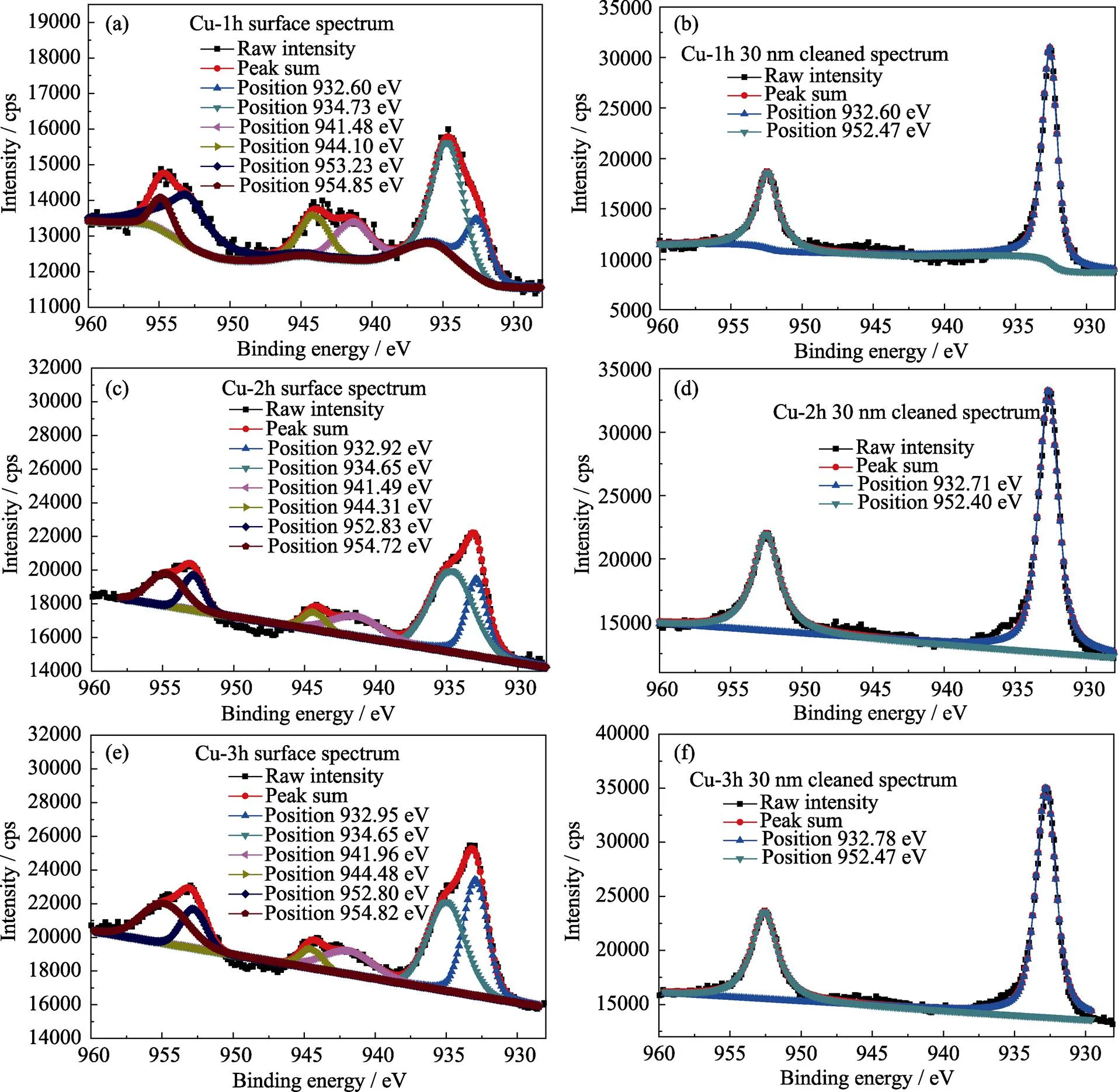
图2 不同样品表面(a, c, e)和30 nm深度处(b, d, f)的Cu 2p的高分辨XPS图谱
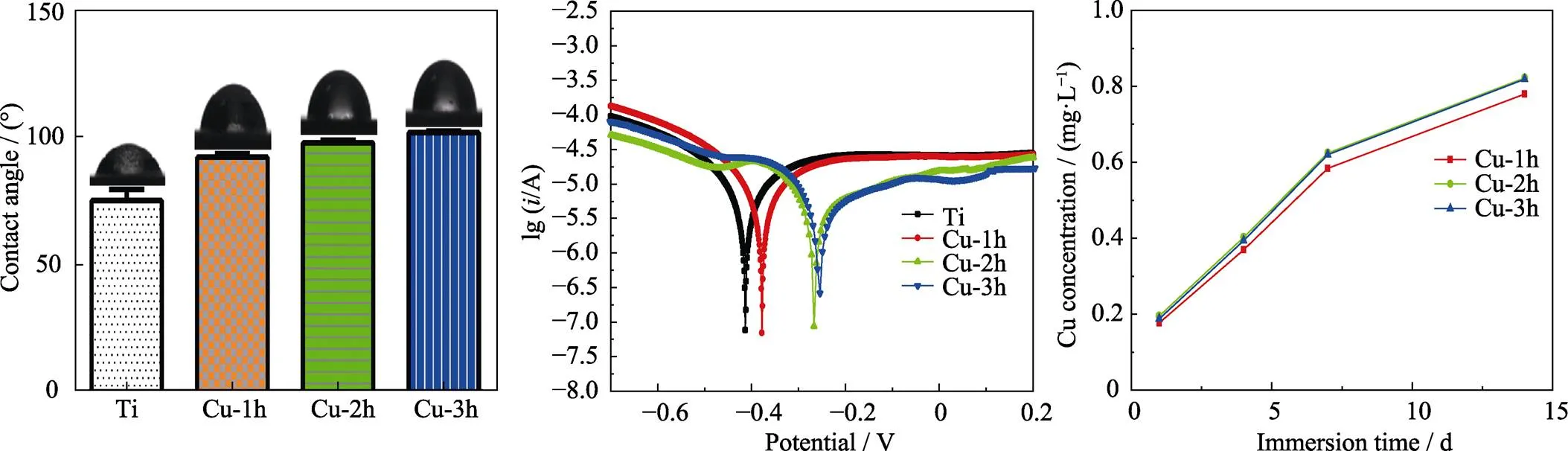
图3 不同样品表面的水接触角(a), 不同样品在0.9wt% NaCl溶液中测得Tafel曲线(b)和不同样品在PBS中浸泡1、4、7和14 d的铜离子释放曲线(c)
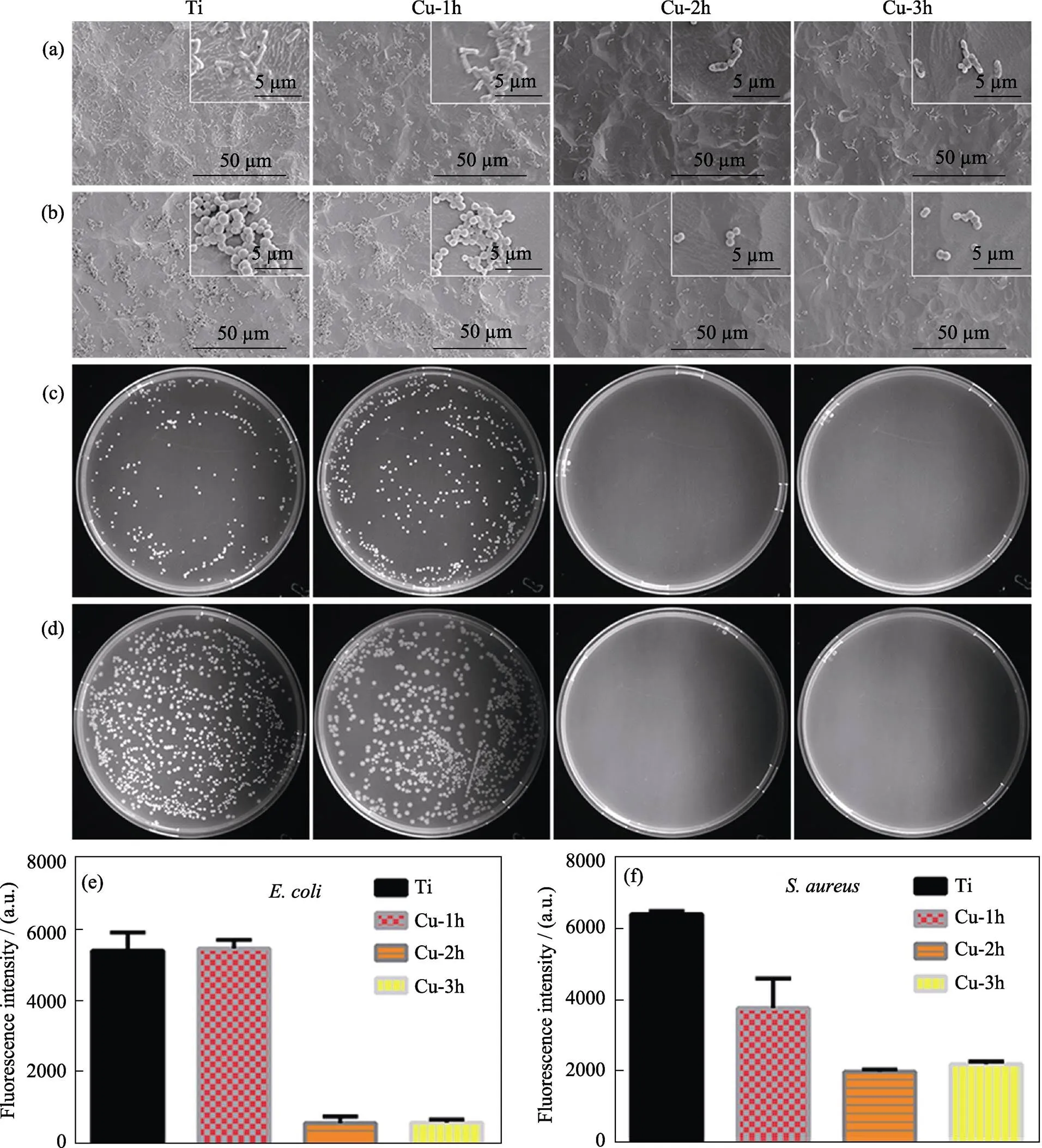
图4 不同样品表面大肠杆菌(a,c,e)和金黄色葡萄球菌(b,d,f)的SEM照片(a,b)、在琼脂板上培养后的菌落生长状况(c,d)和阿尔玛蓝共培养后菌液的荧光强度(e,f)
以上结果表明, Cu-1h不具有抗菌性能; 随着注入时间延长, 钛表面的含铜量逐渐提高, Cu-2h和Cu-3h的抗菌性能显著提高。从样品的铜离子释放量来看, Cu-2h和Cu-3h的铜离子释放量只是略高于Cu-1h, 但样品的抗菌性能差异明显。文献[30]报道, 细菌表面成分与金属铜之间会产生化学反应, 释放大量铜离子, 从而杀死细菌。Parmar等[31]提出关于铜在细菌体内转运的动力学模型, 该模型表明细菌周质和胞质池对细菌内铜的平衡具有重要作用。此外该模型还预测存在一个阈值浓度, 体外铜浓度超过阈值, 会破坏细菌体内铜的平衡。Cu-1h表面的铜含量较低, 细菌能够维持体内Cu的平衡; Cu-2h和Cu-3h表面铜含量较高, 细菌无法再控制胞内Cu的平衡, 从而使细菌无法在样品表面生长。文献[32]报道, 铜合金具有良好的接触抗菌性能, 能够破坏大肠杆菌的膜磷脂层, 使细菌膜的完整性受损, 从而杀死细菌。因此, 除铜离子外, Cu-2h和Cu-3h表面含铜量较高, 同时具有接触抗菌性能。
2.4 生物相容性
图5是rBMSCs和HUVECs分别在不同样品表面培养1、4和7 d后的细胞增殖情况。从图5(a)可以看出, 细胞培养1 d后, 各组样品表面的rBMSCs增殖并没有显著差异; 但细胞培养4和7 d后, Cu-1h能够显著促进rBMSCs的增殖, 而Cu-2h和Cu-3h对rBMSCs的增殖无明显影响。从图5(b)可以看出, Cu-3h能显著促进HUVECs的增殖。这说明HUVECs对铜的耐受能力较高, 而rBMSCs对铜更加敏感。
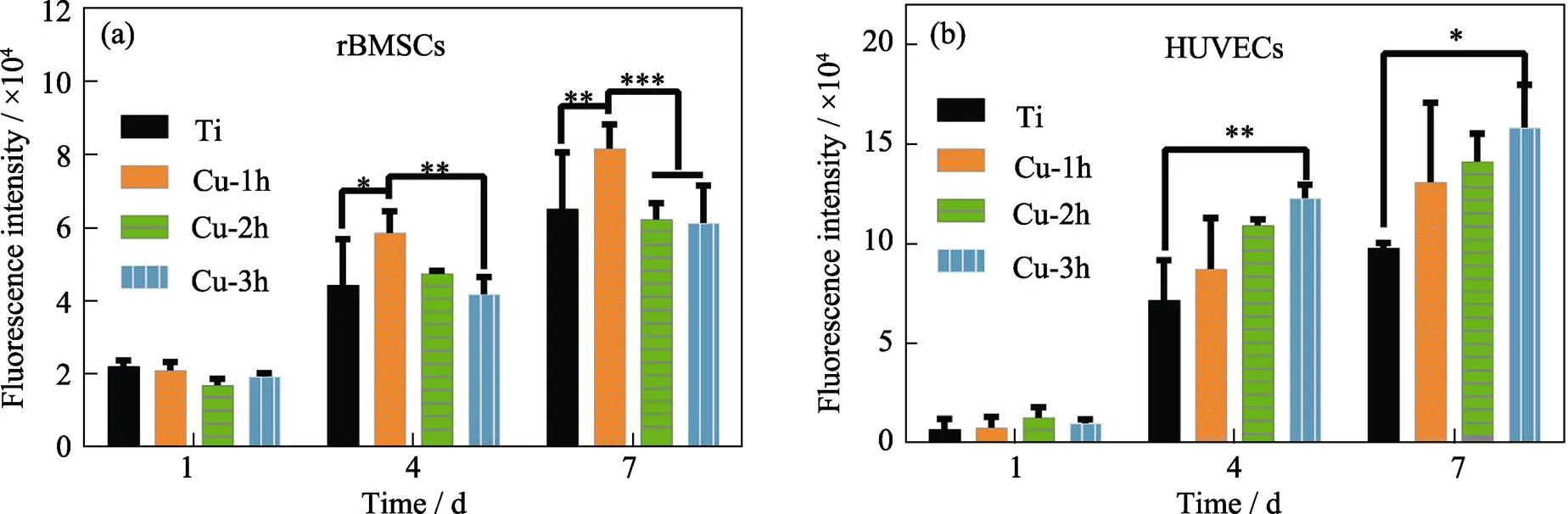
图5 rBMSCs(a)和HUVECs(b)在不同样品表面培养1、4和7 d后的阿尔玛蓝溶液的荧光强度
*< 0.05, **< 0.01, ***< 0.001
铜离子注入后, 酸洗钛表面的微结构消失, 同时提高了样品表面的接触角。样品的耐腐蚀性能和离子释放结果表明铜在钛表面能够稳定释放, 使铜能够持续发挥其生物功能。从样品的铜离子释放量来看, Cu-2h和Cu-3h的铜离子释放量只略高于Cu-1h, 但样品对细菌和细胞的影响却有较大差异。文献[33]报道, 离子注入的元素在基体表面呈非连续分布, 可能会导致样品表面局部区域的含铜量较高。与细胞相比, 细菌体积较小[22-23,34], 单个细菌处于样品表面较高含铜微环境中的体积比较大, 而单个细胞处于样品表面较高含铜微环境中的体积比则较小, 注铜样品对细胞的不利影响较小。Cu-1h能够促进rBMSCs的增殖, 含铜量较高的Cu-2h和Cu-3h对rBMSCs的增殖无明显影响。Gu等[35]的研究表明, 随着铜含量的提高, Cu掺杂的多磷酸钙对细胞的增殖呈现先促进后抑制的规律。可以推测, 继续提高铜的含量, 注铜样品会对rBMSCs和HUVECs产生毒性。另外, Cu-3h能够显著促进HUVECs的增殖。说明HUVECs对铜的耐受能力高于rBMSCs。
3 结论
利用等离子体浸没离子注入技术制备了表面含铜量不同的样品。样品的耐腐蚀性能和铜离子释放结果表明, 铜在钛表面能够稳定存在, 不会产生铜离子爆发性释放。体外细菌和细胞实验表明, 不同铜含量样品对细菌和细胞行为的影响明显不同。注入时间较短的样品能促进细胞的增殖, 但不具有抗菌能力。随着离子注入时间的延长, 样品表面的含铜量增加, 样品抗菌性能显著提高, 同时也仍然具有良好的生物相容性。综上所述, 通过调节钛表面铜离子注入量, 可以获得兼具良好抗菌性能和生物相容性的钛材料。
[1] LEPICKA M, GRADZKA-DAHLKE M. Surface modification of Ti6Al4V titanium alloy for biomedical applications and its effect on tribological performance-a review., 2016, 46(1): 86–103.
[2] LIU X, CHU P, DING C. Surface modification of titanium, titanium alloys, and related materials for biomedical applications., 2004, 47(3/4): 49–121.
[3] YUAN K, CHEN K C, CHAN Y J,Dental implant failure associated with bacterial infection and long-term bisphosphonate usage: a case report., 2012, 21(1): 3–7.
[4] ZHU H, JIN G, CAO H,Influence of implantation voltage on the biological properties of zinc-implanted titanium., 2017, 312: 75–80.
[5] YU Y, JIN G, XUE Y,Multifunctions of dual Zn/Mg ion co- implanted titanium on osteogenesis, angiogenesis and bacteria inhibition for dental implants., 2017, 49: 590–603.
[6] LI J, LIU X, QIAO Y,Antimicrobial activity and cytocompatibility of Ag plasma-modified hierarchical TiO2film on titanium surface., 2014, 113: 134–145.
[7] JIN G, QIN H, CAO H,Zn/Ag micro-galvanic couples formed on titanium and osseointegration effects in the presence of., 2015, 65: 22–31.
[8] YU L, TIAN Y, QIAO Y,Mn-containing titanium surface with favorable osteogenic and antimicrobial functions synthesized by PIII&D., 2017, 152: 376–384.
[9] HU H, TANG Y, PANG L,Angiogenesis and full-thickness wound healing efficiency of a copper-doped borate bioactive glass/ poly(lactic-co-glycolic acid) dressing loaded with vitamin Eand., 2018, 10(27): 22939– 22950.
[10] BARI A, BLOISE N, FIORILLI S,Copper-containing mesoporous bioactive glass nanoparticles as multifunctional agent for bone regeneration., 2017, 55: 493–504.
[11] TIAN T, WU CT, CHANG J. Preparation andosteogenic, angiogenic and antibacterial properties of cuprorivaite (CaCuSi4O10, cup) bioceramics., 2016, 6(51): 45840– 45849.
[12] WENG L, BODA S K, TEUSINK M J,Binary doping of strontium and copper enhancing osteogenesis and angiogenesis of bioactive glass nanofibers while suppressing osteoclast activity., 2017, 9(29): 24484–24496.
[13] LIU R, MEMARZADEH K, CHANG B,Antibacterial effect of copper-bearing titanium alloy (Ti-Cu) against streptococcus mutans and porphyromonas gingivalis., 2016, 6: 29985.
[14] HEMPEL F, FINKE B, ZIETZ C,Antimicrobial surface modification of titanium substrates by means of plasma immersion ion implantation and deposition of copper., 2014, 256: 52–58.
[15] LIU R, TANG Y, ZENG L,andstudies of anti-bacterial copper-bearing titanium alloy for dental application.., 2018, 34(8): 1112–1126.
[16] WALSCHUS U, HOENE A, PATRZYK M,A cell-adhesive plasma polymerized allylamine coating reduces theinflammatory response induced by Ti6Al4V modified with plasma immersion ion implantation of copper., 2017, 8(3): 30.
[17] SHARIFAHMADIAN O, SALIMIJAZI H R, FATHI M H,Relationship between surface properties and antibacterial behavior of wire arc spray copper coatings., 2013, 233: 74–79.
[18] LIU C, FU X, PAN H,Biodegradable Mg-Cu alloys with enhanced osteogenesis, angiogenesis, and long-lasting antibacterial effects.., 2016, 6: 27374.
[19] WANG X, CHENG F, LIU J,Biocomposites of copper-containing mesoporous bioactive glass and nanofibrillated cellulose: biocompatibility and angiogenic promotion in chronic wound healing application., 2016, 46: 286–298.
[20] LU T, QIAO Y, LIU X. Surface modification of biomaterials using plasma immersion ion implantation and deposition., 2012, 2(3): 325–336.
[21] TIAN Y, CAO H, QIAO Y,Antimicrobial and osteogenic properties of iron-doped titanium., 2016, 6(52): 46495–46507.
[22] QIU J, LIU L, CHEN B,Graphene oxide as a dual Zn/Mg ion carrier and release platform: enhanced osteogenic activity and antibacterial properties., 2018, 6(13): 2004–2012.
[23] DING Z, QIAO Y, PENG F,Si-doped porous TiO2coatings enhancedangiogenic behavior of human umbilical vein endothelial cells., 2017, 159: 493–500.
[24] WANG H, LU T, MENG F,Enhanced osteoblast responses to poly ether ether ketone surface modified by water plasma immersion ion implantation., 2014, 117: 89–97.
[25] ANANTH A, DHARANEEDHARAN S, HEO M S,Copper oxide nanomaterials: synthesis, characterization and structure-specific antibacterial performance., 2015, 262: 179–188.
[26] JOLLEY J G, GEESEY G G, HANKINS M R,Auger-electron and X-ray photoelectron spectroscopic study of the biocorrosion of copper by alginic acid polysaccharide., 1989, 37(4): 469–480.
[27] PARMIGIANI F, PACCHIONI G, ILLAS F,Studies of the Cu–O bond in cupric oxide by X-ray photoelectron-spectroscopy andelectronic-structure models., 1992, 59(3): 255–269.
[28] MILLER A C, W S G. Copper by XPS., 1993, 2(1): 55–60.
[29] NISHIMOTO S, BHUSHAN B. Bioinspired self-cleaning surfaces with superhydrophobicity, superoleophobicity, and superhydrophilicity., 2013, 3(3): 671–690.
[30] LIU S, ZHANG XX. Small colony variants are more susceptible to copper-mediated contact killing for pseudomonas aeruginosa and staphylococcus aureus., 2016, 65: 1143–1151.
[31] PARMAR J H, QUINTANA J, RAMIREZ DAn important role for periplasmic storage in pseudomonas aeruginosa copper homeostasis revealed by a combined experimental and computational modeling study., 2018, 110(3): 357–369.
[32] HONG R, KANG T Y, MICHELS C A,Membrane lipid peroxidation in copper alloy-mediated contact killing of, 2012, 78(6): 1776–1784.
[33] XIA C, CAI DS, TAN J,Synergistic effects of N/Cu dual ions implantation on stimulating antibacterial ability and angiogenic activity of titanium., 2018, 4(9): 3185–3193.
[34] TAN J, WANG D H, CAO H L,Effect of local alkaline microenvironment on the behaviors of bacteria and osteogenic cells., 2018, 10(49): 42018–42029.
[35] GUO C R, LI L, LI S S,Preparation, characterization, bioactivity and degradation behaviorof copper-doped calcium polyphosphate as a candidate material for bone tissue engineering., 2017, 7(67): 42614–42626.
Titanium Modified by Copper Ion Implantation: Anti-bacterial and Cellular Behaviors
LI Kun-Qiang1,2, QIAO Yu-Qin1, LIU Xuan-Yong1,2
(1. The State Key Lab of High Performance Ceramics and Superfine Microstructure, Shanghai Institute of Ceramics, Chinese Academy of Sciences, Shanghai 200050, China; 2. Center of Materials Science and Optoelectronics Engineering, University of Chinese Academy of Sciences, Beijing 100049, China.)
Titanium and its alloys have been wildly used as bone implants. However, it is still facing a severer issue: implant related infections due to the lack of antibacterial ability. Copper (Cu) has good antibacterial ability and can be used to improve the anti-infection capability of titanium. In this study, three kinds of Ti samples with different contents of Cu in the modified layer were prepared by plasma immersion ion implantation (PIII) technology, and their responses to bacteria and cells were exploredThe results showed that the sample with low Cu content at the surface could promote the proliferation of rat bone marrow mesenchymal stem cells (rBMSCs) and human umbilical vein endothelial cells (HUVECs) but not inhibit the proliferation of() and(). As the implantation time extends, antibacterial ability of the samples with high Cu content at the surface was significantly enhanced, and no obvious cytotoxicity was observed.Therefore, it is possible to acquire a balance between antibacterial ability and biocompatibility of Ti by controlling the contents of Cu in the modified layer.
ion implantation; biocompatibility; copper; antibacterial
R318
A
1000-324X(2020)02-0158-07
10.15541/jim20190105
2019-03-09;
2019-04-03
国家重点研发计划(2016YFC1100604); 国家自然科学基金重点项目(51831011); 国家重点实验室主任青年基金 (SKL201606)
National Key Research and Development Program of China (2016YFC1100604); National Natural Science Foundation of China (51831011); Science Foundation for Youth Scholar of State Key Laboratory of High Performance Ceramics and Superfine Microstructures(SKL201606)
李昆强(1993–), 男, 硕士研究生. E-mail: kunqiangli@163.com
LI Kun-Qiang(1993–), male, Master candidate. E-mail: kunqiangli@163.com
刘宣勇, 研究员. E-mail: xyliu@mail.sic.ac.cn
LIU Xuan-Yong, professor. E-mail: xyliu@mail.sic.ac.cn
猜你喜欢
杂志排行
无机材料学报的其它文章
- 硫化镍引发钢化玻璃自爆的临界尺寸及影响
- Interfacial Stress Analysis on Skutterudite-based Thermoelectric Joints under Service Conditions
- 巯基改性SBA-15的制备及其对Cr6+的吸附
- Powder Characteristics on the Rheological Performance of Resin-based Zirconia Suspension for Stereolithography
- 氧化锆基微量元素共掺杂羟基磷灰石增韧涂层研究
- Aluminum Hydroxide Nanosheets with Structure-dependent Storage and Transportation toward Cancer Chemotherapy
