128 例再次心脏瓣膜置换术早期疗效观察
2020-03-09郑才斌
黄 烽 韩 涛 郑才斌
1 福建省立医院心脏血管外科,福建医科大学省立临床医学院,福建 福州 350001
2 南平市第一医院胸心外科,福建 南平 353001
随着时间推移,既往因各类心脏疾病而进行心脏外科 手术的患者或因各种原因包括初发疾病手术未涉及瓣膜出现新发瓣膜的病变,或原有瓣膜术后出现瓣膜相关并发症,以及感染性心内膜炎等原因导致需要再次处理原手术瓣膜,或者其余未手术瓣膜进行性改变,如风湿性病变,瓣膜退行性改变等需再次心脏手术治疗。这些患者由于年龄增长,病程时间较长,二次或者多次手术,不可避免的增加了手术难度和手术风险,本文探讨再次心脏瓣膜置换术早期疗效观察,现报道如下。
1 资料与方法
1.1 一般资料
选取2000 年1 月至2015 年12 月在福建省立医院共收纳128 例接受心脏瓣膜再次置换的患者。男性50 例,女性78 例。年龄21~70 岁,平均(45.6±11.4)岁,距前次换瓣时间间隔0.75~29 年,平均(10.99±5.56)年;术前心功能分级(NYHA):Ⅱ级6 例,Ⅲ级100 例,Ⅳ级22例;术前心脏二维超声:左房内径(LAD)2.25~10.40cm,平均(4.93±1.27)cm,左室舒张末期内径(LVEDD)2.96~9.15cm, 平 均(5.19±1.15)cm, 左 室 射 血 分 数(LVEF)30.1%~70.0%,平均(54.03±9.51)%;术前心胸比0.48~0.85,平均(0.65±0.09)。术前合并房颤者72 例,合并糖尿病者11 例,合并高血压者20 例,合并肺动脉高压者32 例,合并冠心病者6 例,肺部感染者14 例;再次换瓣主要原因为风湿性心脏病变由二尖瓣病变发展至主动脉瓣、三尖瓣继发病变、生物瓣衰败和机械瓣相关并发症等。原术式为二尖瓣置换术(MVR)者86 例,其中生物瓣20 例,机械瓣66 例;主动脉瓣置换术(AVR)者12例,其中生物瓣6 例,机械瓣6 例;二尖瓣联合主动脉瓣置换术(DVR)者30 例,其中生物瓣2 例,机械瓣28 例;其中此次再次手术中,126 例为第二次换瓣手术,2 例为第三次换瓣手术。
1.2 方法
1.2.1 术前准备
入院后根据其心脏功能,年龄及并发症等术前检查结果,有针对性的使用改善心功能如多巴胺、多巴酚丁胺、心肌营养药物等药物应用,加强利尿并纠正电解质紊乱:加强全身营养营养;呼吸功能锻炼;监测并控制血糖水平;摄胸部正侧位片或者胸部计算机断层扫描(CT),胸骨后心包黏连情况及主动脉情况,避免开胸时大出血,并确定术中主动脉插管部位[1]。
1.2.2 手术方法
患者均采用常规气静复合全麻、中低温或者浅低温下进行,均采用胸部正中原切口入路,消毒范围可以略微扩大,双侧腹股沟区同样消毒备股动静脉插管。术中开胸时需根据术前影像资料,确认是否先行股动静脉插管转流后开胸。在充分暴露心脏及主动脉并充分止血后再行全身肝素化。心尖部位的游离,根据粘连情况在转流前或者转流后进行松解。128 例患者,114 例患者常规经由升主动脉及上下腔静脉插管建立体外循环,14 例采用了经股、动静脉插管或联合上下腔静脉插管建立体外循环。除部分单纯三尖瓣置换术,使用不停跳下完成,其余心肌保护液使用常规含钾晶体停跳液或组氨酸-色氨酸-酮戊二酸盐液(HTK 液),根据主动脉瓣关闭不全及冠脉开口情况分别采用经升主动脉根部灌注、切开后冠状动脉开口直接灌注,或采取结合冠状静脉窦逆灌的灌注方法,停跳后心肌表面撒冰屑降温。完整切除或保留部分原瓣膜,双头针带垫片间断缝合法行再次瓣膜置换术。三尖瓣成形术为DeVega 或者三尖瓣环成形,再次换瓣手术方式见表1。
1.2.3 术后处理
常规送监护室监护,关注纵膈及胸腔引流量,根据激活全血凝固时间(ACT)值应用鱼精蛋白中和肝素,维持负压吸引,防止发生心脏填塞。严密观察血压、心率等指标变化。定时查动脉血气分析,纠正内环境,调整酸碱平衡,保持电解质稳定,尿量正常。术后通常根据循环情况予多巴胺、多巴酚丁胺、肾上腺素、硝酸甘油等血管活性药物应用。密切监视尿量,监测血液肌酐变化,必要时早期干预,使用床旁血液滤过。
1.3 统计学方法
采用SPSS 23.0 软件进行统计学分析,计量资料以(±s))表示,组内比较采用配对t检验;计数资料以n(%)表示;P<0.05 时为差异有统计学意义。
2 结果
2.1 临床资料
128 例患者,手术总时长146~1100 min,平均(338.60± 154.92) min;出血量50~6000 ml,平均(940.56±656.55)ml;输血量0~3000 ml,平均(523.9±461.35)ml;主动脉阻断时间0~233 min,平均(74.52±47.92)min;体外循环时间55~419 min,平均(157.88±69.82)min;纵膈胸管留置时间3~8 d,平均(4.26±2.76)d;在监护室时间1~17 d,平均(4.52±2.57)d;呼吸机使用时间8~ 311 h,平均(42.53±31.21)h,术后住院时间9~37d,平均(15.5±8.56)d。
2.2 住院期间相关结果
128 例患者中术后死亡18 例,病死率为14.1%。术后并发症包括:肺部感染;低心排综合征(LCOS),其中8 例死亡;大量出血,其中2 例死亡;大量胸腔积液;多脏器功能衰竭(MODS)其中4 例死亡;室颤,其中1例死亡;急性左心功能衰竭,其中3 例死亡。在院死亡18 例,病死率为14.1%,见表2。128 例患者,术后1 周LAD、LVEDD 和LVEF 较术前改善,差异有统计学意义(P<0.05,表3)。

表1 128 例患者再次换瓣采用的手术方式
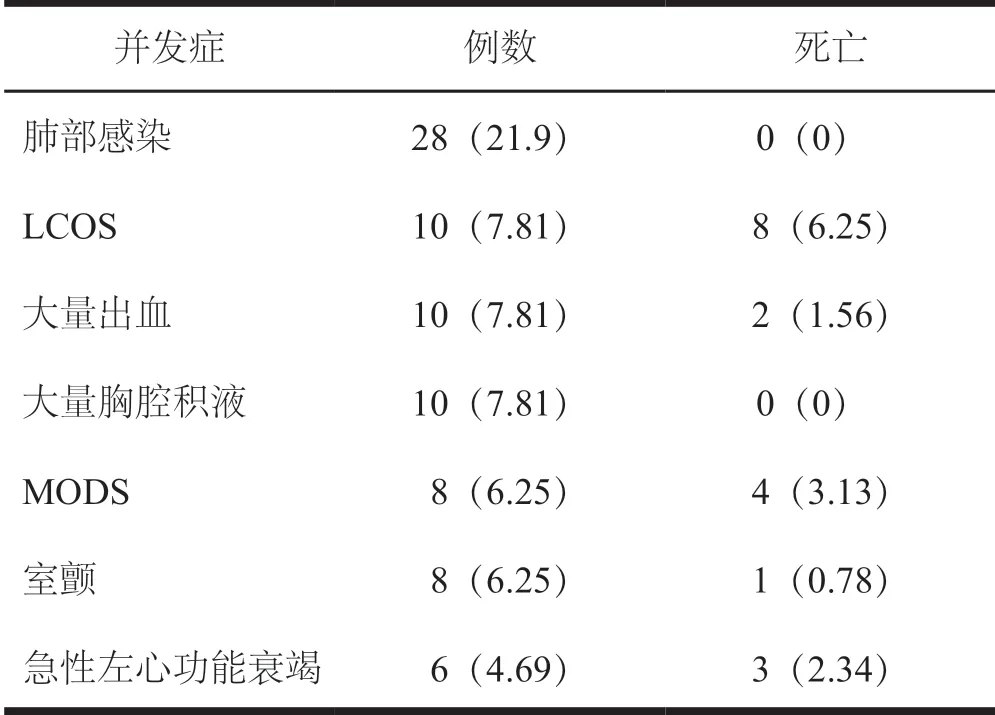
表2 128 例患者术后并发症及死亡统计[n(%)]
3 讨论
中国作为发展中的国家,人口众多,医疗发展不均衡,心脏瓣膜病发病率高,而且由于第一次手术后通常未规律、系统的随访和治疗,所以出现各种原因导致的瓣膜病变,进而再次手术。通过本研究对128 例再次手术患者进行回顾性分析,对手术的早期治疗过程做一个初步总结。
导致心脏再次换瓣的病变原因很多,常见的原因有风湿性心脏病变进展、生物瓣衰败、三尖瓣继发病变、机械瓣相关并发症。其中风湿病后主动脉瓣继发病变和生物瓣衰败占多数[2-3]。不同病因对于术前准备有重要意义,如病程长短,术前心功能变化的程度,全身情况,基础疾病等[4-5]。
心脏瓣膜病再次置换患者通常病程较长,术后没有坚持长期随访复查,而且除心脏瓣膜本身疾病外,常合并有高血压、糖尿病、肺部感染、脑血管疾病、肝肾功能不全、电解质紊乱等并发症。本组患者中,心功能Ⅲ~Ⅳ级者共122 例占比95.3%,射血分数<50%者共有44 例占比34.4%,术前心功能差及射血分数低是术后远期病死率相关的危险因素。因此,术前予以足量足程的强心、利尿、心肌营养等治疗,通过改善心脏前后负荷,减轻肺淤血及肝肾等淤血情况,增强各脏器功能。同时术前必须积极呼吸功能锻炼,加强雾化、协助排痰。对于术前全身营养状况不佳者,需予以加强营养支持,纠正负氮平衡,监测肌酐、尿素氮的变化。因为二次手术患者,手术时间长、出血多、对于术后出血,呼吸及肾功能的打击需要充分考虑到,如果出现术后肾功能不全应尽早使用床旁血液透析。在肝素化前应用自体血液回收装置,可以极大的减少用血量,当然术前也必须备足量的滤白红细胞悬液、新鲜冰冻血浆、单采血小板,用于术中及术后失血的纠正[6-8]。
表3 128 例患者术前与术后1 周心脏彩超 比较(±s))
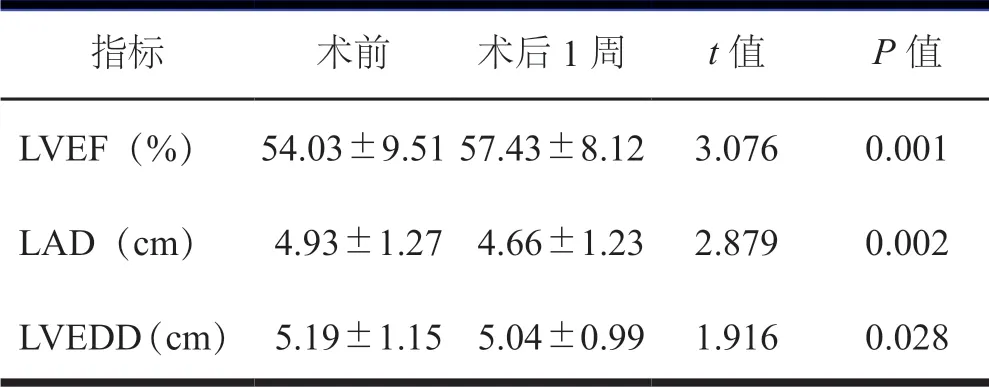
表3 128 例患者术前与术后1 周心脏彩超 比较(±s))
指标 术前 术后1 周 t 值 P 值LVEF(%) 54.03±9.51 57.43±8.12 3.076 0.001 LAD(cm) 4.93±1.27 4.66±1.23 2.879 0.002 LVEDD(cm) 5.19±1.15 5.04±0.99 1.916 0.028
再次换瓣手术的术中技术难点在于胸骨后黏连组织的分离、瓣膜手术视野的显露、体外循环的安全建立。 (1)采用胸部正中切口入路时,在锯开胸骨前不要过早抽出原固定胸骨的钢丝,在锯胸骨时将左右钢丝提拉牵引,并作为锯开胸骨的警示点,可感觉到摇摆锯和钢丝的摩擦;在剑突下、膈面及胸骨后黏连组织尚未松解游离前,应尽量避免使用大的胸骨撑开器,以免造成心肌撕裂导致大出血,故术前阅读胸部侧位片了解胸骨后黏连程度尤为重要。(2)心包内游离主动脉,心房面以钝性分离为主,心室面以锐性分离为主,如果黏连比较紧密,可将右侧或双侧纵膈胸膜打开,经心包外游离上下腔静脉;高危患者可以体外循环下转流后,心脏放空后再充分游离。(3)术前常规消毒腹股沟区,必要时使用股动静脉插管转流,可以应用体外除颤电极,这样既可以于开胸、心脏游离、体外循环建立之前,发生大出血、室颤、心跳骤停时抢救应用,也可用于手术完成后心脏复苏和除颤[9-11]。
本组术后早期并发症主要包括肺部感染28 例、LCOS 10 例、大量出血10 例、大量胸腔积液10 例、室颤8 例、MODS 8 例、急性左心功能衰竭6 例。肺部并发症的原因多缘于气管插管和体外循环过程中肺部组织炎症反应引起的肺部损伤。尤其二次手术,手术困难,体外循环时间长。此外,术中操作、术后的气道管理等对肺部的感染都有比较重要的影响。128 例患者术后出现大量出血及胸腔积液的并发症较多,面对此类患者,除了止血、通畅引流处理外,若患者生命征转向不稳时,需果断再次行开胸探查止血术,以免错失最佳抢救时机[12]。共有8 例出现室颤,经电除颤后7 例转复,1 例死亡,对于长期强心利尿的患者,更需要注意电解质的变化,尤其是钾的变化,可维持于4.5 mmol/L 以上。本组术后在院死亡18例,总病死率为14.1%,明显高于初次换瓣手术1-3%的死亡率。死亡原因主要为LCOS、MODS、急性左心功能衰竭等,这与术前心功能不佳,手术时间长,体外循环时间过长都有密切关系。若出现低心排综合征等患者经上述处理无好转,可予应用体外膜肺氧合(ECMO)。术后1 周心功能、LVEF、LAD、LVEDD 等指标较术前明显改善,对于此类患者,再次手术是有效的治疗手段[13]。
综上所述,再次换瓣手术患者,虽然手术困难、风险大、并发症多,但经过完善的术前准备,术中操作精细,能够获得良好的效果。
