血管内超声导管联合微泡增强尿激酶溶栓的实验研究
2020-03-08朱贤胜高顺记
董 睿 朱 琼 冯 爽 朱贤胜 高顺记 刘 政
深静脉血栓形成是一种常见的外周血管血栓性疾病,血栓脱落可引起肺动脉栓塞、脑梗死等严重并发症。下肢深静脉血栓即使接受规范的抗凝治疗,仍有30%~50%患者发展为血栓后综合征,出现患肢肿胀、静脉性跛行等[1]。超声溶栓是超声空化治疗技术的应用之一,其通过超声发射产生的空化效应增强药物溶栓的疗效[2-4]。研究[5-6]显示微泡作为一种有效的空化核,可增强诱导超声空化效应,提高超声溶栓效果。EKOS®超声导管是一种经血管腔内的新型超声溶栓方法,在不联合微泡的情况下,该超声导管应用于临床治疗肺动脉栓塞和静脉血栓等已取得肯定的效果[7-8]。本实验通过经EKOS®超声导管血栓内注射微泡和尿激酶进行体外溶栓,旨在探讨EKOS®超声导管联合血栓内注射微泡增强尿激酶体外溶栓治疗效果。
材料与方法
一、主要实验试剂与仪器
1.实验试剂:无菌抗凝新生牛血、无水氯化钙、4%组织细胞固定液(北京索莱宝科技有限公司);牛血浆(郑州九龙生物制品有限公司);注射用尿激酶(丽珠集团丽珠制药厂);注射用全氟丁烷微球(1.2×109/ml,Sonazoid®,GE 医疗,挪威);PBS 缓冲液(武汉博士德生物工程有限公司)。
2. 仪器:EKOS®超声导管系统(MACH4,美国EKOS 公司),配备多侧孔给药鞘管、多阵元超声发射轴芯和EkoSonic 控制单元,其轴芯在治疗区有12个微型超声换能器,发射频率2.2 MHz。针式水听器(HNC-0400,美国ONDA 公司);微量蠕动泵(BT-100E,重庆杰恒蠕动泵有限公司);恒温水浴箱(德国HUBER公司);双通道微量输液泵(上海蓝德医疗机械有限公司);电子天平(UTP-313,上海花潮电器有限公司);荧光显微镜(BX3-CBH,日本OLYMPUS公司)。
3.体外循环装置:由微量蠕动泵和自制模拟体循环的管道组成,在管道的入口处以三通管连接另一管道入口用于插入EKOS®超声导管,血栓样品池两端设有管道以模拟人体血栓形成时开放的侧支循环,置整个循环管道于37℃恒温水浴箱中。见图1。循环液为含10%牛血浆的PBS液,蠕动泵以60 r/min工作。
二、实验方法
1.EKOS®超声导管声学参数测量:应用HNC-0400针式水听器(灵敏度为1.228×10-7),分别于换能器晶片距水听器1、2、3、4、5 mm处,测量峰值负压并记录。

图1 体外溶栓实验循环装置示意图
2.血栓制备:取无菌抗凝新生牛血制备血栓90份,每份8 ml,置于预先加入5%氯化钙溶液(33 μl/ml)的圆底EP管中,于37℃恒温水浴箱中温育3 h后取出,去除血清,PBS 液冲洗3 次,滤纸吸干血栓表面液体后应用电子天平称量血栓的初始质量(W0)。
3.实验分组及步骤:采用Excel随机数字表法将前期制备的90份同质血栓样本随机分为6组,每组15份,分别为:超声+微泡+尿激酶联合组(联合组)、超声+尿激酶组(US+UK 组)、超声+微泡组(US+MB 组)、超声组(US 组)、尿激酶组(UK 组)和对照组。各实验组血栓栓龄相同,具有可比性。
将10 万U 尿激酶和/或0.02 ml Sonazoid®造影剂以0.9%无菌生理盐水稀释至5.0 ml(微泡浓度为4.8×106/ml),并全部吸入微量输液泵Ⅰ通道的注射器中,然后与EKOS®超声导管的Drug端口连接;输液泵Ⅱ通道放置充满50.0 ml 0.9%无菌生理盐水的注射器,并以100 ml/h 的速度向EKOS®超声导管的Coolant 端口注入,以扩散超声传感器产生的热能。联合组采用经EKOS®超声导管匀速(10 ml/h)向血栓内注入10 万U尿激酶和0.02 ml Sonazoid®造影剂稀释液;US+UK 组和UK 组以同样方法注入10 万U 尿激酶稀释液;US+MB 组注入0.02 ml Sonazoid®造影剂稀释液;US 组和对照组注入5.0 ml无菌生理盐水。同时根据分组情况,对联合组、US+UK 组、US+MB 组和US组采用经EKOS®超声导管进行超声辐照,UK 组和对照组不予超声辐照,各组处理时间均为30 min。然后取出血栓,以PBS液冲洗3次,用滤纸吸干血栓表面液体,再次应用电子天平称量血栓质量(Wt)。
三、评价和观测指标
计算各组血栓溶栓率,公式为:溶栓率=(W0-W1)/W0×100%。将溶栓处理后血栓置于4%组织细胞固定液中固定,制成石蜡切片,并进行HE 染色。于荧光显微镜下观察各组血栓中红细胞和纤维蛋白的分布情况。
四、统计学处理
结 果
一、EKOS®超声导管声学参数测量结果
导管换能器占空比为24.86%,峰值负压范围为0.4~6.4 MPa,呈无规律动态变化。
二、各组血栓样本W0和溶栓率比较
各组血栓样本W0、溶栓率比较情况见表1和图2。各组血栓样本W0比较,差异无统计学意义(χ2=10.033,P=0.074)。联合组溶栓率与US+UK 组溶栓率相近,均显著高于其余各组,差异均有统计学意义(均P<0.05)。US+MB 组溶栓率与UK 组溶栓率相近,均高于US组和对照组,差异均有统计学意义(均P<0.05)。

表1 各组溶栓前后血栓质量和溶栓率比较

图2 各组溶栓率比较柱状图和散点图
三、组织学表现
光镜观察结果显示,联合组和US+UK组与EKOS®超声导管接触处的血栓可见较多崩解,红细胞分布较其余各组更稀疏;UK 组血栓可见少量溶解灶,红细胞分布较稀疏;余各组血栓仍较致密,未见明显血栓溶解区。见图3。
讨 论
近年来,超声溶栓已成为治疗深静脉血栓的一种新方法。超声波作为一种机械波,一方面可以机械性地破坏血栓,同时也可以激励空化核产生空化效应,其释放的声辐射、微射流、冲击波等机械能量进一步使血栓裂解,产生更多的孔隙,利于溶栓药物的渗透,进而提高溶栓效率[2,9]。微泡作为一种有效的空化核,是诱导超声空化效应的关键,可显著降低发生空化效应的声压阈值[10]。研究[11-13]结果表明在适合微泡空化的条件下,超声联合微泡可显著提高溶栓效果。EKOS®超声导管结合了导管介入溶栓和高频超声,可通过超声能量使纤维蛋白链可逆性分解,允许更多地暴露血栓内纤溶酶原受体位点,同时经多侧孔超声导管使溶栓药物直接作用于血栓内部,使血栓局部药物浓度增高,作用增强,从而减少了溶栓药物的用量和治疗时间[14-15]。该导管系统的换能器发射频率为2.2 MHz。研究[16]表明2.2 MHz 的超声频率与载尿激酶的微泡联合使用可产生最优的再通率,部分原因可能是超声频率与微泡的振动频率相似,可引起微泡谐振产生最佳的溶栓效果。本实验应用EKOS®超声导管联合血栓内注射微泡和尿激酶的方法,对体外牛血血栓进行溶栓实验,旨在探讨EKOS®超声导管联合微泡增强尿激酶溶栓效果。
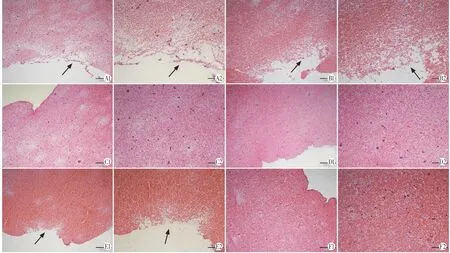
图3 各组治疗后血栓病理图(HE染色)
本实验结果显示,US+UK 组的溶栓率为(42.0±3.3)%,高于UK 组的溶栓率(27.8±3.1)%,差异有统计学意义(P<0.05),表明EKOS®超声导管产生的空化效应和机械效应有助于血栓溶解,并与HE 染色光镜观察结果相符。US+MB 组的溶栓率为(28.4±3.3)%,高于US 组的溶栓率(23.9±3.0)%,差异有统计学意义(P<0.05),但联合组的溶栓率(41.9±4.5)%与US+UK组的溶栓率相近,表明在超声和尿激酶两者作用的基础上,微泡的加入并未进一步提高溶栓率。分析其原因,一方面可能是由于EKOS®超声导管的频率为2.2 MHz,声压在0.4~6.4 MPa,呈无规律动态变化,高声压的超声能量瞬间击破微泡,产生粒径更小的空化核,而2.2 MHz 的频率不能与该小粒径的微泡产生较好的谐振,从而削弱了超声空化效应;加之血栓较致密,微泡在导管侧孔两侧不能及时弥散,导致微泡大量堆积形成微泡层,阻挡了超声能量的穿透,从而导致溶栓效率有限。另一方面,在未应用尿激酶时,微泡介导的超声溶栓率较单纯的超声溶栓率有所提高,应用尿激酶后,超声和尿激酶两者联合作用产生的溶栓效果已经很显著,EKOS®超声导管激励微泡增加的有限的溶栓效果可能被超声联合尿激酶产生的溶栓效果掩盖,故联合组的溶栓率较US+UK 组无明显变化。此外,有研究[17]发现,在微泡介入的情况下,由于微射流、自由基生成、声流和剪切应力的增加,致使酶失活、变性或断裂,最终导致溶栓药物的活性降低。本实验采用的EKOS®超声导管其声压最大可达6.4 MPa,诱导产生剧烈的瞬态空化,也有可能使尿激酶活性下降。本实验US+MB组的溶栓率与UK组比较差异无统计学意义,表明超声联合微泡溶栓与单纯使用尿激酶溶栓具有相似的溶栓效果。
本实验的局限:作为EKOS®超声导管联合微泡和尿激酶进行溶栓实验的初步研究,本实验在体外采用抗凝牛血人工诱导形成的新鲜血栓上进行,未能在动物实验中进一步验证其有效性。此外,本实验未说明因延长血栓形成时间及延长或缩短治疗时间而导致的血栓质量减少的差异,有待后续进一步完善。
综上所述,EKOS®超声导管可明显增强尿激酶的体外溶栓效果,但在此基础上,增加微泡对溶栓率的提高并不明显。结合对EKOS®超声导管的声学参数测量可发现该导管的设计制作并不利于微泡发生空化效应,但EKOS®超声导管联合尿激酶是治疗深静脉血栓形成的一种很有前途的方法。
