长链非编码RNA TDRG1表达对非小细胞肺癌预后判断的价值
2020-03-08汪勇孙宝林朱骏徐骁晗
汪勇,孙宝林,朱骏,徐骁晗
(1.南京市溧水区人民医院 胸外科,江苏 南京 211200; 2.南京医科大学第一附属医院心脏大血管外科,江苏 南京 210029)
研究表明,人类编码蛋白质的基因仅占总基因组的2%,而非编码RNA占人类基因组的绝大多数。其中有长链非编码RNA(lncRNAs),长度超过200个核苷酸,无蛋白质编码能力[1]。越来越多的证据表明lncRNAs在肿瘤发生中具有致癌作用。例如,LncRNA烟酰胺核苷酸反义转氢酶RNA1 (lncRNA nicotinamide nucleotide transhydrogenase-antisense RNA1, lncRNA NNT-AS1)已经显示在某些类型的癌症如肝细胞癌中上调[2]。lncRNA睾丸发育相关基因1(lncRNA testis developmental related gene 1,lncRNA TDRG1)通过结合和靶向血管内皮生长因子A(vascular endothelial growth factor-A, VEGF-A)蛋白增强子宫内膜癌的致瘤性[3]。lncRNA TDRG1可能是上皮性卵巢癌[4]和胃癌[5]中新的重要诊断和治疗靶点。然而非小细胞肺癌(non-small cell lung cancer, NSCLC)中lncRNA TDRG1的临床意义尚未阐明。本研究通过检测人NSCLC组织及其癌旁组织中lncRNA TDRG1的表达水平,探讨lncRNA TDRG1与患者临床特征及预后的相关性。
1 材料与方法
1.1 临床样本收集
收集南京医科大学第一附属医院2010年至2013年接受手术治疗患者的60对NSCLC组织及其相邻的癌旁组织标本,立即置于液氮中保存直至使用。患者的临床和病理资料如表1所示。患者均未接受术前化疗或放疗。本研究经患者所在医院伦理委员会批准,所有患者均签署书面知情同意书,所有标本都按照道德和法律标准进行处理和匿名。

表1 lncRNA TDRG1表达与NSCLC患者临床特征的关系 例
1.2 材料与试剂
TRIzol试剂盒和反转录试剂盒均购自美国Invitrogen公司;染料法荧光定量SYBR Premix Ex TaqⅡ试剂盒购自中国TaKaRa 公司。
1.3 实验方法
1.3.1 RNA提取 按照说明书的实验步骤,使用TRIzol试剂盒提取组织样品的总RNA,使用反转录试剂盒将RNA反转录为cDNA。反转录反应条件:37 ℃ 30 min,然后85 ℃持续5 s,保持在4 ℃。
1.3.2 实时荧光定量聚合酶链反应(qRT-PCR) 使用SYBR Premix Ex Taq Ⅱ试剂盒实时PCR检测系统进行qPCR以定量lncRNA TDRG1。按如下条件进行PCR扩增:95 ℃ 30 s,然后95 ℃变性5 s、60 ℃退火60 s、72 ℃延伸30 s共40个循环。使用甘油醛-3-磷酸脱氢酶(GAPDH)作为内部对照。lncRNA TDRG1引物:上游5′-GAAGAGGAGGGAGGCAGTCT-3′,下游5′-GGGAACCTAGACCTGGGAAG-3′;GAPDH引物:上游5′-GGAGCGAGATCCCTCCAAAAT-3′,下游5′-GGCTGTTGTCATACTTCTCATGG-3′。所有实验重复3次。
1.4 统计学处理
统计分析使用STATA 12.0和SPSS 19.0。采用配对t检验比较癌组织与癌旁组织的lncRNA TDRG1表达水平,卡方检验评估lncRNA TDRG1表达与临床病理特征之间的相关性,单因素和多因素Cox风险模型分析临床病理特征对预后的影响,Kaplan-Meier生存分析计算总生存期。P<0.05认为差异具有统计学意义。
2 结 果
2.1 lncRNA TDRG1表达在NSCLC肿瘤组织中上调
与邻近癌旁组织相比,NSCLC组织中lncRNA TDRG1表达显著升高(t=6.047,P=0.026,图1A),提示lncRNA TDRG1与NSCLC的发展有关。
2.2 lncRNA TDRG1表达与患者临床病理特征之间的关系
lncRNA TDRG1表达与NSCLC患者临床病理特征的关系如表1所示。lncRNA TDRG1的表达在性别(男与女)、年龄(<60岁与≥60岁)、组织类型(腺癌与鳞癌)、肿瘤大小(直径≥3 cm与<3 cm)间差异无统计学意义,但与淋巴结转移显著正相关。无淋巴结转移的肿瘤(N0)与较低的lncRNA TDRG1表达相关,而有淋巴结转移(≥N1)的肿瘤与较高的lncRNA TDRG1表达相关(χ2=6.747,P=0.009,图1B)。另外lncRNA TDRG1表达与肿瘤病理分期显著相关(χ2=21.472,P<0.001,图1C)。

图1 lncRNA TDRG1在肺癌与癌旁组织中的表达 A. lncRNA TDRG1在肺癌组织与癌旁组织中的相对表达量,a 两者比较P<0.05;B. lncRNA TDRG1在N0与N1中的相对表达量,a 两者比较P<0.05;C. lncRNA TDRG1在Ⅰ期与Ⅱ~Ⅲ期中的相对表达量,a 两者比较P<0.05
2.3 lncRNA TDRG1表达与NSCLC患者生存期的关系
Kaplan-Meier分析显示,高lncRNA TDRG1表达组患者的5年总生存期显着短于低lncRNA TDRG1表达组(P<0.001),见图2。
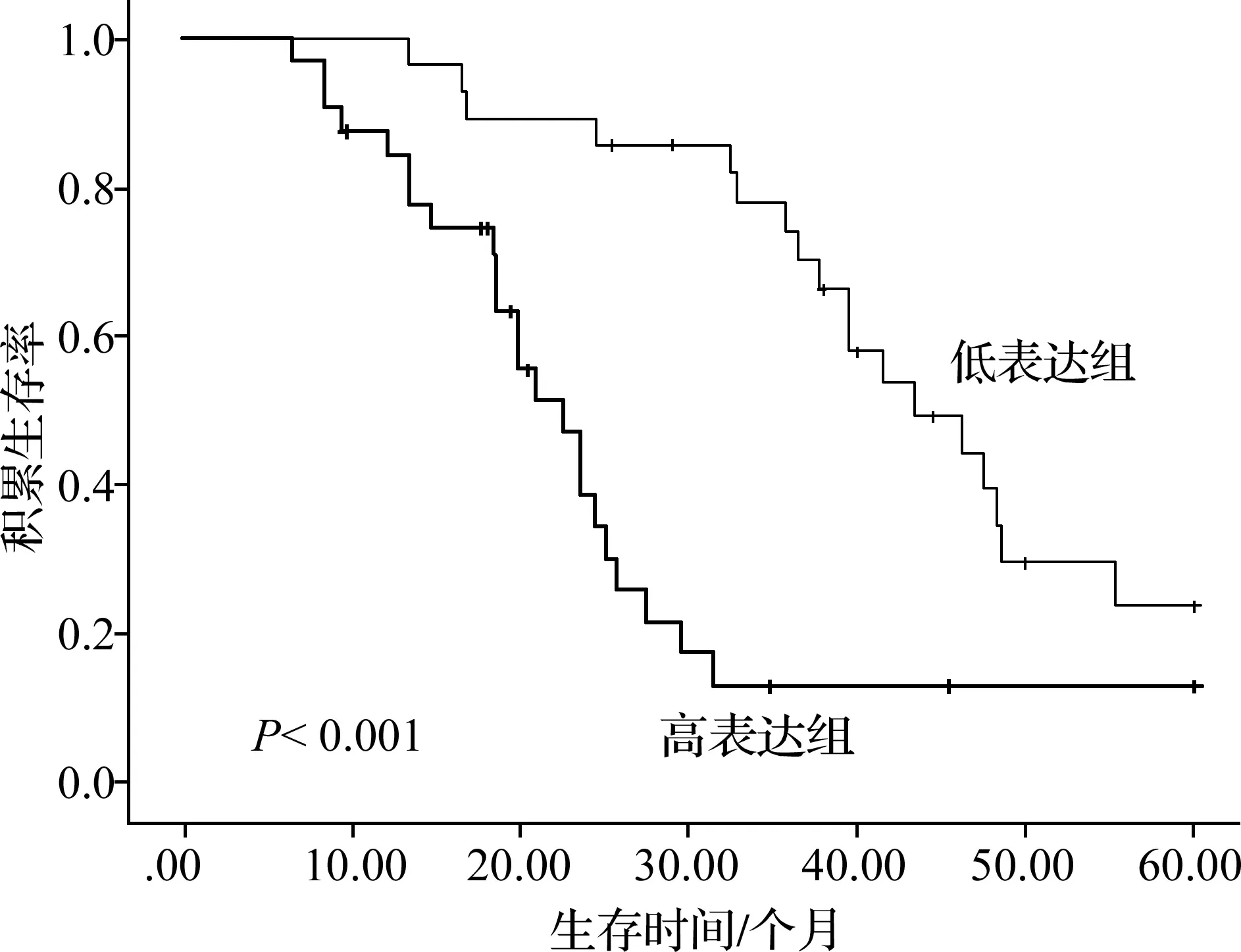
图2 lncRNA TDRG1表达水平与NSCLC患者生存率的相关性
单因素分析(表2)显示,性别、年龄、肿瘤大小及组织类型无统计学意义,但TNM分期、淋巴结转移及lncRNA TDRG1表达具有统计学意义。单因素分析赋值见表3。此外,多变量Cox模型(表4)显示,TNM分期、淋巴结转移及lncRNA TDRG1表达分别可作为5年总生存期的独立预后不良因素。多因素变量分析赋值见表3。

表2 NSCLC患者预后的Cox比例风险回归(单因素)分析

表3 NSCLC患者预后的Cox比例风险回归单因素/多因素分析赋值
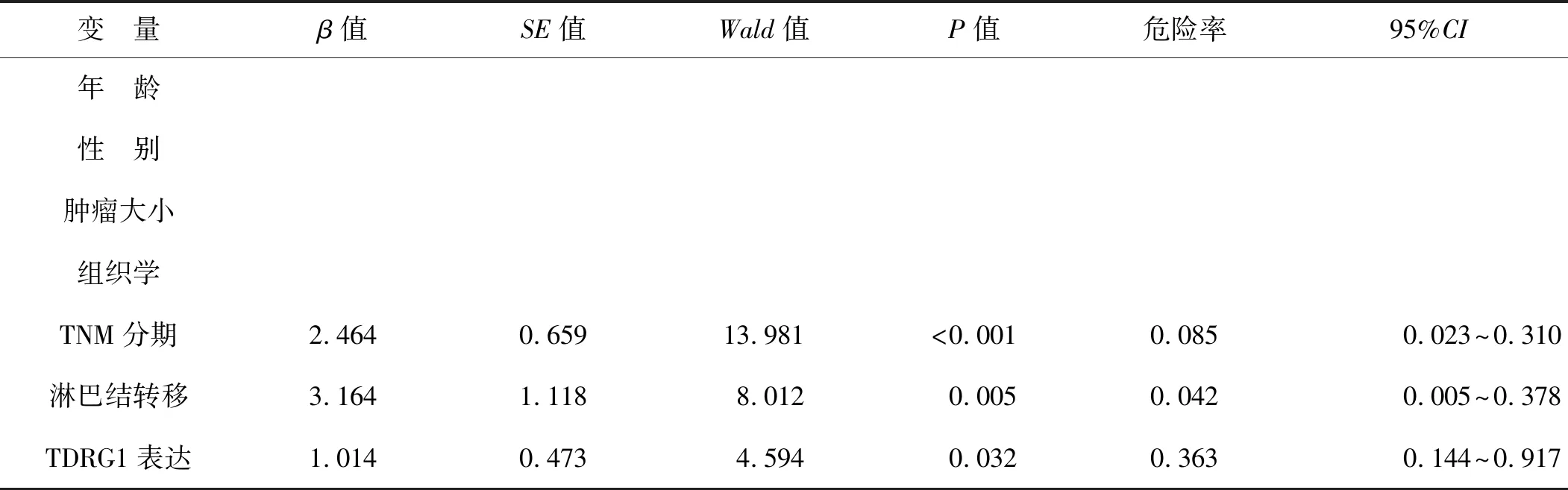
表4 NSCLC患者预后的Cox比例风险回归(多因素)分析
3 讨 论
NSCLC占所有肺癌病例的80%~85%,并且是全球癌症相关死亡的主要原因。尽管在了解NSCLC的分子机制和临床治疗方面取得了进展,但其预后仍然很差,NSCLC患者的5年总生存率为15%。NSCLC患者治疗失败和死亡的主要原因是肿瘤的高转移潜能以及缺乏有效的早期诊断方法。因此确定用于NSCLC早期诊断和治疗的新型生物标志物非常重要。
lncRNAs通常以疾病、组织或发育阶段特异性方式表达,使得这些分子成为有吸引力的治疗靶点,并且指向发育和疾病特别是人类癌症中lncRNA的特定功能。许多研究表明lncRNA可能是肿瘤的潜在诊断标志物。AGAP2 antisense RNA 1(AGAP2-AS1)可能是NSCLC诊断和预后判断的潜在生物标志物[6]。但肺癌中lncRNA TDRG1的差异表达及其预后价值尚未完全阐明。本研究qRT-PCR结果显示,与邻近的癌旁组织相比,NSCLC组织中lncRNA TDRG1的表达显著升高。进一步结合临床特征进行亚组分析发现,lncRNA TDRG1的高表达与TNM分期及淋巴结转移密切相关。该结果表明,lncRNA TDRG1可能参与NSCLC的发生发展尤其是肿瘤的转移过程。lncRNAs具有多种生物功能,包括在细胞增殖、分化和凋亡中的作用。越来越多的证据表明lncRNAs在各种癌症中发挥重要作用。例如,据报道lncRNA BRAF-activated noncoding RNA (lncRNA BANCR)在子宫内膜癌中表达上调,并促进癌细胞增殖和肿瘤发生[7]。另一项研究发现lncRNA肺腺癌转移相关转录因子1 (lncRNA metastasis-associated lung adenocarcinoma transcript 1, lncRNA-MALAT1)通过与核心蛋白复合物PRC2结合,抑制PCDH10表达,从而促进胃癌细胞的侵袭[8]。因此,以后我们将进一步开展体外、体内实验,深入研究lncRNA TDRG1影响NSCLC转移过程的具体分子机制。
此外,lncRNAs已被证实可作为多种疾病的预后因子。例如,lncRNA FOXD2 adjacent opposite strand RNA 1(FOXD2-AS1)的上调预示食管鳞状细胞癌的预后不良[9]。lncRNA重编程调节物(lncRNA regulator of reprogramming, lncRNA ROR)是与NSCLC进展相关的新型预后因子[10]。为探索lncRNA TDRG1对NSCLC预后的影响,本研究采用log-rank检验进行的Kaplan-Meier分析表明,lncRNA TDRG1高表达的患者总体生存时间较低表达患者明显缩短。单因素和多因素分析进一步确定高表达的lncRNA TDRG1可作为患者总体生存的独立预后因子。
本研究尚有一些不足:(1) 临床样本量较少,仅为60例;(2) 针对临床特征的亚组分析不够全面、细致,目前肺腺癌的发病率明显升高,肺腺癌又可细分为原位腺癌、微浸润腺癌、浸润性腺癌;(3) 仅分析了lncRNA TDRG1与5年生存期的关系,而并未全面分析关于疾病复发、无进展生存期等其他预后评价指标。肺癌的发生发展是一个非常复杂的过程,由多个基因多个通路等多种因素综合导致而成。因此,以后仍需扩大样本量进行更全面更细致的亚组分析,为lncRNA TDRG1作为不同类型肺癌患者的潜在分子标靶提供更有力的证据。
总之,我们首次初步证实lncRNA TDRG1表达的上调可能与侵袭性疾病进展及NSCLC的不良预后相关,提示LncRNA TDRG1可能参与NSCLC的癌变过程并成为NSCLC的潜在预后指标。有必要进一步研究lncRNA TDRG1促进NSCLC发生和发展的分子机制。
