微卫星不稳定性及错配修复蛋白表达与结直肠癌化疗疗效相关性的研究
2020-03-08冯强孙琦孙霞吴丹秦磊
冯强,孙琦,孙霞,吴丹,秦磊
(1.东南大学医学院附属江阴医院 肛肠外科,江苏 江阴 214400;2.东南大学医学院附属江阴医院 肿瘤科,江苏 江阴 214400;3.苏州大学附属第一医院 普通外科,江苏 苏州 215000)
结直肠癌(CRC)是我国最为常见的恶性肿瘤之一[1];错配修复(MMR)蛋白表达及微卫星不稳定(MSI)与CRC的发病存在着明显的相关性[2-3]。正常情况下,人体内的MMR基因所表达产生的MMR蛋白存在自动修复上述MSI的功能。然而由于MMR基因自身的缺陷,造成MMR蛋白错配修复功能丧失,基因不稳定性概率增加,在细胞复制过程中,基因错配的机率也随之增加,从而引起MSI,造成肿瘤的发生。由此可见,MMR与MSI之间存在密切联系[4-5]。
近年来有研究者发现,5-氟尿嘧啶(5-FU)联合其他化疗药物,尤其是加入含奥沙利铂的化疗方案,会改变MMR蛋白表达缺失(dMMR)/微卫星高度不稳定(MSI-H)患者对辅助化疗的敏感性。如Zaanan等[6]研究发现,Ⅲ期MSI-H的CRC患者接受奥沙利铂和5-FU辅助化疗的效果比微卫星低度不稳定(MSI-L)或稳定的CRC患者要好。鉴于既往研究结果,本研究拟采用荧光聚合酶链反应(PCR)法检测肠癌组织中MSI分型,再用免疫组化法(IHC)检测CRC组织中MMR蛋白的表达情况,分析 MSI表达与临床病理特征的相关性,进一步验证MMR蛋白表达与MSI分型的一致性,从而了解它们对CRC精准化及个体化治疗的指导意义,为 MSI分型检测筛选合理的检测方法。同时观察采用不同化疗方案的不同分期、不同MSI分型患者无进展生存期(PFS)之间的差异,从而评判不同化疗方案对CRC的疗效。
1 资料与方法
1.1 一般资料
CRC组织标本取自2013年10月至2016年10月在东南大学医学院附属江阴医院肛肠外科手术切除的石蜡组织标本,所有患者均为手术病理确诊(由至少两名主治医师以上病理科医师确诊)且病理资料和临床资料完整、术前未经化放疗和分子靶向治疗的初诊患者。CRC组织标本共130例,男75例(57.69%),女55例(42.3%);年龄25~85岁,平均61岁;肿瘤位于右半结肠27例(20.7%),左半结肠26例(20%),直肠77例(59.3%);Ⅱ期91例(70%),Ⅲ期39例(30%)。 选择癌旁组织标本10例作为对照,标本经HE染色证实为正常结直肠组织。组织标本均经40 g·L-1甲醛固定,常规石蜡包埋,每例石蜡标本以4 μm厚度连续切片5张。
1.2 主要试剂
一抗MLH1兔抗人抗体和hMSH2兔抗人抗体均为 SANTA CRUZ 公司产品。二抗:(1) MLH1兔单抗,克隆号ES05,即用型;(2) PMS2兔单抗,克隆号EP51,即用型;(3) MSH2兔单抗,克隆号FE11,即用型;(4) MSH6兔单抗,克隆号EP49,即用型。免疫组化EliVision plus试剂盒均为福州迈新生物技术开发有限公司产品。
1.3 MMR蛋白的免疫组化检测
1.3.1 免疫组化检测过程 采用免疫组化S-P法,参照EliVision plus试剂盒说明书进行,具体如下:取各CRC组织,连续石蜡切片,58 ℃烘烤60 min,二甲苯脱蜡,然后水化,0.5%过碘酸处理后用PBS冲洗;接着浸入柠檬酸缓冲液修复液加热,再用PBS冲洗;滴加3%双氧水,再次PBS冲洗;最后滴加正常山羊血清封闭液;滴加一抗,结合抗原:每张切片上分别滴加hMLH1、hMSH2、TS抗体,37 ℃孵育65 min(hMLH1、hMSH2抗体稀释1∶200,TS抗体稀释1∶1 000),放入4 ℃ 冰箱过夜;第2天复温,PBS冲洗,依次滴加生物素标化二抗、辣根过氧化物酶标记链霉卵白素溶液,PBS冲洗;最后DAB显色,苏木精复染,梯度酒精脱水,中性树脂封片,镜下观察切片。所有切片均以PBS代替一抗作为阴性对照,其他步骤同前。
1.3.2 免疫组化结果的判断 每批标本检测时均设有空白对照(以PBS缓冲液代替一抗染色已知阳性切片),结果由两名主治医师以上病理科医师采用双盲法独立重复阅片,所有染色切片均在光镜下观察,计算机图像分析系统扫描后保存。阳性细胞计数采用图像分析软件(Image-proplus 6.0)统计计算。hMLH1阳性染色主要定位于细胞核,呈棕黄色颗粒,部分细胞质着色;hMSH2定位于细胞核,呈棕黄色颗粒,细胞质和细胞膜不染色,间质不染色。染色阳性结果表现为浅黄色、黄色或棕黄色颗粒。随机选取5个高倍视野,按肿瘤细胞阳性比率评分:肿瘤细胞阳性率≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;按肿瘤细胞着色强度评分:没有细胞着色为0分,浅黄色为1分,黄色为2分,棕黄色为3分。采用肿瘤细胞阳性率评分乘以肿瘤细胞着色强度评分的方法综合评分,两者相乘,结果作为最终评分。根据最终评分,将MMR蛋白染色分为4个等级:0分为(-),l~4分为(+),5~8分为(++),>8分为(+++)。片内正常结直肠组织及间质细胞无着色,作为阴性对照。判断标准:内对照细胞核阳性而癌组织全阴性(即没有一个细胞核染色)时表示该蛋白表达缺失。
1.4 MSI的PCR检测
1.4.1 基因组DNA抽提 采用Qiagen公司的DNA提取试剂盒按组织样品DNA的提取步骤提取组织DNA,常规切片4 μm厚5~10张,经脱蜡、蛋白酶K消化及离心,将DNA洗脱。稀释DNA至浓度为20 ng·μl-1,体积为50 μl。一张HE染色观察形态,其余用于下一步提取DNA;显微镜下观察HE切片,选取富有肿瘤细胞的区域,对应HE切片将肿瘤组织刮入裂解液,保证肿瘤成分80%以上。
1.4.2 PCR法扩增 在试剂准备区配制20 μl PCR反应体系,在标本制备区加模板(待检血液样本、待检肿瘤石蜡样本)至反应体系中,PCR反应管振荡混匀,短暂离心。在扩增区按以下反应条件进行PCR扩增: PCR反应体系20 μl。反应条件: 94 ℃预变性4 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共40个循环;72 ℃延伸5 min,温度降至10 ℃结束。以双蒸水代替DNA模板作为阴性对照,以已知阳性病例作为阳性对照。取PCR扩增产物2 μl,2%琼脂糖凝胶电泳鉴定,扩增结束后拟对PCR产物进行测序。
1.4.3 对PCR产物测序 将DNA PCR产物(20 μl)磁珠纯化,配制测序反应体系,总反应体积5 μl,盖紧PCR管,用手指弹管混匀,稍离心后将PCR管置于PCR仪上进行扩增。接着反应产物醋酸钠纯化后上ABl3730 DNA Analyzer进行PAGE电泳。采用Sequence Analysis软件进行序列分析。
1.5 观察指标
观察130例患者的MSI分型、MMR蛋白表达情况。将130例患者分为MSI-H组和非MSI-H组,观察两组间MMR蛋白表达缺失率的差异。同时收集130例患者的临床及病理资料,观察MSI-H组和非MSI-H组两组的临床病理特征的差异。最后分析术后不同辅助化疗方案组(FOLFOX4组、XELOX组、未化疗组)不同MSI分型、不同MMR蛋白表达者生存时间的差异。研究终点为无进展生存时间(progress free survival,PFS),是指从确诊之日起至患者末次随访病情进展的日期。最后一次随访至2018年8月30日。
1.6 统计学处理
使用统计软件SPSS 21.0,用Kaplan-Meier法计算生存率,用Log Rank法检验生存率的差别,计量资料以±s表示,独立组间比较采用t检验,计数资料以例数和百分比表示,组间比较采用χ2检验,P<0.05为差异具有统计学意义。
2 结 果
2.1 MMR蛋白表达结果
4种MMR蛋白表达均定位于肿瘤细胞核,MLH1、PMS2、MSH2、MSH6均阳性表达即为MMR表达未缺失,任何一种蛋白表达的缺失即为MMR表达缺失(图1)。MMR蛋白阳性者(pMMR组)95例(73%),表达缺失者(dMMR组)35例,缺失率为26.9%,其中MLH1、PMS2、MSH2、MSH6表达缺失者分别为15例(42.9%)、11例(31.4%)、6例(17.1%)及3例(8.6%)。
2.2 MMR蛋白表达与MSI表达的相关性
MSI的PCR检测显示,MSI-H的检出率为23.8%(31/130),而非MSI-H的检出率为76.2%(99/130)(图2、3、4)。在非MSI-H组中,MMR未缺失率占94.9%,而缺失率仅占5.1%;MSI-H组中,MMR未缺失率占3.2%,缺失率占96.8%。提示在CRC患者中,MSI-H与MMR蛋白缺失有一定的相关性(P<0.001)。
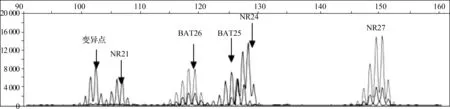
图4 CRC的MSI-L:肿瘤组织的NR-21、NR-24、NR-27、BAT-25和BAT-26位点结果分析
2.3 MSI表达水平与临床病理特征的关系
非MSI-H与MSI-H组患者年龄、性别、部位、分期比较结果显示,两组间差异均不具有统计学意义(P>0.05),提示两组患者各病理特征无明显差异,见表1。
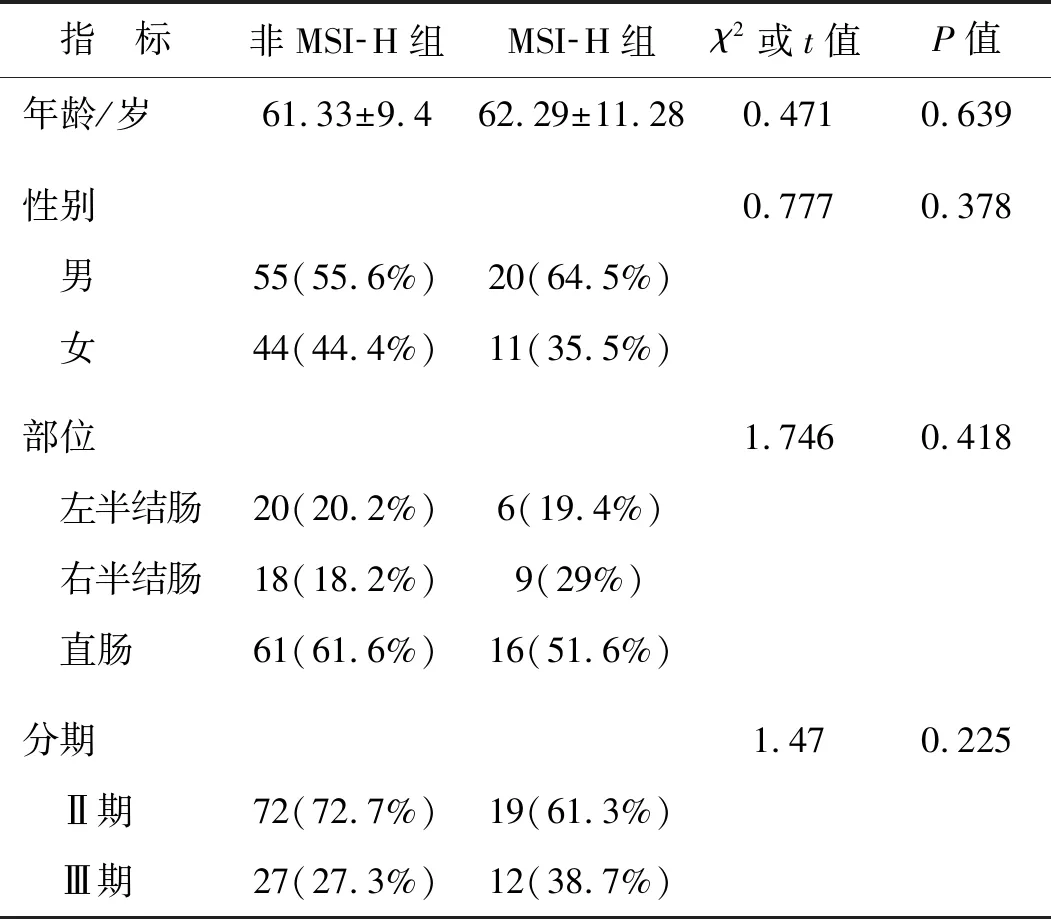
表1 非MSI-H与MSI-H组临床病理特征的比较
2.4 MSI表达水平与PFS的关系
对术后不同辅助化疗方案组(FOLFOX4组、XELOX组、未化疗组)就不同MSI分型与不同MMR蛋白表达的亚组进行Log Rank生存分析显示:在FOLFOX4组中,不同MSI分型、不同MMR蛋白表达亚组患者的PFS为2~41个月,平均16.7个月,差异具有统计学意义(P=0.004)。在XELOX组中,上述两亚组患者的PFS为2~46个月,平均14.6个月,差异无统计学意义(P=0.175);在未化疗组中,上述两亚组患者的PFS为1~40个月,平均19.2个月,差异无统计学意义(P=0.442)。见图5。对FOLFOX4、XELOX及未化疗组间进行比较显示,FOLFOX4组中MSI-H患者的复发时间要短于非MSI-H患者。
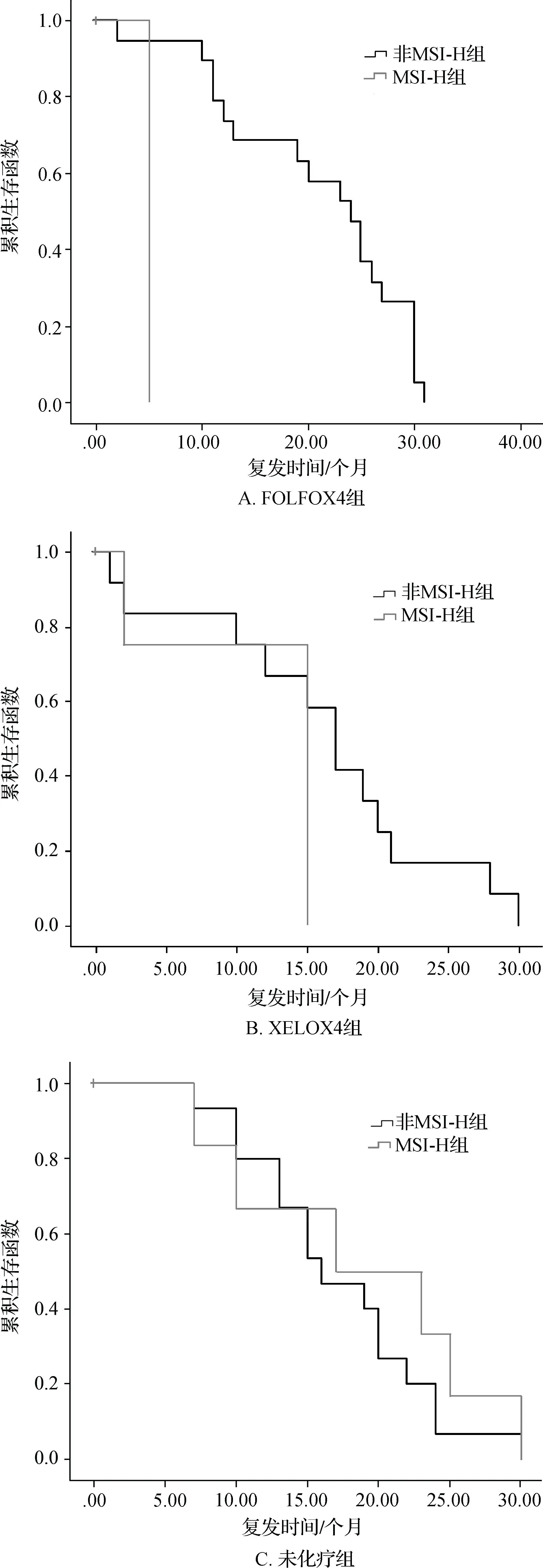
图5 各化疗方案组中不同患者的PFS曲线图
3 讨 论
CRC是一种由遗传和环境因素相互作用而引起的异质性疾病,发病率和死亡率较高[7]。目前,MSI作为预判CRC患者能否在CRC辅助治疗中获益的指标已经成为了研究的热点。本研究中我们发现,非MSI-H 组中MMR未缺失率占94.9%,缺失率仅占5.1%,而MSI-H 组中MMR未缺失率占3.2%,缺失率占96.8%,从而进一步验证了MMR蛋白表达与MSI分型的一致性,为MSI分型检测筛选合理的检测方法。
大量研究表明,MSI-H的CRC患者预后相对好,具有更高的生存率,然而对5-FU单药治疗却不敏感[8]。这已在2011年的NCCN指南中被提及。近年来有研究者[9]发现,5-FU联合其他化疗药物会改变MSI-H患者对辅助化疗的敏感性,尤其是加入含奥沙利铂的化疗方案。临床上多采用FOLFOX或XELOX化疗方案,因此了解MSI的CRC患者接受FOLFOX或XELOX化疗的生存预后,为CRC患者的个体化治疗提供可能的理论依据。本研究回顾性分析 MSI-H患者的临床病理特征,通过对接受FOLFOX或XELOX化疗的患者进行生存预后分析,判断MSI-H患者对化疗疗效的预测价值。我们发现,不同MSI状态的CRC患者在不同的术后辅助化疗后,其生存期是不同的。
目前对MSI-H患者与非MSI-H患者相比较,是否能从FOLFOX化疗方案中获益仍然存在争议[10-12]。本研究发现,在FOLFOX化疗基础上,总体MSI-H CRC患者的PFS比非MSI-H者差,与Zaanan等[6]的研究结果相似,而在XELOX方案化疗及未化疗患者中均未看到MSI-H组与非MSI-H组间PFS差异有统计学意义。因此可推断加入奥沙利铂可能会改变MSI-H对辅助化疗疗效的预测作用。同时本研究中我们发现,MSI-H的CRC患者能从XELOX方案获益。因此,对于有化疗指征的MSI-H型患者,我们更推荐XELOX方案的化疗。但因本研究MSI-H的CRC样本量小,且为回顾性研究,结果不一定客观准确,需待进一步前瞻性研究加以论证。
总体来说,MSI可作为5-FU化疗药物敏感性预测的分子标志物,MMR检测对CRC(特别是Ⅱ期CRC)的个体化治疗有重要的指导意义。在5-FU基础上再加入其它化疗药物可能会改变MSI对化疗疗效的预测价值。但是迄今为止,有关MSI与具体化疗方案疗效相关性的数据仍较少,尚需要进一步研究[13]。
