幽门螺杆菌生物膜形成因素及治疗策略研究
2020-03-07宿晶刘晨光
宿晶,刘晨光
(中国海洋大学,山东青岛 266003)
幽门螺杆菌(Helicobacter pylori,Hp)是一种寄生于胃粘膜的革兰氏阴性微需氧细菌,能够引起胃炎或胃溃疡等多种疾病。目前临床上治疗Hp的策略多为三联或四联疗法,即联合使用抗生素和质子泵抑制剂。然而近年来,Hp对抗生素的耐药性大大增加,其生物膜的形成被认为是造成耐药性增加的重要原因。目前为止,生物膜引起耐药性增加的机制主要有4种学说:渗透与营养限制、外排泵基因上调、基因水平转移以及对抗免疫防御系统[1]。因此,如何抑制和清除Hp生物膜是目前需要重点关注的问题。本文主要对Hp生物膜的形成、影响因素以及治疗策略的研究概况进行综述。
1 Hp生物膜的形成过程
生物膜是指细菌粘附在生物或非生物表面,并被自身分泌的胞外聚合物(extracellular polymeric substances,EPS)包裹所形成的微生物聚集体。如图1所示,Hp生物膜的形成过程包含5个阶段:(1)初始粘附,此时Hp之间的相互作用较弱,为可逆吸附作用;(2)牢固粘附,该过程的主要特征是Hp细胞分裂,微生物群落形成,细菌之间相互作用加强;(3)EPS的产生,Hp生长代谢较为缓慢;(4)EPS形成,生物膜成熟,出现群体感应调节现象;(5)EPS重塑,Hp从最初的生物膜中分离出来,回到游离细菌状态,再次进入新的生物膜形成阶段。
2 Hp生物膜形成的影响因素
2.1 鞭毛及相关蛋白在Hp生物膜形成中的作用
鞭毛驱动Hp定植于胃粘膜,在该过程中,Hp利用鞭毛接触胃粘膜表面,通过静电相互作用与粘膜表面发生粘附。可以看出,鞭毛在Hp生物膜形成过程中的粘附阶段起重要作用。研究显示,鞭毛钩状相关蛋白(flagellar hook-associated protein,fliD)基因编码鞭毛相关蛋白,有助于鞭毛蛋白亚基的聚合。另一方面,Panan等人[2]研究发现,野生型Hp可形成结构紧密的成熟生物膜,EPS含量丰富;相反,fliD突变菌株形成的生物膜细胞结构松散,且胞外基质和纤维连接较少。因此可以看出fliD编码的蛋白可能参与了Hp生物膜的成熟过程。
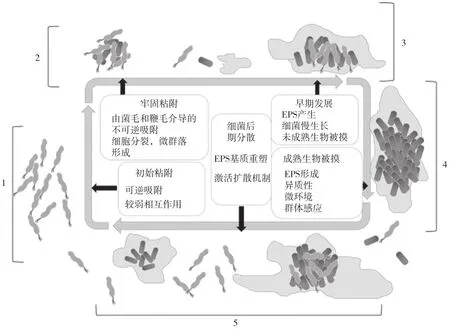
图1 Hp生物膜形成的5个阶段
2.2 葡萄糖/半乳糖转运蛋白在Hp生物膜形成中的作用
葡萄糖/半乳糖转运蛋白(glucose/galactose MFS transporter,GluP)通过摄取D-葡萄糖、D-甘露糖以及D-半乳糖参与幽门螺旋杆菌胞外多糖合成过程。Ge等人[3]研究发现五磷酸鸟苷3’端焦磷酸水 解 酶(penta-phosphate guanosine-3-pyrophosphohydrolase,spoT)的缺失会影响Hp对葡萄糖等单糖和多糖的摄取,从而影响胞外多糖的合成,无法形成完整的EPS,抑制了生物膜的生长。进一步研究发现,spoT可以通过调控外排泵基因gluP的表达,从而影响Hp形成生物膜的能力。
2.3 Hp外膜蛋白在Hp生物膜形成中的作用
Hp外 膜 蛋 白(Helicobacter outer membrane B,HomB)有助于Hp粘附在胃粘膜表面,在生物膜形成过程中起到重要的作用。ArsRS是一种由传感器激酶ArsS和响应调节器ArsR组成的酸响应双组分系统。当pH降低时,ArsS自磷酸化,然后将磷酸基团转移到ArsR,磷酸化的ArsR可以抑制下游基因的表达。如图2所示,Stephani等人[4]研究发现当pH值降低时,磷酸化的ArsR可以与homB启动子结合抑制homB的表达,使Hp不能与胃粘膜表面发生粘附,从而影响Hp生物膜的形成。
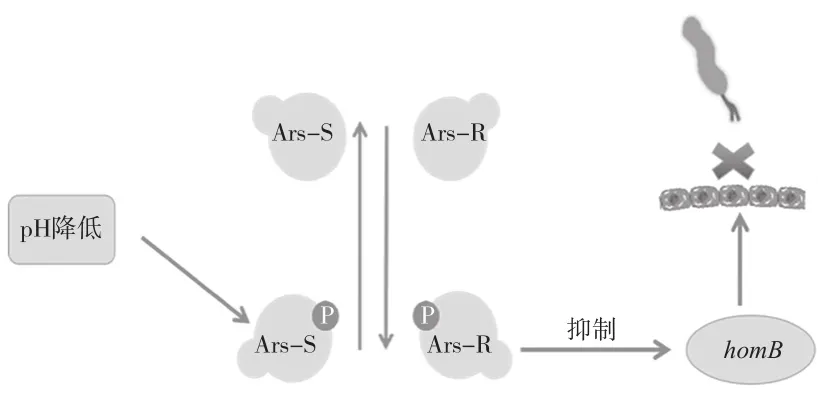
图2 homB的表达影响Hp的粘附
3 Hp生物膜的防治策略
3.1 通过抑制Hp的粘附抑制生物膜的形成
3.1.1 天然产物抑制Hp的粘附
天然产物中含有很多抑制细菌生长的成分。相关研究表明黄连素、苦参碱以及大黄素等天然产物能够降低Hp分泌多糖的能力,并通过破坏存活菌株的荚膜,抑制Hp的生长和粘附,防止生物膜的形成[5]。
3.1.2 有机硫化合物抑制Hp的粘附
二烯丙基三硫醚是大蒜素的主要活性成分[6],是一种具有较强的极性亲水性有机硫化物。细菌细胞膜是由磷脂双分子层构成的,有机硫化合物可以通过破坏细菌细胞膜的磷脂双分子层,造成细菌细胞溶解。因此二烯丙基三硫醚可以破坏细菌细胞膜,减少细菌定植,抑制生物膜的形成。
3.2 通过直接破坏EPS清除成熟生物膜
3.2.1 物理法
细菌生物膜暴露在电磁场中会产生应激效应,导致膜内细菌的表型改变,影响细菌的表面粘附。Campli等人[7]探讨了极低频电磁场对Hp成熟生物膜的影响,发现暴露在低频电磁场中的Hp生物膜,膜内细菌amiA的表达发生改变,导致Hp表型的变化,粘附能力降低;同时,细菌数量发生失衡,无法激活其群体感应机制,细菌活力下降,有效清除了Hp生物膜。
3.2.2 生物法
EPS由多糖、DNA和蛋白质等组成,因此应用多糖水解酶以起到破坏生物膜的作用。研究显示藻酸盐裂解酶(Alginate Lyase,AlgL)能够降解EPS中的多糖。Bugli等人[8]使用AlgL和克拉霉素治疗Hp生物膜的感染,发现AlgL通过降解Hp的EPS,迫使Hp由休眠状态转为活跃的代谢状态,而克拉霉素对活跃的Hp有很好的杀灭作用。该实验结果证明了传统抗菌剂与基质降解酶的联合使用,能够改善Hp生物膜感染的治疗效果。
3.2.3 化学法
表面活性剂是一种具有两亲性质的化合物,当表面活性剂与生物膜接触时,亲水基团和疏水基团共同作用,破坏细菌生物膜结构,是一种重要的生物膜抑制剂。Shen等人[9]研究了鼠李糖脂对Hp生物膜的破坏作用。鼠李糖脂的疏水基团与EPS接触,其亲水性基团向水相延伸,破坏细菌表面的亲疏水性质,降低细菌之间的粘附力以及生物膜与介质之间的表面张力,从而导致生物膜脱落。该研究表明鼠李糖脂可作为一种佐剂,与抗生素联合使用,从而达到清除生物膜的作用。
3.2.4 纳米技术
脂质与聚合物复合纳米粒(LPNs)的外脂双分子层结构能够与EPS融合并破坏EPS,使膜内细菌恢复敏感状态,然后将纳米粒中的抗菌药物直接递送至生物膜内部,从而发挥药物的作用,具体过程如图3所示。Cai等人[10]开发了一种LPNs,该纳米颗粒的外层为鼠李糖脂和磷脂的混合脂质,内芯为阿莫西林和果胶硫酸。当该纳米粒子接触到Hp生物膜时,粒子外层的混合脂质与EPS相融合,破坏EPS的结构;随后,纳米粒子的内芯释放阿莫西林,杀灭暴露的生物膜内部细菌;同时,果胶硫酸抑制Hp的粘附,防止生物膜的再生。研究显示在LPNs表面进一步修饰聚乙二醇提高纳米颗粒的亲水性,可以帮助纳米颗粒穿透黏液层到达Hp的定植部位——上皮细胞表面,从而更好地清除Hp生物膜[11]。

图3 纳米粒清除Hp生物膜过程
4 结语
综上所述,Hp生物膜形成过程的清除方法已取得了不少进展,但距离彻底消除Hp还有一定的距离。这主要有两方面原因:(1)Hp生物膜形成的分子机制尚不清晰;(2)关于Hp生物膜清除策略的具体机制仍不完善。相信随着对Hp生物膜形成的分子机制以及治疗机制的深入研究,由Hp感染引起的疾病可以得到有效的治疗。
