恒温扩增技术在男性淋球菌性尿道炎病原菌RNA检测中的应用
2020-03-06戴显宁童郁林建萍施建有陈璐许锴
戴显宁,童郁,林建萍,施建有,陈璐,许锴
(温州市人民医院 检验科,浙江 温州 325000)
淋病奈瑟菌(n.gonorrhoeae,NG)又称淋球菌,为严格的人体寄生菌,常寄存于急性尿道炎患者脓性分泌物的白细胞中。而淋球菌性尿道炎(gonococcal urethritis)是由NG感染的一种较常见的性传播疾病,临床主要表现以尿道炎多见,典型症状是排尿困难、尿频、尿急、尿痛等。它具有发病率高、传染性强、潜伏期短等特点[1-3]。男性在最初发病时会出现尿道发痒、微痛、尿道发红、变肿、分泌异物等症状。有些男性患者发病期尿道分泌物可能较少或没有,且病程较长,易造成漏检[4-5]。 因此建立一种男性NG病原菌快速而准确的检测方法,对诊断和控制淋病传播至关重要。恒温扩增技术(simultaneous amplification and testing,SAT)是近年来发展起来的一种新型核酸扩增技术,已在肠道病毒、肺炎支原体和结核分枝杆菌的研究中被证实较传统聚合酶链反应(polymerase chain reaction,PCR)有更高的灵敏度和特异度,且优于其他检测技术[6]。本研究应用RNA-SAT法、实时荧光定量PCR(real time fluorescence quantitative,FQ-PCR)以及分离培养法检测322例男性疑似NG感染患者,拟建立从男性尿液样本中检测病原菌NG-RNA的方法,用于辅助男性淋球菌性尿道炎的诊断。
1 资料和方法
1.1 一般资料 选取2017年6月至2018年6月温州市人民医院男科门诊疑似淋球菌性尿道炎患者322例,年龄19~65(37.5±11.2)岁。纳入标准:①符合临床对淋球菌性尿道炎感染的诊断标准[7];②初次筛查均为首诊,且排除1周内已使用相关药物治疗的患者。本研究经本院伦理委员会批准,所有患者均知情同意。
1.2 试剂与仪器 RNA-SAT法试剂盒购自上海仁度生物科技有限公司(批号:20180201);FQ-PCR法试剂盒购自广州中山达安生物有限公司(批号:2018003);NG琼脂平板购自郑州安图生物工程股份有限公司(批号:20171011A)。荧光定量PCR仪AB-7500购自美国ABI公司,37 ℃培养箱购自上海跃进医疗器械有限公司。
1.3 方法
1.3.1 样本采集:尿液采集:留取≥2 h不排尿后的首段尿并取1 mL加至尿液RNA保存液中,用于RNA-SAT检测。分泌物采集:用无菌棉拭子伸入男性尿道口1~2 cm,旋转数周,停留10 s以上,一式三份;一份拭子加1.5 mL 0.9%氯化钠溶液震荡洗涤,用于FQ-PCR检测;一份加至尿液RNA保存液中,用于RNA-SAT检测;另一份拭子立即接种于专属淋球菌培养基上。
1.3.2 检测方法:RNA-SAT检测:加入RNA模板5 μL 至35 μL反应体系微量管中,置于恒温金属浴内 (60 ℃,10 min;42 ℃,5 min),并加入已预热SAT酶10 μL;ABI-7500荧光定量PCR仪进行恒温扩增(42 ℃,1 min,40 个循环)。FQ-PCR检测:将分泌物样本用1 mL 0.9%氯化钠溶液充分洗脱至 1.5 mL EP管中,13 000 r/min离心3 min,取沉淀物加入50 μL DNA提取液,100 ℃煮沸裂解10 min。13 000 r/min离心3 min,取2.5 μL上清液至FQPCR反应液,至ABI-7500 荧光定量PCR仪进行扩增(95 ℃,5 min;95 ℃,30 s,58 ℃,45 s,72 ℃, 1 min,35个循环;72 ℃,10 min);NG培养:1 h内接种至NG培养基后,置于CO2恒温培养箱,在5%~10% CO2、35~37 ℃、相对湿度80%以上的条件下培养24~48 h。
1.3.3 预后评估:对于NG阳性的患者采用头孢曲松钠1.0 g,加1%利多卡因3.5 mL一次肌注,同时给予阿奇霉素1.0 g联合用药。并对其中用药7 d后临床症状、体征消失且尿常规白细胞阴性患者采样复查,比较RNA-SAT法、FQ-PCR法以及分离培养法的阴转率。
1.4 统计学处理方法 采用SPSS19.0统计软件进行统计学分析。分离培养法是WHO推荐诊断淋菌性尿道炎的首选方法,也是诊断淋病的金标准,故以分离培养法为参考方法[8-9],计算RNA-SAT、FQ-PCR法检测NG的灵敏度、特异度、阳性预测值及阴性预测 值。计数资料以率(%)表示,组间比较采用χ2检验。绘制ROC曲线图,并通过曲线下面积(area under curve,AUC)判断试验的准确性。P<0.05为差异有统计学意义。
2 结果
2.1 3种不同方法检测男性NG感染情况 对322例疑似尿道炎患者尿液及拭子样本分别采用RNA-SAT法、FQ-PCR法以及培养法检测病原菌NG。NG阳性率最高为尿液RNA-SAT法[35.1%(113/322)],其次为拭子RNA-SAT法[33.2%(107/322)]、拭子FQ-PCR法[31.4%(101/322)]以及分离培养法[29.5%(95/ 322)];NG阳性率最低为尿液FQ-PCR法[26.1%(84/ 322)],见表1。3种尿液检测方法的阳性率差异有统计学意义(χ2=6.312,P<0.05),而3种拭子检测方法的阳性率差异无统计学意义(χ2=1.039,P >0.05)。
2.2 RNA-SAT法和FQ-PCR法检测NG的方法评价及ROC曲线分析
2.2.1 RNA-SAT法和FQ-PCR法检测NG的方法评价:以分离培养法作为参考方法,计算RNA-SAT、FQ-PCR法检测NG的灵敏度、特异度、阳性预测值及阴性预测值,其中尿液RNA-SAT法检测NG的灵敏度最高,尿液FQ-PCR法的灵敏度最低,差异有统计学意义(χ2=8.026,P<0.01);特异度则相反,且差异有统计学意义(χ2=6.507,P<0.05)。拭子RNA-SAT法与拭子FQ-PCR法的灵敏度和特异度差异均无统计学意义(χ2=0.121,P>0.05;χ2=3.467,P>0.05)。尿液RNA-SAT法和拭子RNA-SAT法的灵敏度和特异度差异均无统计学意义(χ2=1.205,P>0.05;χ2=2.752,P>0.05),见表2。

表1 3种不同方法检测男性NG感染情况(例)

表2 RNA-SAT法和FQ-PCR法检测NG的方法评价
2.2.2 ROC曲线分析:根据灵敏度和特异度绘制ROC曲线,按照AUC为0.7~0.9表示诊断准确度为中等划分[10-11],以上检测方法的诊断准确度均中等偏上。拭子FQ-PCR法(AUC=0.987)>拭子RNA-SAT法(AUC=0.974)>尿液RNA-SAT法(AUC=0.960)>尿液FQ-PCR法(AUC=0.942),见图1。

图1 RNA-SAT法和FQ-PCR法检测NG感染的ROC曲线图
2.3 NG预后阴转率评估 对81例NG阳性的患者且用药7 d后临床症状、体征消失且尿常规白细胞阴性的患者采样复查,比较尿液RNA-SAT法、尿液FQPCR法以及分离培养法的阴转率,三者差异无统计学意义(χ2=2.531,P>0.05);同样比较拭子RNASAT法、拭子FQ-PCR法以及分离培养法的阴转率,三者差异无统计学意义(χ2=2.933,P>0.05),见表3。
3 讨论
培养法长期以来都是检测NG的金标准,但由于NG培养条件苛刻,培养时间长以及离体易死亡等因素,不利于NG的快速检测及早期诊断[12]。因此,目前非培养法越来越多用于NG的诊断。其中RNA-SAT法是将新一代的核酸恒温扩增技术和实时荧光检测技术相结合的一种新型核酸检测技术。基本原理是同一温度下,首先通过M-MLV反转录酶产生靶标核酸(RNA)的一个双链DNA拷贝,然后利用T7 RNA多聚酶从该DNA拷贝上产生多个RNA拷贝;每一个RNA拷贝再从反转录开始进入下一个扩增循环;同时,带有荧光标记的探针和这些RNA拷贝特异结合,产生荧光。该荧光信号可由荧光检测仪器实时捕获,实时反映扩增循环情况。该方法具有高灵敏度、高特异度、低污染、反应稳定等优点[13]。
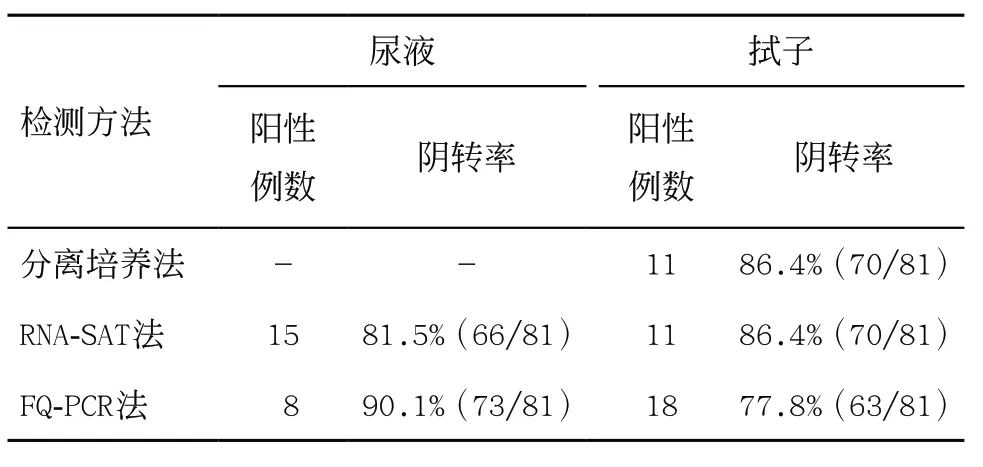
表3 RNA-SAT法、FQ-PCR法以及分离培养法阴转率比较
本研究通过对322例疑似尿道炎患者尿液及拭子样本分别采用RNA-SAT法、FQ-PCR法及分离培养法检测病原菌NG,结果显示RNA-SAT法检测NG阳性率均要高于FQ-PCR法和分离培养法,与国内其他报道[14-15]相近。可能原因一方面是FQ-PCR法采用传统的煮沸裂解法提取核酸,效率较低,再加上尿液成分中含有较多的PCR反应抑制物,导致FQ-PCR法对尿液不敏感,影响核酸扩增[16];而分离培养法作为传统的NG诊断金标准,由于NG对环境、标本的采集、运送等要求较高,同时还可能因抗生素使用、接种后病原微生物不成活等因素而导致漏 检[17]。另一方面RNA-SAT法采用磁珠法提取核酸,反应体系加入了竞争性内标,从而增加检测反应灵敏度[18-19]。此外,从ROC曲线判断,拭子RNA-SAT法和尿液RNA-SAT法的AUC中等偏上,具有较高的诊断价值(AUC>0.9)。且尿液RNA-SAT法和拭子RNASAT法的灵敏度和特异度差异无统计学意义,提示RNA-SAT法均可将泌尿生殖道分泌物和尿液作为待测样本,且尿液作为一种非侵入式取样,避免男性患者拭子取样的尴尬和痛苦。因此,在男性患者排斥或尿道拭子取材有困难时,可根据实际情况考虑留取尿液标本检查,但是必须在留取尿液标本时明确首次排空尿(first void urine,FVU)概念,即尿液留取时间与上次排尿间隔至少2 h,且必须为首段尿的10~30 mL。这样才能保证检测结果准确可靠[20]。最后,本研究通过对81例用药7 d后临床症状、体征消失且尿常规白细胞阴性的患者重新采样进行疗效监测,阴转率从高到低依次是尿液FQ-PCR法>拭子RNA-SAT法>尿液RNA-SAT法>拭子FQ-PCR法,但差异均无统计学意义,可能原因是阳性标本例数不够造成的,需进一步扩大样本量进行验证。总的来说,RNA-SAT法能排除患者治疗后病灶处已死亡病原菌对检测结果造成的假阳性并且RNA在死亡的病原菌中降解快速,有利于治疗后的疗效观察及判愈,避免过度治疗,从而减轻患者负担。
综上所述,RNA-SAT法和FQ-PCR法对初诊或未经治疗患者NG病原菌检测中作用相当,均可作为判断NG病原菌感染的指标。但在治疗过程中,FQ-PCR法检出的结果不能区别是活菌或死菌,不适合用作判断预后标准,而RNA-SAT法具有活菌扩增,死菌不扩增的特点,有利于临床治疗后的疗效观察及判愈,从而避免过度治疗[12,14];同时可采用尿液作为待检样本,具有采样方便、污染小及结果准确等优点,可用于临床男性NG病原菌检测与预后评估。
