形状记忆高分子材料在骨缺损修复再生领域的研究进展
2020-03-05刘育豪张陶
刘育豪 张陶
1.口腔疾病研究国家重点实验室 国家口腔疾病临床医学研究中心四川大学华西口腔医院口腔颌面外科 成都 610041;
2.口腔疾病研究国家重点实验室 国家口腔疾病临床医学研究中心四川大学华西口腔医院全科门诊 成都 610041
骨是人体最重要的器官之一,在维持体内钙磷代谢稳态、储存干细胞、造血功能等方面发挥重要作用[1]。然而,衰老、疾病、创伤等因素可造成骨缺损,进而引起骨组织生物功能的降低,因此需要有效疗法以实现骨缺损的修复和再生。在过去的数十年中,骨移植(bone grafting)是治疗骨缺损的金标准,至今每年全世界范围内仍进行200多万次骨移植手术[2]。然而,骨移植的大规模应用受到限制,主要原因有骨移植材料来源匮乏、异体骨移植的供体骨组织不健全、手术操作复杂、感染与并发症风险等[3-4]。骨移植替代物的研发已受到学者关注,脱细胞基质[5]、生物玻璃和磷酸钙骨水泥[6]等生物材料已被用于骨缺损修复,但这些材料很难用于深部的骨组织缺损,且难以完全匹配复杂骨缺损的不规则三维形态[7]。
组织工程及再生医学(tissue engineering and regenerative medicine)是对受损组织进行修复并促进再生的一个极具前景的研究领域[8]。组织工程的3个要素为支架、干细胞和信号分子。制备具有良好的生物相容性、生物降解性、力学稳定性以及能够负载细胞或信号分子的支架材料是首要条件[1,9];近年来,学术界对支架材料提出了微创性、精确匹配不规则骨缺损(如颅颌面骨缺损和脊柱骨缺损)等更高的要求。近年来,“智能响应型生物材料”(stimuli-responsive biomaterials)已被引入骨缺损修复领域,其能够感受温度、光照、水分和磁场等外界物理化学刺激,进而在三维形状、固液相态等性质上触发转变[10],最终产生可注射性[11]、自愈合性[12]、形状记忆性等新颖性能,成为新颖的支架材料。
本文对形状记忆高分子材料(shape memory polymer,SMP)的原理、生物学效应及应用潜能作一综述。
1 形状记忆材料的发展历程
SMP是智能响应型生物材料的一种,其宏观三维立体形状或微观表面形态可在物理化学刺激下发生“初始态”与“临时态”之间的转变。1932年,瑞典科学家在金镉合金中观察到“形状记忆”现象,即加热可使变形的金镉合金恢复原状。1941年,Vernon指出甲基丙烯酸酯具有“弹性记忆”效应,使高分子材料学界开始关注形状记忆效应的研究。随后,1960年交联聚乙烯热收缩膜的商业产品问世, 1980年SMP发展迅速,其形变性能日益优异,在生物医学、纺织业、航空航天、机器人科学等诸多领域得以应用[13]。
21世纪以来,形状记忆材料已在血管移植、心血管支架、肌肉重建、骨缺损修复等生物医学应用中受到关注[14-16]。对于骨缺损修复,其应用特点为可由植入性形态(棒状、薄片状等)转变为不规则骨缺损的三维形态(图1A),对于实现微创修复、匹配复杂骨缺损(如颅颌面骨缺损与脊柱骨缺损)、促进骨缺损的再生等极具前景。形状记忆合金已用做脊柱矫形器、骨连接器等承力性材料,其显著优势为材料强度高、耐疲劳性好(重复形变次数远高于SMP);相比于形状记忆合金,SMP虽然强度较低,但显著优势包括密度低、绝缘性/耐腐蚀性高、过渡温度可调、形状设计灵活、形变时长可控[17-18]、形变率/回复率高(≥90%)[19-20]等。更为重要的是,多孔性SMP可作为组织工程支架以加载信号分子或干细胞,有望实现骨缺损的再生,而形状记忆合金至今仅可实现骨缺损的充填修复。
2 SMP的形状记忆原理
大多数SMP的研究中,其形状记忆效应是温敏型,即形状转变由温度变化触发。一个典型的温敏型形状记忆循环包括以下几个步骤(图1B):将“初始态”SMP升温至“过渡温度”(transition temperature)以上,开启形状记忆循环;应力作用下SMP发生形变,制备“临时态”SMP;温度降低至临界温度以下,使分子链运动受到限制,将SMP“锁定”在临时态;温度回升至临界温度以上,分子链活动度提升,使SMP回复到初始态;温度回降至临界温度以下,冷却SMP,循环终止[14]。
温敏型SMP材料可良好匹配骨缺损形态。例如Zhang等[3]制备了一种过渡温度为55 ℃的SMP支架,温度高于55 ℃时SMP软化并具有可塑性,利于填入骨缺损模型中并扩充至边缘吻合;温度低于55 ℃后SMP被锁定在临时态且刚性增强,以较好的力学稳定性维持其三维形态。然而,若将SMP用于活体组织,其过渡温度需调控至接近体温。Liu等[21]将SMP支架的过渡温度设计为42 ℃,更接近活体体温。将其用于兔颌骨缺损中,该SMP支架可在体内实现形状记忆性能,且未因温度变化引起活体组织的明显损伤,具备良好的生物相容性。
除温敏型SMP外,Correia等[22]制备了基于壳聚糖的SMP支架,该支架通过乙醇脱水可固定在临时态,而在吸水时可恢复至初始态。该“水敏型”SMP支架可良好匹配骨缺损模型,且其可能利用活体组织内的水分进行形状转变,避免了外加温度刺激导致的潜在组织损伤,因而有望后续深入研究与应用。
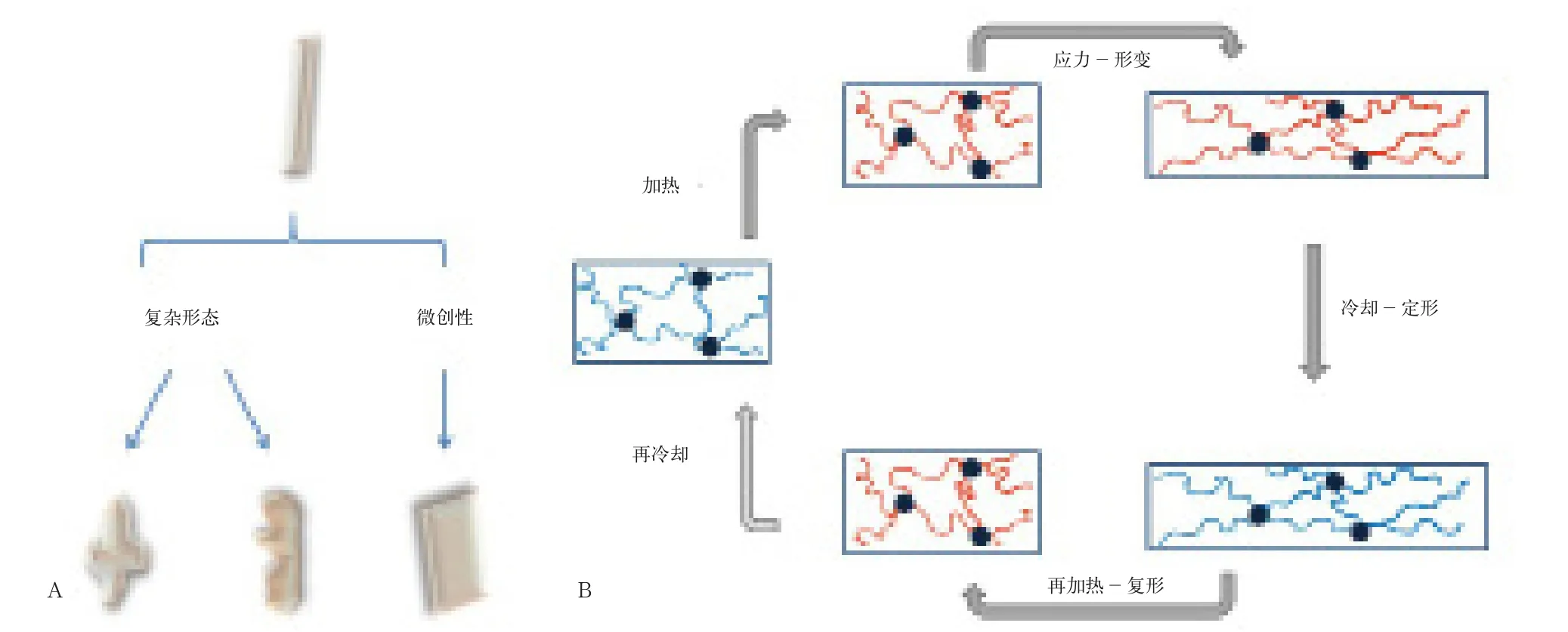
图1 形状记忆效应图示Fig 1 Diagram of shape memory effect
3 SMP对骨缺损的生物学效应
3.1 形状记忆效应与骨缺损
对于复杂形状骨缺损(例如颅颌面骨缺损)而言,传统的生物材料以既定形状植入后难以与骨缺损边缘形态产生良好匹配,常导致边缘不密合进而发生材料吸收,难以实现骨缺损的均匀修复[3]。自智能响应型生物材料问世后,温敏型可注射水凝胶率先在骨缺损修复领域展现优势[1]。该类材料以液态注射至骨缺损内并充满缺损空隙,后随温度改变而转化为凝胶态且与缺损边缘密合良好。然而该类材料较弱的力学性能限制了其深入应用,尤其是承力区骨缺损的应用。近年来,SMP用于骨缺损,其应用特点为植入性形态与复杂三维形态的相互转化,在微创性与骨缺损形态匹配性上极具优势,类比于可注射水凝胶的液态-凝胶态相互转化。另一重要因素是,SMP作为固态材料,较之凝胶材料具有更好的力学性能,更利于骨缺损修复。
近年的体外研究中,SMP对于不规则骨缺损模型的形状记忆性能与匹配性能已受到学者肯定。然而SMP尚未用于不规则骨缺损的动物实验,这可能是因为活体骨形态的扫描重建技术及SMP相关的三维打印技术尚不成熟。目前的动物实验中,SMP主要基于收缩-舒张效应以修复规则形状骨缺损,取得了较好的效果。例如,Baker等[23]将聚多巴胺涂层SMP支架用于小鼠股骨缺损,该支架以致密压缩态植入体内约1 min后舒张填满骨缺损并恢复多孔性。虽然未见新骨形成,12周后该支架与周围骨组织稳定整合,其扭力稳定性与骨移植材料相似。类似地,Xie等[24]将聚氨酯/羟磷灰石复合SMP支架用于兔股骨缺损,其植入体内约1 min后体积膨胀并与缺损边缘密合,12周内骨可由材料边缘逐渐向内长入材料孔隙,伴有明显的血管化及骨改建过程。以上研究初步肯定了SMP在微创性与骨缺损形态匹配性上的优势,后续研究应基于不规则骨缺损或较大骨缺损的动物实验进行深入探究。
3.2 SMP的改性方式
对SMP进行改性以提升其生物学效应已受到学者们的关注[25]。值得注意的是,形状记忆效应本身可用作一种表面改性方式。Lee等[26]研发了基于甲基丙烯酸酯共聚物的SMP,其独特性能为时间依赖性表面动态微粗糙度。首先模拟临床应用的钛种植体表面在SMP表面制备粗糙形貌,后压缩为光滑表面,其可在24 h内回复粗糙形貌。因光滑表面利于成骨细胞增殖而粗糙表面利于成骨细胞分化,该SMP表面微观粗糙度的动态变化对细胞增殖分化的促进作用优于常规表面。此外,已有研究将多巴胺或聚多巴胺用作SMP支架涂层材料,其作用为提高支架表面亲水性进而促进成骨细胞增殖与骨矿化[3,27]。另有研究将生物活性玻璃纳米粒子及纳米羟磷灰石引入SMP组分制备复合支架,这类纳米材料的引入不仅能够促进成骨细胞增殖与骨矿化,并且能够提高材料刚性[19,22]。
作为组织工程支架以装载干细胞或信号分子的SMP也受到学者们的关注。例如,Liu等[21]将骨形态发生蛋白-2(bone morphogenetic protein-2,BMP-2)填入多孔SMP支架。该支架植入兔颌骨缺损后发生形状转化,约10 min后材料孔隙直径由33 μm回复至160 μm,使得BMP-2以可控速率均匀释放至骨缺损中,有效促进骨再生。用作细胞载体的研究中,Tseng等[28]将脂肪源性干细胞接种于聚多巴胺涂层SMP支架内,并探究形状记忆性能对干细胞功能的影响。该SMP支架收缩-舒张形状转化所需时长约为24 h,与非形状记忆支架对比,形状转化期间及转化后其矿物沉积、碱性磷酸酶活性、成骨相关基因表达均没有显著差异。Hendrikson等[29]将间充质干细胞接种于SMP支架内,发现支架形状转化所产生的力学刺激可对间充质干细胞造成显著影响,使其细胞形态变得更为狭长。以上的研究初步支持了SMP支架装载干细胞用于骨组织工程的可行性,但目前的SMP通常只能保证不降低干细胞活性,未见SMP促进干细胞增殖、分化的报道。
综上所述,在装载细胞的SMP支架用于活体植入之前,并考虑装载细胞种类的复杂性,SMP性能仍需进一步完善。首先,过渡温度应更接近体温,因为较明显的温度变化可能对细胞造成不可逆损伤[30]。其次,形状记忆回复时长应合理设计,过快的形状回复不利于材料植入且可能使组织受力明显而破坏稳态[14,21],而缓慢的形状回复可能使装载细胞从支架中逃逸[30-31]。更重要的是,SMP形状转变速率、孔隙直径变化程度等因素对细胞数量、形态、活性、增殖及分化等功能的影响应进行深入研究[32]。
4 SMP的应用潜能与性能优化
作为一种新颖的智能响应型生物材料,SMP在骨缺损修复应用中已展现以下三方面优势:1)微创性,即以利于植入体内的三维形态(棒状、薄片状等)植入骨缺损后回复至骨缺损三维形态,对机体创伤小;2)修复不规则骨缺损,即SMP可对复杂骨缺损的三维形态进行记忆,植入体内并发生形状转变后可与骨缺损边缘良好吻合,有利于缺损的均匀、紧密的充填与修复;3)促进骨再生,即作为支架材料装载各类生物活性因子或细胞后,可促进骨缺损内的新骨形成。然而,SMP在获得进一步应用前,后续研究应对SMP的性能继续进行完善,可能从以下几个方面来考虑。
1)兼顾材料力学性能与生物学效应。相对于软骨或肌肉等低模量组织缺损,骨缺损修复对材料力学性能要求更高[33],尤其是复杂形态骨缺损。在前述的对SMP进行改性的研究中,部分改性方式,例如加入生物活性玻璃纳米粒子组分,可提升材料力学性能;而装载BMP-2或干细胞等对于材料的生物学效应的提升作用更为明显,但装载所需的支架孔隙可降低材料力学性能。如何在维持较好力学性能的基础上提高材料的生物学效应,仍需深入摸索。
2)促进对复杂三维形状的记忆性能。一方面,可结合最新的活体扫描与三维打印技术,更精确地记录骨缺损形态的三维信息并复制于材料[4];另一方面,可尝试使材料对3个甚至更多个不同形状进行记忆并实现多向形态转化[13,34-35],以期更为灵活地修复复杂骨缺损。
3)探究形状记忆性能能否持续发挥效应。在本文所述的SMP的主要优势中,其材料自身可实现的微创性与形态转化主要在植入时发挥作用;而装载BMP-2或干细胞等成分进行改性,在植入后可分别通过BMP-2的释放及对周围细胞的效应、材料本身所载干细胞的成骨分化,来发挥成骨作用。值得思考的是,SMP在植入体内后能否基于其自身性能发挥持续的生物学效应。一个值得借鉴的研究是,Jung等[36]将SMP用于牙齿的正畸治疗,该材料形状转化后可对牙齿施加一定的牵引力,该力对于正畸而言大小适中且能够稳定持续约20 d。对于骨缺损修复而言,也应考虑SMP形状转化所产生的持续性牵引力或压力是否有“用武之地”,可参考牵张成骨技术的原理与应用。
综上所述,SMP作为一类智能响应型生物材料,可在外界物理化学刺激下发生宏观/微观的形状转化。灵活的形状转化一方面赋予其极佳的微创性,另一方面使得复杂三维骨缺损的修复成为可能。此外,装载信号分子或细胞可进一步提升SMP的成骨性能,促进骨缺损的再生。因此,SMP已成为骨缺损修复研究中极具前景的植入性材料。后续研究应对其性能进行更全面、更深入的优化,以期推动其临床应用。
