经首次根治性手术治疗口腔鳞状细胞癌患者的生存相关影响因素分析
2020-03-05薛伶俐李雅冬
薛伶俐 李雅冬
重庆医科大学附属第一医院颌面外科 重庆 400010
头颈癌(head and neck cancer,HNC)是世界上第六大常见癌症[1]。口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是HNC中仅次于喉鳞状细胞癌的预后第二差的恶性肿瘤[2],在世界范围内都是一个难题。OSCC具有很高的局部侵袭力和淋巴结转移潜力[3],很多患者在确诊时常已进入中晚期。虽然随着医学的进步,OSCC的治疗方式得以不断改进,尤其是强调个体化的综合序列治疗理念已被国内各级医院普遍接受[4],然而近年来OSCC的发病率呈现增加的趋势,预后也没有明显改善,总体生存率基本维持在50%~70%[5-7]。我国目前关于OSCC生存预后因素的回顾性研究相对较少,本研究通过回顾性分析OSCC患者的术后定期回访资料和临床病理资料,得出其5年总体存活率(overall survival,OS),探讨影响患者术后生存时间的相关临床病理因素,以便为临床工作提供一定的参考。
1 材料和方法
1.1 临床资料
本研究收集了重庆医科大学附属第一医院颌面外科2011.4—2013.12间首次接受根治性外科手术治疗的OSCC患者共78例作为研究对象。所有病例均经病理诊断确诊为OSCC,并于重庆医科大学附属第一医院颌面外科接受首次根治性外科手术治疗,手术同期均未发现远处转移,接受手术治疗时手术切缘均为阴性。78例患者按照年龄分为低龄组(≤60岁)和高龄组(>60岁)两个亚组;根据临床分期(TNM分期),将研究对象分为早期(Ⅰ、Ⅱ期)和中晚期(Ⅲ、Ⅳ期)两个亚组;根据病理分级,将研究对象分为高分化和中、低分化两个亚组。
1.1.1 纳入标准 1)经病理诊断证实的原发性局部OSCC患者,包括舌、颊、牙龈、硬腭、口底共5个部位;2)经颌面外科医生评估为可切除者,卡氏功能状态(Karnofsky performance status,KPS)评分>60分;3)治疗前5年内无其他恶性肿瘤疾病史;4)治疗措施采用以首次根治性外科手术治疗为主,并辅助选择性放化疗的综合序列治疗方案;5)临床病理资料完整。
1.1.2 排除标准 1)拒绝手术,或者因合并手术禁忌证不能耐受手术者;2)住院期间死亡患者;3)术后5年内因其他疾病去世患者;4)因未按时复诊,或更换联系方式等致失访患者。
1.2 治疗方法
所有患者均由经验丰富的外科医生进行规范化外科手术治疗。手术强调根治性切除原发病灶,根治性切除的安全缘为1.5 cm[8],术中采用冰冻切片检查确保手术安全缘,术区缺损行同期修复重建术。对颈部有可疑转移灶的患者联合进行颈淋巴清扫术,术后至肿瘤科进一步评估,辅以放疗和/或全身化疗。
1.3 随访
患者完成手术治疗后,通过门诊定期随访、电话阶段随访的方式对研究对象进行周期性随访。随访内容包括:患者生存状态、死亡时间、死亡原因、术后相关治疗、是否复发、复发部位、再次治疗内容等。随访起点为接受手术日期,随访止点为死亡日期或生存超过5年最后一次随访时间。随访周期为前2年每3个月随访1次,第3~5年每6个月随访1次,5年以上为每年随访1次,于2019年3月完成最后一次随访,预后指标采用5年总体存活率及生存时间。
1.4 统计分析
由SPSS 22.0统计学软件进行统计分析。1)描述性分析:计量资料以均数±标准差或中位数及四分位间距表示,计数资料以百分率表示;采用独立样本t检验或χ²检验对事件结果的发生率进行比较。2)生存相关分析:采用Kaplan-Meier法绘制生存曲线,采用COX比例风险回归模型进行单因素和多因素分析。检验水准为双侧α=0.05。
2 结果
2.1 一般情况
术后收集并定期随访患者共计78例,因未定期复诊、更换联系方式致失访者共7例(排除),随访率为91.0%。至随访截止时间(2019年3月),有4例患者在术后1~4年内发生了食道鳞状细胞癌(esophageal squamous cell carcinomas,ESCC),OSCC合并ESCC患者占比5.1%(4/78),术后2年内因ESCC死亡患者共3例(排除)。最终纳入符合条件的患者共68例,中位随访时间为63(6~87)个月,最短随访时间6个月(死亡),最长87个月(超5年生存最后一次随访),平均年龄为(60.9±10.6)岁。
本组68例OSCC患者的基线资料详见表1。
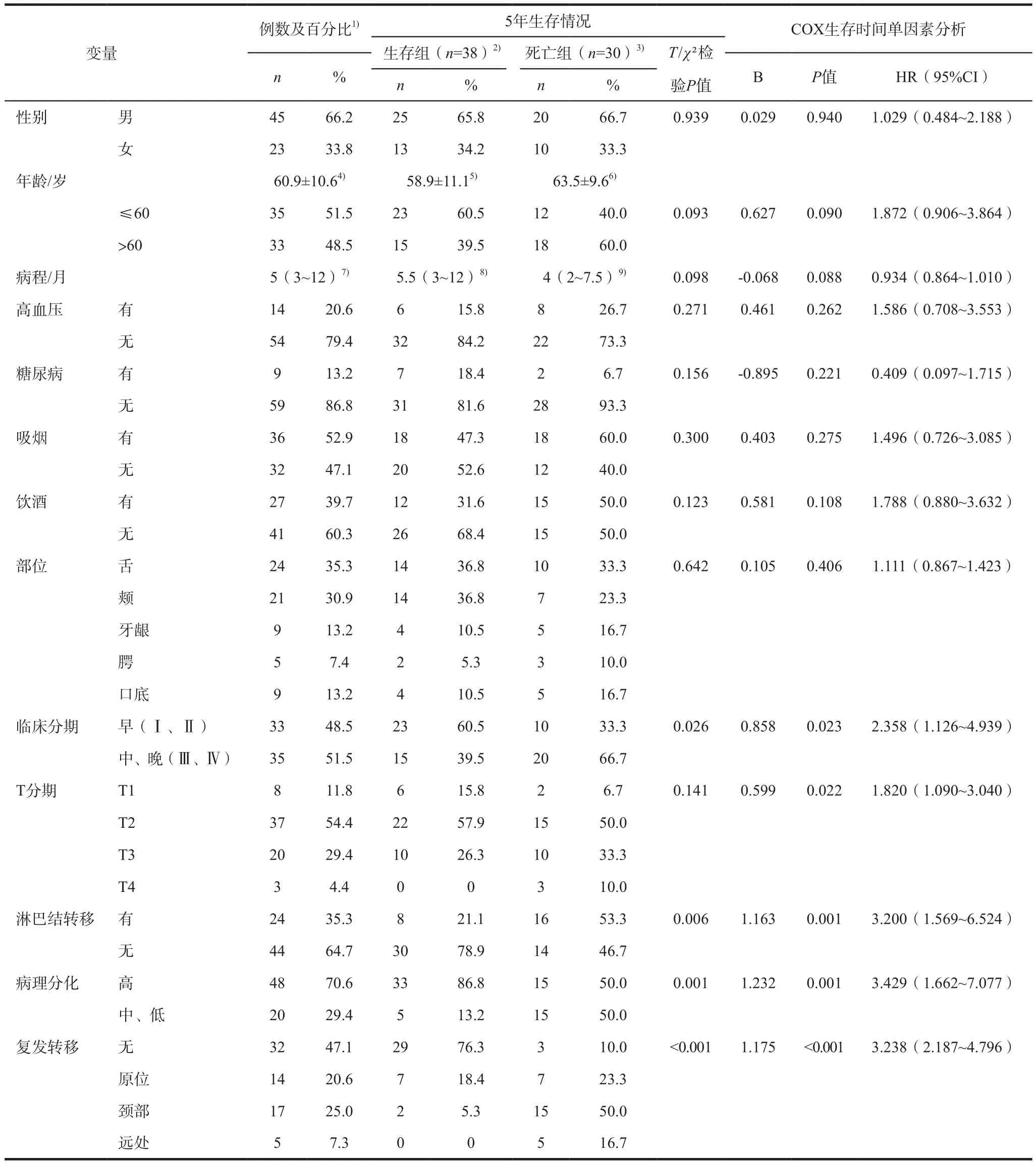
表1 基线资料及生存相关单因素分析结果Tab 1 Basic demographic data and univariate analysis results associated with survival
截至随访终点,超过5年存活总数为38例,OS为55.9%。总体生存曲线如图1 所示。5年内死亡患者的最短生存时间为6个月,最长生存时间为52个月,中位生存时间为20.5个月,四分位间距10~40个月。患者的性别、年龄、病程、高血压、糖尿病、吸烟、饮酒、患病部位以及原发灶大小(T分期)对于5年OS影响的差异无统计学意义(P>0.05),而临床分期、淋巴结转移、病理分化以及复发转移对5年OS的影响则有统计学意义(P<0.05)。早期(Ⅰ、Ⅱ期)患者5年OS(60.5%)优于中晚期(Ⅱ、Ⅳ期)患者(39.5%)(P=0.026);经病理证实存在淋巴结转移的患者5年OS低于无转移者(P=0.006);高分化患者5年OS显著优于中、低分化患者(P=0.001);术后无复发转移者的5年OS显著优于有复发转移者,而对有复发转移患者的5年OS,原位复发者>颈部转移者>远处转移者(P<0.001)。

图1 68例OSCC患者的总体生存曲线Fig 1 The survival curve of 68 patients with OSCC
2.2 影响生存时间的COX单因素分析
对所选择的变量采用COX单因素分析,结果见表1。临床分期、原发灶大小、淋巴结转移、病理分化及复发转移是影响生存时间的暴露因素(P<0.05)。早期(Ⅰ、Ⅱ期)患者较中晚期(Ⅲ、Ⅳ期)生存预后好(P=0.023);肿瘤原发灶越大(即T分期越高),生存预后越差(P=0.022);手术同期经病理证实有淋巴结转移者较无淋巴结转移生存预后要差(P=0.001);高分化患者的总体生存预后优于中、低分化患者(P=0.001);术后无复发转移者生存预后优于有复发转移者(P<0.001)。运用Kaplan-Meier 法绘制生存曲线如图2~6所示。性别、年龄、病程、高血压、糖尿病、吸烟、饮酒、原发肿瘤部位对OSCC术后生存时间的影响无统计学意义(P>0.05)。

图2 临床分期生存曲线Fig 2 The survival curves for TNM stage

图3 原发灶大小生存曲线Fig 3 The survival curves for tumor size
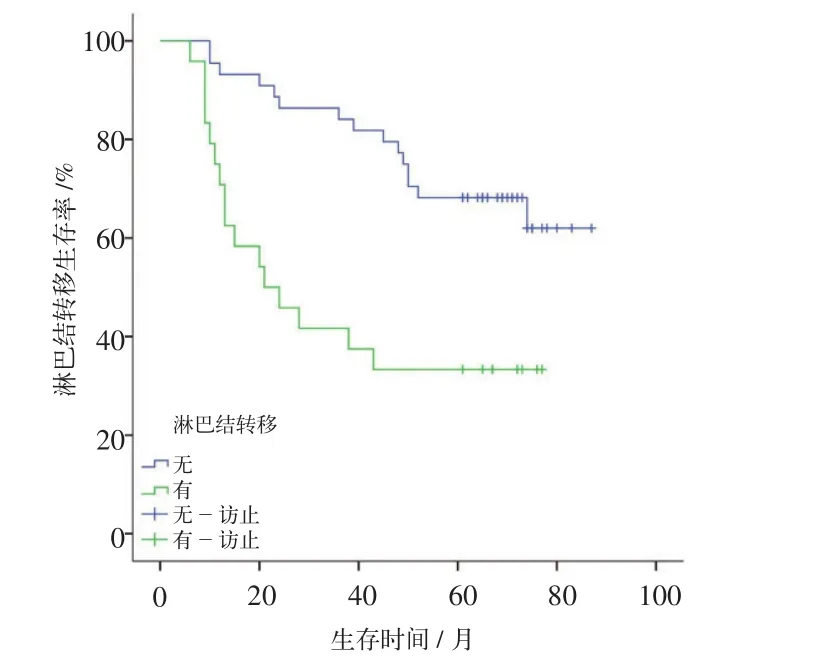
图4 淋巴结转移生存曲线Fig 4 The survival curves for lymphatic metastasis
2.3 影响生存时间的COX多因素分析
对单因素分析有统计学意义的协变量引入多因素COX比例风险回归模型分析,结果见表2:病理分化(P=0.015)、复发转移(P<0.001)是与术后生存时间相关的独立因素。

图5 病理分化生存曲线Fig 5 The survival curves for pathological differentiation
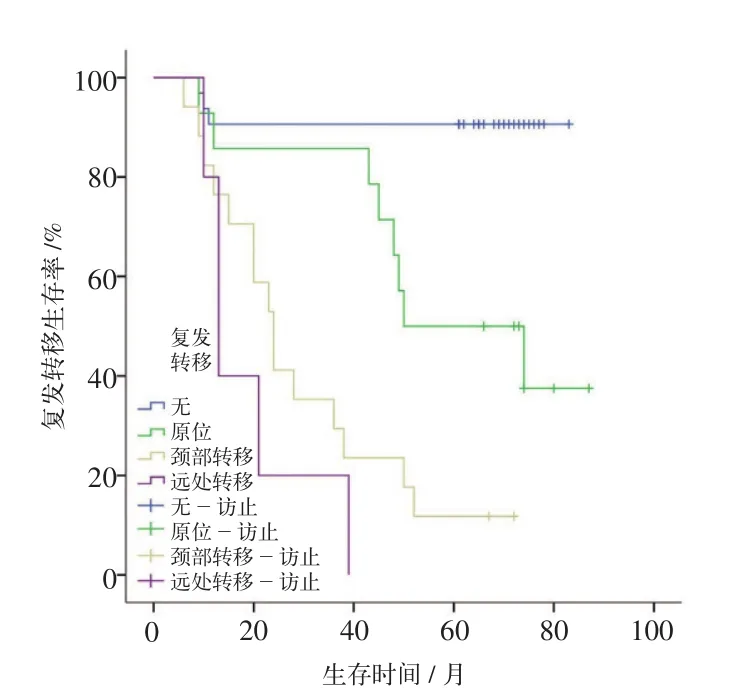
图6 复发转移生存曲线Fig 6 The survival curves for recurrence and metastasis

表2 生存相关多因素分析结果Tab 2 Multivariate analysis results associated with survival
3 讨论
OSCC是口腔癌中发病率最高的恶性肿瘤,占比超过90%[5-6],因而OSCC的诊治在口腔医生的临床工作中占有相当重要的地位。OSCC患者在就诊初期,常已合并原发灶的广泛侵犯及淋巴结转移现象,根治性外科切除仍是当前最主要的治疗方式。OSCC手术治疗常造成颌面部大面积组织缺损。虽然随着医学技术的进步,目前可通过运用计算机辅助外科技术及显微外科技术,采用同期组织修复重建及后期赝复体修复,以实现一定的功能恢复,但因为OSCC具有局部浸润性、早期易淋巴结转移、复发率较高等特性,近10年来的生存率依然未取得明显提高[5,9]。本组随访并纳入研究的患者共68例,其5年总体存活率为55.9%,与当前国际上的研究结果[5-7]无明显差异。本研究通过回顾性分析,重点探讨影响OSCC患者生存时间的预后因素。
OSCC的形成是多种因素共同作用的结果,其发生机制尚不明确,主要与长期慢性刺激引起的炎症反应有关[5,7,9-10],烟草和酒精在其病因学中占有很重要的作用[11-12],是OSCC发生的独立因素[13],但尚无文献表明烟草和酒精与OSCC的预后生存有关。本研究病例中,吸烟、饮酒对生存预后无明显影响,但52.9%患者有吸烟史,39.7%患者有饮酒史,可见烟酒与OSCC的发生存在一定相关性。
本组68例研究病例中,最常见的患病部位是舌(35.3%),其次为颊部(30.9%)。本组研究显示OSCC的发生部位与生存预后之间无明显相关性,不同部位生存率及生存时间的差异均无统计学意义(P>0.05),这与多项研究[14-18]的结果一致。也有学者有不同的发现。Montero等[19]通过对1 617例临床病例进行回顾性研究发现,发生在硬腭者的生存预后最差,其次为舌、上牙龈、颊,而口底及下牙龈患者的生存预后相对较好。Dissanayaka等[20]的研究表明,颊癌患者的生存预后好于舌癌。Asio等[21]则发现,口底癌及牙龈癌患者的生存预后最差。这可能与地区、人种的因素有关,也可能是由于中晚期患者病损累及范围较大,从而导致在部位分类时可能出现一定的分类误差所致。目前对OSCC发生部位与生存预后的相关性尚不明确,有待于细化部位分类方法进一步研究。
OSCC的TNM分期一直被认为是非常重要的临床预后因素,并且是选择治疗方式的影响因素,肿瘤的大小和有无淋巴结转移为制定治疗计划提供了有力的依据[20]。通过本组研究的单因素、多因素分析结果可知,TNM分期、肿瘤的大小及淋巴结转移是OSCC生存相关的暴露因素,但均不是影响生存预后的独立因素。Taghavi等[22]指出,虽然很多学者认为肿瘤分期通过评估原发肿瘤的大小及淋巴结的状态对生存率有着显著影响,但TNM分期不能单独作为判断预后的因素。Grimm[23]通过对484例OSCC患者的临床病理参数与预后、生存、复发进行单因素和多因素分析,得出淋巴结受累与患者的预后不良有一定相关性,但并非独立预后因素。分析可能的原因主要有:1)TNM系统及原发灶大小T分类完全基于肿瘤的解剖学范围,忽略了肿瘤的个体组织学特征、生物学行为和肿瘤-宿主相互作用[24];2)TNM系统需通过治疗进行分层,以更好地确定与生存结局的关系[19];3)本组病例采用2009年第7版TNM分期,缺乏对肿瘤浸润深度(depth of invasion,DOI)的描述。研究[24-25]表明,肿瘤浸润深度与其恶性程度、局部复发、淋巴结转移及生存预后有着紧密联系。新版TNM分期(2016年第8版)已将DOI纳入T分期[26]。4)本研究样本量有限,只针对有无淋巴结转移进行分析。相关研究[27]表明,淋巴结转移与生存预后的关系,需进一步引入N分期、淋巴结包膜外侵犯(extranodal extension,ENE)、淋巴结比率(lymph node ratio,LNR)等概念。 新版TNM分期同样已经引入了ENE的概念。此外,还有研究[28]证明,LNR是OSCC的独立预后因素,相比ENE和N分期,LNR对患者总体生存预后的意义更大。在将来,LNR或许会被引入肿瘤分期系统中[28-30]。
世界卫生组织分级系统采用Broders分类,将OSCC病理分级分为3个级别:Ⅰ级(分化良好/高分化),Ⅱ级(中分化)和Ⅲ级(低分化)[31]。本组研究得出,病理分化是影响患者生存时间的独立因素(P=0.015)。通过Kaplan-Meier法绘制的生存曲线(图5)可以看出,无论是近期还是远期生存,高分化患者较中、低分化患者都有着更好的生存预后。有学者[20]认为,尽管Broders分类依赖于肿瘤细胞的结构特征而不是功能特性,但根据研究结果依然可以得出,良好分化与不良分化的OSCC患者的存活率存在明显的差异。相关研究[32-35]表明,OSCC的病理分化越好,miR-138-5p、细胞角蛋白16(cytokeratins 16,CK16)、CD163、B7-H6蛋白等因子的表达越高,其总体生存预后越好;OSCC的病理分化越差,上述因子的表达越低,其总体生存预后越差(P<0.05)。黄江峰等[36]通过对456例OSCC患者的临床资料及生存情况进行回顾性研究,同样得出组织学分级是影响其生存的重要因素。Wang等[37]对275例OSCC患者的复发与生存相关因素进行分析,也发现不良分化患者5年总体复发及生存等预后明显低于分化良好的患者。
肿瘤术后的复发转移被认为是影响生存率的一个相当重要的因素[22]。本组患者中,有36例术后发生了复发和(或)转移。死亡病例中,90%发生复发转移。术后无复发转移者5年OS明显优于有复发转移者,且在复发转移病例中,原位复发者OS>颈部转移者OS>远处转移者OS(P<0.001)。由此可见,肿瘤的复发转移是影响术后生存预后的一个独立危险因素,且术后发生转移的患者较局部复发者拥有更差的生存预后,通常认为是无法治愈的[38]。研究[39]表明,OSCC的远处转移率相对较低,约为10%。本组中的OSCC患者,有5例在术后1~3年发生了远处转移,远处转移率为7.4%,所有远处转移患者,均在发现转移后1~2年内死亡。关于OSCC复发的原因及机制目前尚不明确。相关研究[40-44]指出,低龄、有复发史、低分化肿瘤、区域淋巴结的转移以及高LNR患者具有更高的复发风险。
此外,在本组随访病例中,笔者意外发现,有4例患者在接受手术等相关治疗后,未再出现复发或转移,但在术后1~4年内相继被诊断出患有ESCC。4例患者均有长期吸烟饮酒史,其中3例患者因ESCC去世。食道癌是胃肠道中侵袭性很强的癌症之一,是全球癌症相关死亡的第六大常见原因,其中ESCC占全球食道癌病例的90%,对人类健康和生活质量有显著影响[45]。与OSCC相似,对食道黏膜反复的化学和物理刺激可以增加发生ESCC的风险,烟草和酒精的使用是ESCC发生的危险因素[46]。ESCC与OSCC在生物学上具有许多共同特征,但目前尚无有效研究证明两者之间存在转移关系。近年在关于口腔癌患者发生食道癌的风险及相关因素的研究发现,牙龈卟啉单胞菌可能在其中起到一定作用。Olsen等[47]通过建立肿瘤的发生模型发现,牙龈卟啉单胞菌和致癌作用之间存在直接关系。Ha等[48]证明,牙龈卟啉单胞菌可以通过上皮-间充质转变样变化和癌症干细胞特性的获得来增加口腔癌细胞的侵袭性,提示牙龈卟啉单胞菌可能作为潜在的细菌风险调节剂而存在。Meng等[45]在研究牙龈卟啉单胞菌在消化系统癌症中的可能作用时,发现牙龈卟啉单胞菌可能参与ESCC的发病机制,牙龈卟啉单胞菌血清生物标志物对于早期检测ESCC可能是非常重要的,并且可用于早期诊断及改善预后。鉴于口腔与食道之间的解剖关系,Olsen等[47]提出,口腔微生物、细菌分泌的效应物、炎症细胞和介质可能随唾液和血液一起移动到远处并诱导全身性致癌作用。OSCC患者携带的可能诱发癌症的牙龈卟啉单胞菌,除原发灶的侵犯外,可在食道形成二次侵入,导致ESCC的发生[45]。Matsui等[49]通过对166名OSCC患者进行改良食道胃十二指肠镜检查,共检出37个食道和16个下咽部癌变,从而提出患有OSCC的患者需要密切监测下咽和食道发生鳞状细胞癌的建议。基于以上发现,笔者认为,在临床工作中,有吸烟饮酒史的OSCC患者,应常规开展一些ESCC的临床基础筛查,如牙龈卟啉单胞菌血清生物标志物检查、食道胃十二指肠镜检查等以监测食道病变,从而对OSCC患者合并ESCC者做到早发现早诊断早治疗,进一步提高患者的生存预后。基于本研究的样本量有限,OSCC与ESCC之间更紧密的关系有待进一步研究。
本组研究通过回顾性分析得出,根据肿瘤的TNM分期、原发灶大小、淋巴结转移、病理分化及复发转移可对患者的生存预后作出一定的预测。TNM分期、原发灶大小及淋巴结转移对OSCC患者治疗方式的制定及治疗结果起着重要作用,但对于患者生存预后并非独立影响因素;而病理分化及复发转移则是影响OSCC患者生存时间的独立因素。然而,对于围手术期患者的生存预后判断,复发转移尚是一个未知因素,需进一步分析其发生相关临床病理因素,以更好地选择患者个体化的治疗方式,并对近远期预后作出判断。此外,基于OSCC患者发生ESCC的可能风险,对有吸烟饮酒史的OSCC患者,应常规开展一些ESCC临床筛查。本研究属于小样本量的回顾性研究,尚存在一些局限性,未来有待加大样本量及研究范围,结合临床病理、生物分子及遗传等方面,进一步分层分析术后生存结果及相关因素,如疾病特异性生存、局部控制、区域控制等,分析癌症相关死亡风险及局部复发风险,以进一步评估治疗结果和不同的治疗选择[19]。
