以种子电导率为指标定位水稻耐储藏QTL
2020-03-05曹玉洁费月新赵文佳侯璐燕王越吴敏许珊吴洪恺
曹玉洁费月新赵文佳 侯璐燕 王越 吴敏 许珊 吴洪恺
(浙江农林大学农业与食品科学学院,杭州311300;#共同第一作者;*通讯作者:hongkaiwu@163.com)
水稻是中国乃至世界上最重要的粮食作物之一,为了保证农业生产安全和粮食安全,需要对水稻种子和稻谷(粮食)进行储备。但是,长期储藏后,往往造成种子生活力下降,稻米品质劣变。因此,水稻耐储藏研究是一个重要的研究方向。
水稻种子耐储性的评价主要采用种子活力等方面的指标,如发芽率、发芽势、发芽指数等,这些指标能完整反映种子(生)活力变化的情况,同时也更能表现生产实际状况,因此广泛应用在水稻种子耐储性相关研究中[1-2]。种子在清水中浸出液的多少可以间接反映种子细胞膜系统的完整性和种子老化的程度,种子浸出液多,种子老化程度深,电导率增加。因此,种子浸出液电导法作为一种简易、快速、客观的种子活力测试方法,已经广泛应用于许多物种的种子活力检测[3],并形成了国际标准方法[4]。也有报道指出,种子浸出液电导法可用于稻米(粮食)陈化的谷物化学研究。周显青等[5]研究表明,随着稻谷储藏时间的延长和陈化程度的加深,种子浸出液电导率逐渐增大,能反映不同储藏年限稻谷品质的差异。
可见,种子浸出液电导率既可以评价种子储藏老化后的(生)活力,又可以评价稻米(粮食)储藏后品质劣变的程度。因此,种子浸出液电导率是研究水稻耐储藏性状的理想指标。笔者以种子浸出液电导率为指标,用本实验室构建的高代回交群体为材料,进行了稻米耐储藏QTL的定位,结果报道如下。
1 材料与方法
1.1 试验材料
以扬稻6号为供体亲本,粳稻秀水134为受体亲本,杂交获得F1,与轮回亲本秀水134连续回交3次,自交1次,得到BC3F2群体。种子收获后,自然晒干至含水量13%,常规条件下,室温储藏16个月备用。
1.2 试验方法
1.2.1 多态性分子标记的筛选和连锁图谱的构建
根据McCouch等构建的分子标记连锁图谱[6],选择分子标记进行秀水134和扬稻6号间多态性分析;用Mapchart 2.2绘制多态性SSR标记连锁图。
1.2.2 相对电导率的测定
参照ISTA方法[4]进行。每个株(系)随机称取饱满未破损的种子50粒,放入100 mL烧杯中,用量筒量取50 mL去离子水加入烧杯中,用保鲜膜覆盖烧杯口,使其呈密封状态,放置在22℃的培养箱中24 h。揭去保鲜膜,轻轻搅拌,稳定后,用DDS-307A型电导仪测定。以相同的去离子水为空白对照,重复4次。
电导率(μS/cm)=(样品浸出液电导率-空白对照电导率)/样品种子质量。
1.2.3 QTL 检测
用SPSS软件进行性状-标记基因型的单因素方差分析,计算目标性状在分子标记基因型间的差异由误差造成的概率P。用-log10(P)的大小来表示该位点存在QTL的可能性大小。以-log10(P)为纵坐标,分子标记遗传距离(cM)为横坐标做折线图,取-log10(P)>2(即p<0.01)为阈值,进行QTL分析,计算QTL相对加性效应值和贡献率。

图1 秀水134和扬稻6号间多态性分子标记连锁图谱

图2 电导率次数分布图
A位点QTL相对加性效应值=(A3A3表型值-A1A1表型值)/2×A1A1表型值×100%。
A3A3表示供体亲本基因型;A1A1表示背景亲本基因型。
QTL贡献率=基因型间平方和/总平方和×100%。
2 结果与分析
2.1 SSR分子标记连锁图谱的构建
根据McCouch(2002)构建的分子标记连锁图谱[6],选择了629对引物,进行秀水134和扬稻6号间多态性分析,筛选到两个亲本间有多态的引物263对,亲本间多态性比例为41.8%。选择PCR扩增条带分辨清晰,且均匀覆盖水稻12条染色体的95对多态性分子标记,用Mapchart2.2绘制多态性SSR标记连锁图(图1),全基因组总长度为 1 499.6 cM。
2.2 群体耐储藏特性的表现
本研究所用的群体包括615个个体。这615个个体的电导率分布见图2,电导率值最大的为38.12 μS/(cm·g),最小的为5.45 μS/(cm·g),平均值为14.94 μS/(cm·g)。大部分个体的电导率分布在9~21 μS/(cm·g)之间,占比91.73%。同时,还存在极端个体,暗示该群体中可能存在效应较大的减效或增效QTL。
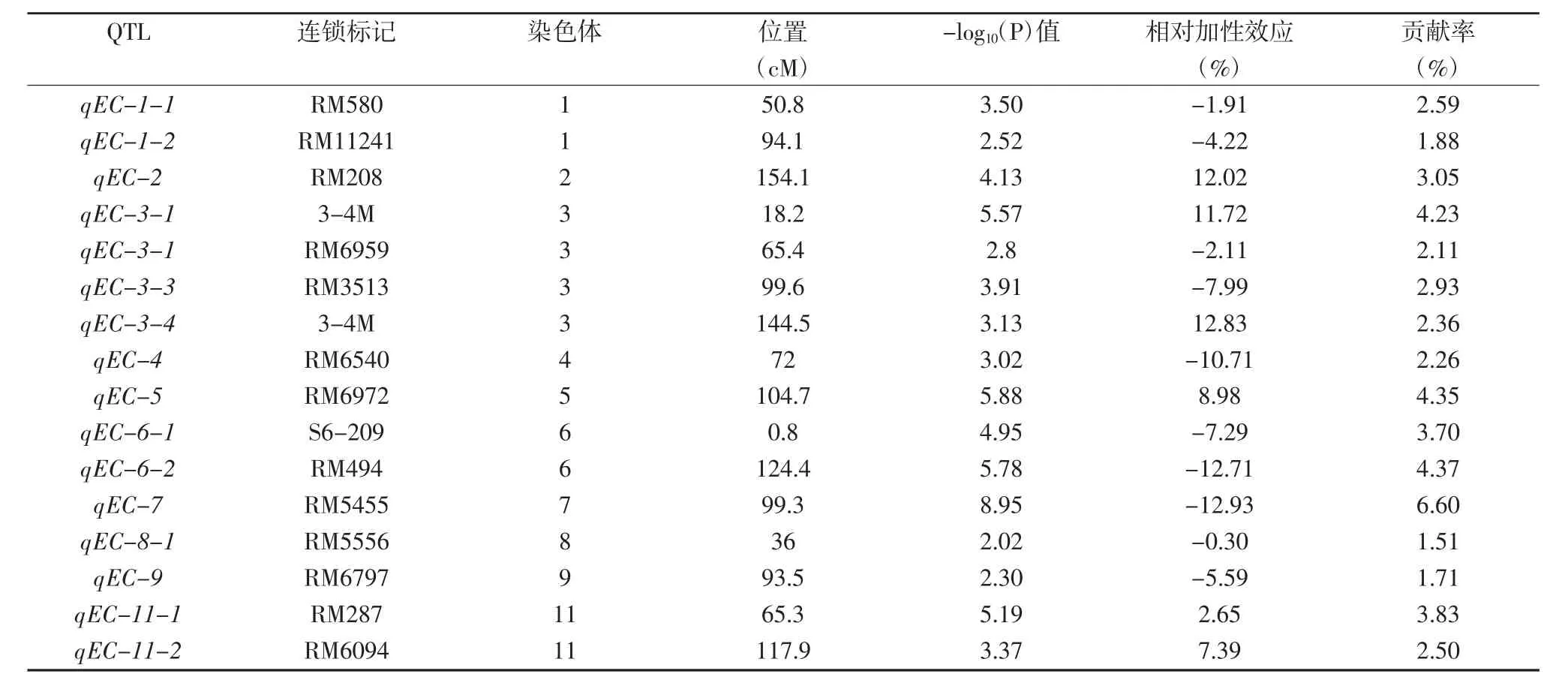
表1 水稻种子电导率为指标的耐储藏QTL检测
2.3 耐储藏特性QTL分析
用SPSS软件进行表型值-基因型单因素方差分析,用-log10(P)值的大小来表示某一位点存在QTL可能性的大小,该值越大,则QTL存在的可能性越大。以-log10(P)为纵坐标,分子标记遗传距离(cM)为横坐标做折线图,取-log10(P)>2(即p<0.01)为阈值,检测到16个耐储藏相关的QTL,结果见图3。
除第10和第12染色体上未检测到控制电导率的QTL外,其余10条染色体均检测到。其中,第3条染色上检测到的QTL最多,有4个,占总数的25%。计算16个QTL的相对加性效应与贡献率,得到表1。16个QTL 中,有 6 个 QTL(qEC-11-2、qEC-11-3、qEC-5-1、qEC-3-2、qEC-2、qEC-3-6)表现为正效应,即来自供体(扬稻6号)的等位基因是增效基因,其相对加性效应变幅范围为 2.65%~12.83%;其余 10 个 QTL(qEC-8-1、qEC-1-1、qEC-3-3、qEC-1-2、qEC-9-1、qEC-6-1、qEC-3-4、qEC-4-1、qEC-6-4、qEC-7-2) 表现为负效应,即来自供体(扬稻6号)的等位基因是减效基因,其相对加性效应变幅范围为-12.93%~-0.30%。16个QTL的贡献率变幅范围为1.51%~6.60%,其中,第7染色体上的qEC-7-2贡献率最大,为6.6%;其-log10(P)值也最大,为8.95,是可能性最大的控制电导率的QTL。
3 讨论
种子电导率的变化反应了细胞膜的完整性[7],既可以评价种子储藏老化后的活力,又可以评价稻米(粮食)储藏后陈化的程度,可以综合全面评价水稻的耐储藏特性。以电导率来评价水稻耐储藏特性操作简单,结果客观,所需时间短,因此得到了广泛应用[8]。但是,电导率的遗传研究未见报道。
我们以高代回交群体BC3F2为材料,分析了控制电导率的基因位点,共检测到16个QTL,分布在除第10和第12染色体的其余10条染色体上。16个QTL的贡献率变幅范围为1.51%~6.60%,贡献率都比较小,暗示电导率的遗传比较复杂,影响因素多。对于复杂的遗传性状,染色体代换系是理想的研究群体[9-11]。染色体片段代换系具有许多非常突出的优点,染色体片段代换系遗传背景单一,每个代换系只有一个或少数几个供体片段,这样可以避免不同基因间相互作用来影响QTL定位,可以提高QTL定位的准确性;染色体片段代换系的每个个体都是纯合稳定的,可以提供大量的种子用于多点、多年、多重复的试验,这样可以提高QTL效应和贡献率的精确性。
