脉管Ⅱ号胶囊对Ang-1/Tie2信号通路及人脐静脉内皮细胞的影响
2020-03-05王世军张美吉杨尾莲陈福伟林欣欣
王世军 张美吉 杨尾莲 陈福伟 林欣欣
作者单位:350004 福建 福州,福建中医药大学附属人民医院中医外科(王世军,张美吉,杨尾莲,陈福伟);350004 福建 福州,福建中医药大学第一临床医学院2016级(林欣欣)
血管生成是指在原有血管基础上以出芽生长的方式长出新生血管的过程,可参与肿瘤的发生及发展、炎症反应等多种病理过程[1],故抑制血管生成已成为目前抗肿瘤治疗研究的热点。近年来部分研究显示,血管生成素1(angiopoietin-1,Ang-1)及其受体酪氨酸激酶受体2(tyrosine kinase receptors 2,Tie2)可通过信号通路的转导促进血管生成,在胚胎期血管形成和成年期血管新生中发挥着重要的调控作用,如在炎症反应和肿瘤发生及发展等多种生理或病理原因致使血管增生的情况下均可发现Ang-1和Tie2的表达水平明显升高[2-3]。既往已有研究证实,脉管Ⅱ号胶囊可改善下肢动脉硬化闭塞症患者肢端缺血症状,但其具体作用机制不明,笔者为进一步探讨其作用机制,以人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)为研究对象,观察了脉管Ⅱ号胶囊对其Ang-1和Tie2表达的影响。
1 材料与方法
1.1 主要材料与试剂
脉管Ⅱ号胶囊:福建中医药大学附属人民医院内部制剂,闽药制字Z06106040,由君药赤芍、牡丹皮,臣药水蛭、莪术,佐使药全蝎、蜈蚣等中药浓缩颗粒置于胶囊(江阴天江药业有限公司生产)内而成[4-5];HUVECs:中国科学院典型培养物保藏委员会细胞库提供;去内毒素质粒提取试剂盒:OMEGA公司生产;兔抗鼠Ang-1、Tie2、GAPDH及羊抗兔IgG:Abcam公司生产;血管内皮生长因子及F12K培养基:Invitrogen公司生产;空载质粒及Ang-1-pReceiver-M98质粒:上海吉玛制药技术有限公司设计并构建。
1.2 实验动物与分组
SPF级雌性SD大鼠20只,3月龄,体质量(257±24)g,均由湖北省疾病预防控制中心提供。将大鼠置于室温23℃左右、湿度60%左右的环境内饲养1周后,按照随机数表法将其随机分为高剂量血清组与低剂量血清组,每组10只,分别以90 mg·kg-1·d-1与30 mg·kg-1·d-1的剂量喂服脉管Ⅱ号胶囊,用于制备高剂量和低剂量含药血清。
1.3 细胞培养与分组
转染液的制备:将1.5μL转染试剂加入无菌离心管中,涡旋混匀后加入0.5μg空载质粒或重组了Ang-1干扰片段的Ang-1-pReceiver-M98质粒,混匀静置15 min,获得空载质粒转染液和Ang-1-pReceiver-M98转染液。
将HUVECs分为空白组、空载组、低剂量组、低剂量+Ang-1干扰组、高剂量组及高剂量+Ang-1干扰组,其中空白组与空载组HUVECs均置于含有10%胎牛血清、1%丙酮酸钠、0.1 mg/mL肝素和0.05 mg/mL血管内皮生长因子的F12K培养基内,并分别接种于96孔培养板中放在37℃、5%CO2环境内培养,每3 d更换1次培养基,待HUVECs培养至融合度达到60%~80%时,按每孔102μL将空载质粒转染液加入空载组培养板中,充分混匀,放回培养箱中培养4 h,去上清,再加入完全培养基,在37℃、5%CO2环境内继续培养;低剂量组与低剂量+Ang-1干扰组HUVECs均置于含有10%低剂量含药血清(取自低剂量血清组大鼠)、1%丙酮酸钠、0.1 mg/mL肝素和0.05 mg/mL血管内皮生长因子的F12K培养基内,并分别接种于96孔培养板中放在37℃、5%CO2环境内培养,每3 d更换1次培养基,待HUVECs培养至融合度达到60%~80%时,按每孔102μL将Ang-1-pReceiver-M98转染液加入低剂量+Ang-1干扰组培养板中,充分混匀,放回培养箱中培养4 h,去上清,再加入完全培养基,在37℃、5%CO2环境内继续培养;高剂量组与高剂量+Ang-1干扰组HUVECs均置于含有10%高剂量含药血清(取自高剂量血清组大鼠)、1%丙酮酸钠、0.1 mg/mL肝素和0.05 mg/mL血管内皮生长因子的F12K培养基内,并分别接种于96孔培养板中放在37℃、5%CO2环境内培养,每3 d更换1次培养基,待HUVECs培养至融合度达到60%~80%时,按每孔102μL将Ang-1-pReceiver-M98转染液加入高剂量+Ang-1干扰组培养板中,充分混匀,放回培养箱中培养4 h,去上清,再加入完全培养基,在37℃、5%CO2环境内继续培养。
1.4 MTT法检测HUVECs增殖情况
将对数生长期的HUVECs以1.0×104个/孔的密度接种于96孔板内,放入CO2培养箱中,并加入H2O2(400μmol/L)培养24 h后,每孔加入10μL MTT(5 mg/mL)孵育4 h,弃去孔内液体,而后以150μL/孔加入二甲基亚砜震荡5~10 min,待甲臜颗粒充分溶解后使用酶联免疫检测仪检测490 nm及570 nm时的HUVECs吸光度值,分析细胞增殖情况。
1.5 Hoechst33258染色法观察HUVECs形态
将HUVECs置于4%多聚甲醛内固定10 min,弃去固定液后用PBS冲洗2次,每次3 min;冲洗完毕后,加入少量Hoechst33258染色液至淹没细胞,室温下染色3~5 min,然后弃去染色液,PBS冲洗5次,每次3 min;冲洗完毕后,置于荧光显微镜下观察细胞亮度和细胞凋亡情况。
1.6 Elisa法检测Ang-1、Tie2的表达水平
根据试剂盒说明书稀释标准品,在酶标包被板上设标准品孔,依次加入不同浓度的标准品50μL,绘制标准曲线。另外,在酶标包被板上再设空白孔与待测样品孔,其中空白孔内不加任何样品与试剂,直接用封板膜封板;待测样品孔内依次加入样品40μL、生物素标记抗体10μL、酶标试剂50μL,震荡混匀后用封板膜封板。封板后,将酶标包被板置于37℃环境下温育30 min,揭掉封板膜,弃去液体后甩干;甩干后,每孔内加满洗涤液(30倍浓缩洗涤液用蒸馏水稀释30倍而成)静置30 s后弃去,如此重复5次后拍干;拍干后,每孔依次加入显色剂A 50μL、显色剂B 50μL,轻轻震荡混匀,37℃环境下避光显色10 min后,加入终止液50μL终止反应。终止反应后,采用酶联免疫检测仪检测Ang-1、Tie2的表达水平。
1.7 Western blotting法检测Ang-1、Tie2蛋白表达水平
取24孔HUVECs分别置于冰面上,用RIPA蛋白裂解液裂解细胞20 min,每5 min振荡1次;裂解后,在4℃下以15000 r/min的速度离心30 min,吸取上清液,获取总蛋白;用10%SDS-PAGE凝胶电泳2.5 h及转膜后,将NC膜用TBS稍荡洗,并用5%脱脂奶粉室温封闭1 h;而后,在4℃下分别孵育Ang-1、Tie2及GAPDH一抗过夜,TBST洗膜3次,每次10 min;室温下孵育二抗1 h,TBST洗膜3次,每次10 min;最后,曝光显影,采用Image Lab软件进行蛋白条带灰度值分析。
1.8 统计学处理
采用SPSS17.0统计软件对所得数据进行统计学分析,其中计量资料以均数±标准差表示,多组间比较采用单因素方差分析,两组间比较采用t检验;均以P<0.05为差异具有统计学意义。
2 结果
2.1 各组细胞增殖情况对比
与空白组对比,空载组细胞的相对增殖率无明显变化(P>0.05);高剂量组和低剂量组细胞的相对增殖率显著增加(P均<0.05),且高剂量组显著高于低剂量组(P<0.05);高剂量+Ang-1干扰组和低剂量+Ang-1干扰组细胞的相对增殖率显著降低(P均<0.05),且低剂量+Ang-1干扰组显著低于高剂量+Ang-1干扰组(P<0.05),详见表1。
表1 各组细胞相对增殖率对比Table 1 Comparison of relative proliferation rate of HUVECs among all groups
注:各组细胞相对增殖率对比,其中与空白组对比,a P<0.05,差异具有统计学意义;与空载组对比,b P<0.05,差异具有统计学意义;与高剂量组对比,c P<0.05,差异具有统计学意义;与低剂量组对比,d P<0.05,差异具有统计学意义;与高剂量+Ang-1干扰组对比,e P<0.05,差异具有统计学意义Note:The cell relative proliferation rate were compared among all groups:comparison with the blank group(a P<0.05)showed statistically significant difference;comparison with the unloaded group(b P<0.05)showed statistically significant difference;comparison with the high-dose group(c P<0.05)showed statistically significant difference;comparison with the low-dose group(d P<0.05)showed statistically significant difference;comparison with the high-dose+Ang-1 interference group(e P<0.05)showed statistically significant difference
组别Group细胞数(孔)Number of cells(well)相对增殖率Relative proliferation rate空白组Blank group 96 1.07±0.12空载组Unloaded group 96 1.03±0.10高剂量组High-dose group 96 1.86±0.18ab低剂量组Low-dose group 96 1.49±0.19abc高剂量+Ang-1干扰组High-dose+Ang-1 interference group 96 0.52±0.11abcd低剂量+Ang-1干扰组Low-dose+Ang-1 interference group 96 0.32±0.06abcde F值F value 1765.000 P值P value 0.000
2.2 各组细胞形态和细胞凋亡情况对比
空白组、空载组、高剂量组和低剂量组细胞均维持原有形态,细胞凋亡和细胞形态变化不明显;高剂量+Ang-1干扰组和低剂量+Ang-1干扰组细胞凋亡增加,且以低剂量+Ang-1干扰组细胞凋亡数量较大(图1)。
2.3 各组细胞Ang-1、Tie2表达水平对比
与空白组对比,空载组细胞Ang-1、Tie2表达水平均无明显变化(P>0.05);高剂量组和低剂量组细胞Ang-1、Tie2表达水平均显著增加(P均<0.05),且高剂量组显著高于低剂量组(P<0.05);高剂量+Ang-1干扰组和低剂量+Ang-1干扰组细胞Ang-1、Tie2表达水平均显著降低(P均<0.05),且低剂量+Ang-1干扰组显著低于高剂量+Ang-1干扰组(P<0.05),详见表2。
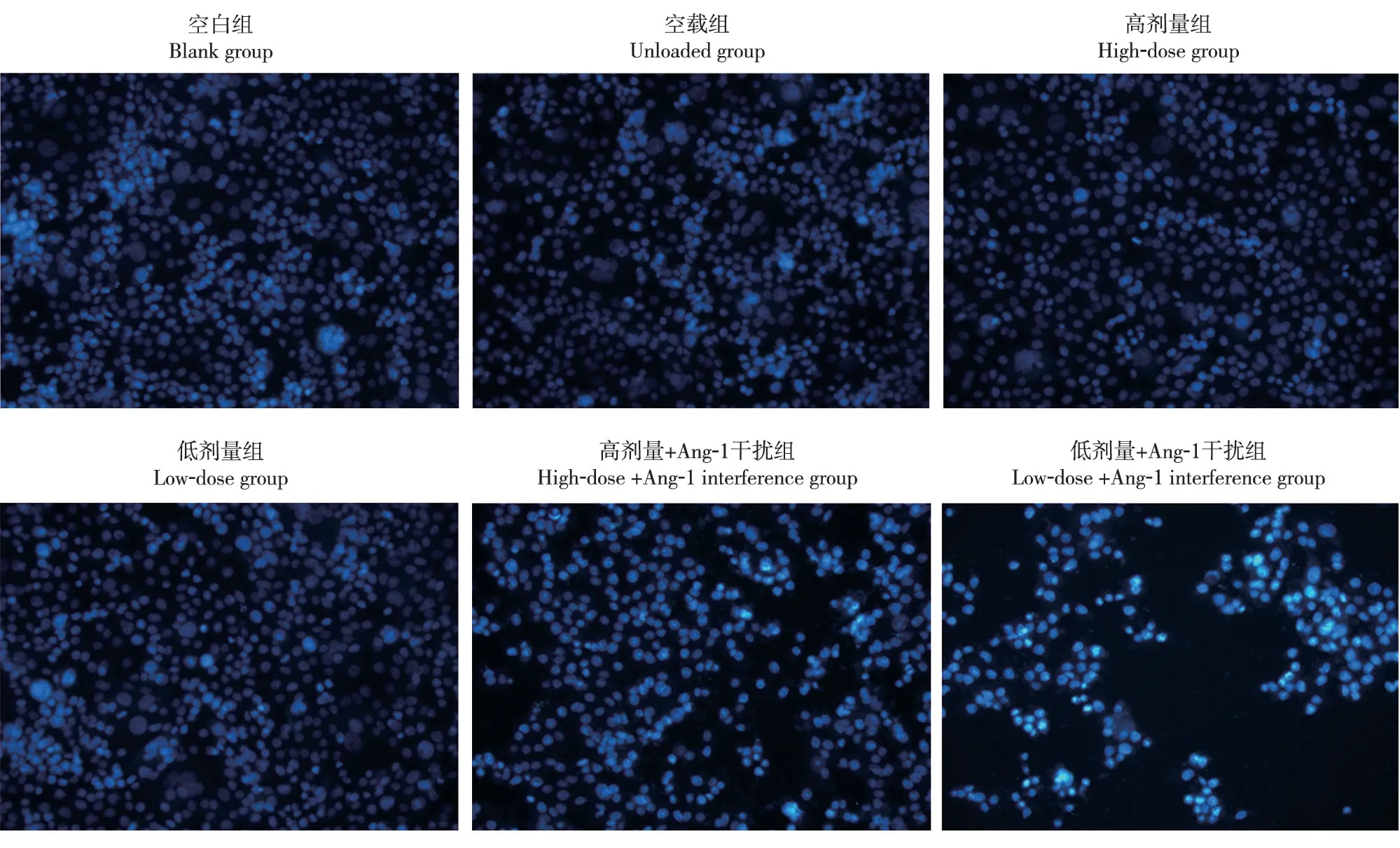
图1 免疫荧光染色法显示各组细胞凋亡和细胞形态变化(400×)Fig.1 Immunofluorescence staining shows changes of cell apoptosis and cell morphology in each group(400×)
表2 各组细胞Ang-1、Tie2表达水平对比Table 2 Comparison of the expression levels of Ang-1 and Tie2 among all groups

表2 各组细胞Ang-1、Tie2表达水平对比Table 2 Comparison of the expression levels of Ang-1 and Tie2 among all groups
注:各组细胞Ang-1、Tie2表达水平对比,其中与空白组对比,a P<0.05,差异具有统计学意义;与空载组对比,b P<0.05,差异具有统计学意义;与高剂量组对比,c P<0.05,差异具有统计学意义;与低剂量组对比,d P<0.05,差异具有统计学意义;与高剂量+Ang-1干扰组对比,e P<0.05,差异具有统计学意义Note:The expression levels of Ang-1 and Tie2 were compared among all groups:comparison with the blank group(a P<0.05)showed statistically significant difference;comparison with the unloaded group(b P<0.05)showed statistically significant difference;comparison with the high-dose group(c P<0.05)showed statistically significant difference;comparison with the low-dose group(d P<0.05)showed statistically significant difference;comparison with the high-dose+Ang-1 interference group(e P<0.05)showed statistically significant difference
组别Group细胞数(孔)Number of cells(well)Ang-1 Tie2空白组Blank group 96 1.08±0.17 0.99±0.08空载组Unloaded group 96 1.06±0.18 0.96±0.15高剂量组High-dose group 96 2.91±0.18ab 1.65±0.07ab低剂量组Low-dose group 96 1.86±0.23abc 1.38±0.15abc高剂量+Ang-1干扰组High-dose+Ang-1 interference group 96 0.33±0.05abcd 0.50±0.08abcd低剂量+Ang-1干扰组Low-dose+Ang-1 interference group 96 0.18±0.06abcde 0.22±0.04abcde F值F value 3925.000 2530.000 P值P value 0.000 0.000
2.4 各组细胞Ang-1、Tie2蛋白表达水平对比
与空白组对比,空载组细胞Ang-1、Tie2蛋白表达水平均无明显变化(P>0.05);高剂量组和低剂量组细胞Ang-1、Tie2蛋白表达水平均显著增加(P均<0.05),且高剂量组显著高于低剂量组(P<0.05);高剂量+Ang-1干扰组和低剂量+Ang-1干扰组细胞Ang-1、Tie2蛋白表达水平均显著降低(P均<0.05),且低剂量+Ang-1干扰组显著低于高剂量+Ang-1干扰组(P<0.05),详见表3、图2。
3 讨论
中医学认为,下肢动脉硬化闭塞症为邪气由表及里、由皮毛及脏腑,最终到达经络形成瘀阻所致[6]。福建中医药大学附属人民医院研制的脉管Ⅱ号胶囊利用其内含有的水蛭、全蝎、蜈蚣等药物“迅速飞走诸灵,俾飞者升,走者降,血无凝著,气可宣通,与攻积除坚,徒入脏腑者有间”的特性达到通利经脉、迫邪外出的作用,并且经临床研究证实其对下肢动脉硬化闭塞症具有良好的临床疗效。然而,脉管Ⅱ号胶囊的现代分子生物学作用机制却尚不明确。
表3 各组细胞Ang-1、Tie2蛋白表达水平对比Table 3 Comparison of protein expression levels of Ang-1 and Tie2 among all groups

表3 各组细胞Ang-1、Tie2蛋白表达水平对比Table 3 Comparison of protein expression levels of Ang-1 and Tie2 among all groups
注:各组细胞Ang-1、Tie2蛋白表达水平对比,其中与空白组对比,a P<0.05,差异具有统计学意义;与空载组对比,b P<0.05,差异具有统计学意义;与高剂量组对比,c P<0.05,差异具有统计学意义;与低剂量组对比,d P<0.05,差异具有统计学意义;与高剂量+Ang-1干扰组对比,e P<0.05,差异具有统计学意义Note:The expression levels of Ang-1 and Tie2 were compared among all groups:comparison with the blank group(a P<0.05)showed statistically significant difference;comparison with the unloaded group(b P<0.05)showed statistically significant difference;comparison with the high dose group(c P<0.05)showed statistically significant difference;comparison with the low dose group(d P<0.05)showed statistically significant difference;comparison with the high dose+Ang-1 interference group(e P<0.05)showed statistically significant difference
组别Group细胞数(孔)Number of cells(well)Ang-1 Tie2空白组Blank group 24 1.00±0.10 0.98±0.13空载组Unloaded group 24 0.96±0.14 0.94±0.15高剂量组High-dose group 24 3.10±0.14ab 1.78±0.16ab低剂量组Low-dose group 24 1.53±0.12abc 1.48±0.10abc高剂量+Ang-1干扰组High-dose+Ang-1 interference group 24 0.40±0.07abcd 0.51±0.06abcd低剂量+Ang-1干扰组Low-dose+Ang-1 interference group 24 0.18±0.04abcde 0.33±0.09abcde F值F value 2258.000 508.800 P值P value 0.000 0.000

图2 各组细胞Ang-1、Tie2蛋白表达条带图Fig.2 Histogram of the protein expression of Ang-1 and Tie2 of cells in each group
血管形成包括血管发生和血管生成两种方式,其中血管发生是胚胎发育过程中内皮细胞前体形成原始血管的过程;血管生成则是机体在一定刺激下由已有血管以分裂、芽生的方式形成新血管网络的过程[7]。血管内皮生长因子、黏附分子、增殖蛋白、转化生长因子及Ang-1/Tie2信号通路等调节因子均对血管的发生和生成具有调节作用[8-11]。Ang-1是促血管生成因子,其基因位于染色体8q22.3-q23部位,蛋白表达主要位于血管平滑肌细胞和周细胞。Tie2是Ang家族的共同受体,其基因位于染色体1p33-1p34部位,蛋白表达主要位于上皮细胞。Ang-1与其受体Tie2结合并活化后可促使大量血管平滑肌细胞及周细胞趋化、聚集,进而包围内皮细胞形成完整的血管壁,生成新生血管[12-17]。为此,笔者于本研究中观察了脉管Ⅱ号胶囊对HUVECs内Ang-1及Tie2表达的影响,以探索其促进血管生成的可能机制。结果显示,与空白组对比,空载组HUVECs的相对增殖率及Ang-1、Tie2表达水平均无明显变化(P均>0.05);高剂量组和低剂量组HUVECs的相对增殖率及Ang-1、Tie2表达水平均显著增加(P均<0.05),且高剂量组显著高于低剂量组(P均<0.05);高剂量+Ang-1干扰组和低剂量+Ang-1干扰组HUVECs的相对增殖率及Ang-1、Tie2表达水平均显著降低(P均<0.05),且低剂量+Ang-1干扰组显著低于高剂量+Ang-1干扰组(P均<0.05)。空白组、空载组、高剂量组和低剂量组细胞均维持原有形态,细胞凋亡和细胞形态变化较少;高剂量+Ang-1干扰组和低剂量+Ang-1干扰组细胞凋亡增加,且以低剂量+Ang-1干扰组细胞凋亡数量较大。可见,脉管Ⅱ号胶囊可明显促进Ang-1/Tie2信号通路的表达,进而促进血管生成,且高剂量较低剂量的作用显著;干扰Ang-1可抑制血管生成,且脉管Ⅱ号胶囊可对抗干扰Ang-1对血管生成的抑制作用。
综上所述,调节Ang-1/Tie2信号通路的表达可能是脉管Ⅱ号胶囊促进血管生成的作用机制,有待进一步深入研究证实。
