舟山近海水样环境DNA获取方法的建立
2020-03-04源利文邬倩倩高天翔
陈 治 宋 娜 源利文 邬倩倩 高天翔
(1. 海南热带海洋学院水产与生命学院, 三亚 572022; 2. 中国海洋大学水产学院, 青岛 266003; 3. 神户大学人间发达环境学研究科, 神户 657-8501; 4. 浙江海洋大学水产学院, 舟山 316022)
环境DNA(Environmental DNA, eDNA)是指动物、植物、微生物等释放于空气、土壤、水体等环境中的DNA总称[1]。eDNA分析方法首先被应用于微生物(Micro-organisms)群落的研究[1], 2008年开始拓展到水生大生物(Macro-organisms)研究领域[1]。eDNA获取是eDNA分析的基础, 此步骤包括水样采集、eDNA保存、eDNA提取三个环节[1]。关于常规水样的eDNA获取方法, 目前已有诸多研究报道[2—5]。高浊度水样的eDNA获取方法, 国内外主要集中在微生物领域[6—8], 大生物领域的研究则较少。高浊度水样大生物eDNA获取具有以下两个方面突出问题: (1)水体环境一般不适合大生物的生存[9,10]——与微生物相比, 大生物的eDNA含量极低; (2)泥沙等杂质对eDNA获取具有较强的干扰作用[11—14], 会增大eDNA获取的难度。因此亟需建立和优化高浊度水样的eDNA获取方法。
此外, 关于已有的水样eDNA获取方法, 目前仍无统一观点。对于水样采集, Dejean等[12]、Ficetola等[15]、Foote等[16]、Thomsen等[17,18]研究认为乙醇沉淀法的eDNA产量最高; Minamoto等[3]、Olson等[19]、Takahara等[20,21]、Fukumoto等[22]则认为使用0.2 μm的混合纤维素滤膜和0.7 μm的玻璃纤维滤膜抽滤效果优于乙醇沉淀法; Deiner等[4]进行了乙醇沉淀法与滤膜抽滤法比较, 结果却显示二者效果相同。对于eDNA获取的第二个环节——eDNA的保存亦存在诸多争议。Lever等[6]、Pilliod等[14]、Strickler等[23]、Takahara等[20]在研究过程中将滤膜置于-20℃冷冻保存。Minamoto等[3]用15 mL酒精对抽滤后的滤膜进行脱水保存, 发现室温下eDNA至少在6d内不存在显著降解, 而冻融反而影响eDNA产量。与上述两种观点不同, Pilliod等[14]、Strickler等[23]、Takahara等[21]对冷冻保存1—2d后的水样进行抽滤, 发现eDNA产量与现场抽滤的效果一致。除上述两个环节外, 对于eDNA获取的第三个环节(eDNA提取), 主流的观点认为DNeasy Blood and Tissue Kit的提取效果最佳, 故该试剂盒目前被广泛应用于eDNA研究。但Deiner等[4]、Senapati等[24]却认为使用标准的苯酚-氯仿-异戊醇提取方法结果显著优于MoBio PowerWater DNA Isolation Kit和DNeasy Blood and Tissue Kit试剂盒。此观点又与Eichmiller等[25]、Yamanaka等[26]、Miya等[27]的结论冲突。综上所述, eDNA获取的最优方法, 可能与研究的对象、水域、目的密切相关。因此有必要在空白研究水域对已有的eDNA获取方法进行验证优化。
舟山渔场是我国最大的近海渔场, 位处长江、钱塘江、甬江等河流的入海交汇区, 东部受台湾暖流的影响, 西部主要受由三江等大陆径流形成的沿岸水影响, 北部还有黄海冷水团的季节性分布, 具有独特的高浊度水文环境[28—31]。迄今为止, 尚无该区域及类似水域大生物eDNA获取的相关研究。徐念等[32]虽对长江中下游干流eDNA样本进行了鱼类多样性初步研究, 但研究中并未进行高浊度eDNA获取方法的优化工作。为提高后续eDNA分析结果的可靠性, 亟待在舟山近海建立和优化eDNA获取方法。曼氏无针乌贼(Sepiella japonica)曾与大黄鱼、小黄鱼、带鱼并称为我国东海四大海产, 近年来其资源衰退严重[33]。2000年以来, 浙江省积极采取人工繁殖苗种和放流相结合的增殖养护措施。仅2013—2016年在浙江北部的累计增殖放流受精卵就达7835×104粒。目前, 浙江近海曼氏无针乌贼数量呈明显增长趋势[33]。本研究以曼氏无针乌贼为eDNA定量检测对象, 以方便后期开展追踪调查及增殖放流效果评价工作。
1 材料与方法
1.1 物种选取与探针设计
根据曼氏无针乌贼、金乌贼(Sepia esculenta)、长蛸(Octopus variabilis)等14种舟山近海常见头足类序列, 使用Primer Express 3.0.1及Primer Premier 6设计了曼氏无针乌贼COⅠ基因特异性引物、探针。所得引物、探针序列为: L-2317: 5′-CAC CAGACATAGCCTTCC-3′; Pro-H-2432: HEXTGTTCATCCAGTTCCAGCACCT-TAMRA; H-2471: 5′-GCCAGCATGAGATAGATTAC-3′(引物、探针已申请发明专利)。
1.2 水样采集及eDNA提取
于2017年4月1日至2017年6月14日, 采集浙江省舟山市海洋科学城(29°58′40.81″ N, 122°12′57.47″ E)和西闪岛曼氏无针乌贼繁育中心(29°54′4.08″ N,122°19′45.10″ E)附近海域水样。每一组实验处理取3个平行样, 同时取灭菌后的去离子水为阴性对照。考虑到eDNA获取从水样采集到eDNA保存、eDNA提取包含众多小环节, 单个水样即使只抽滤200 mL所需时间也在30min左右, 因此实验过程中采用逐步优化的方法, 减少不同小环节间的交叉组合。本研究共进行了水样采集、eDNA提取2个大环节(分7个小环节)方面的优化。
水样采集方法的优化对于乙醇沉淀法, 分别采集15 mL、240 mL水样。采集方式及后续DNA提取方法参照Minamoto等[3]、Goldberg等[34]、Jerde等[35,36]水样处理方法。但因泥沙含量较高, 对原方法进行了2处改动: (1)样品4℃下10000×g离心1h去掉上清液, 将原来200 μL一次润洗改为200 μL三次润洗(共600 μL), 将沉淀物转移到2 mL离心管中; (2)消化结束取上清液到2 mL离心管后, 两次用200 μL TE buffer (或400 μL超纯水)润洗剩余沉淀并转移上清液。
对于滤膜抽滤法, 处理过程为: (1)用直径47 mm、孔径0.45 μm的WCN硝酸纤维滤膜滤膜分别抽滤15和120 mL海水及对应阴性对照。(2)用蒸馏水润洗抽滤装置, 去除残留的eDNA。抽滤剩余水样及阴性对照。抽滤时间约45min (乙醇沉淀法10000×g离心1h结束时, 则停止抽滤), 记录抽滤体积。(3)之后按照乙醇沉淀法中的提取步骤进行eDNA提取。
滤网孔径对去除水样中大颗粒杂质的影响(1)取4个体积为1.5 L的塑料杯。其中3个塑料杯用网目尺寸分别为10、20和30 μm的Spectra Mesh尼龙网罩在塑料杯口上, 用50 mL的注射器缓慢吸取水样加注到尼龙网上。用于除去水样中粒径较大的杂质。水样经过尼龙网过滤后滴入1.5 L塑料杯中。最后1个塑料杯无尼龙网过滤。(2)每个塑料杯抽滤3×200 mL水样及阴性对照。(3)按前文中提取滤膜eDNA方法进行DNA提取。
滤膜孔径对eDNA采集的影响(1)用直径为47 mm, 孔径为0.22、0.45和0.70 μm的硝酸纤维滤膜分别抽滤3×50、3×150和3×300 mL的水样, 并设置阴性对照。记录抽滤所需时间。(2)按前文中提取滤膜eDNA方法进行DNA提取。
静置时间对eDNA采集的影响取12个体积为1.5 L的塑料瓶。(1)分别在分装结束的0、20min、40min及60min后抽滤水样, 抽滤时间为5min。抽滤时用量程为50 mL的注射器(精确度到5 mL)从表层吸取水样注入抽滤漏斗上。记录5min抽滤的水样体积, 并设置阴性对照。(2)滤膜规格及eDNA提取方法参考前文。
阳离子表面活性剂(Cationic surfactanton)对eDNA采集的影响: 将水样分装到2个体积为1.5 L的塑料瓶中。a塑料瓶的水样不做处理, b塑料瓶的水样按1:1000的比例加入浓度为10%的苯扎氯铵(Benzalkonium chloride)试剂[37]。使b塑料瓶中苯扎氯铵的终止浓度为0.01%。在水样分装结束后, 分别对a、b两组抽取3×300 mL水样, 并设置阴性对照。滤膜规格及eDNA提取方法参考前文。
eDNA提取方法的优化碎膜消化法与去膜消化法比较 抽滤12个体积为150 mL水样及阴性对照。前3个滤膜采用碎膜法提取eDNA(a组), 具体提取方法参考前文。后9个滤膜采用去膜法提DNA,具体的去膜操作如下: (1)取Salivette唾液收集管, 去除离心柱上的唾液收集绵。(2)用镊子将滤膜轻卷成长条状, 放入Salivette唾液收集管的离心柱中。(3)1000×g分别离心1min (b—1组)、5min (b—2组)、10min (b—3组)。(4)将Salivette唾液收集管收集的混合物用200 μL超纯水润洗并倒入2 mL离心管中。(5)再次用200 μL超纯水润洗混合物并倒入离心管中。之后的操作步骤与碎膜法相同。
酚抽除沙法对eDNA提取的影响取6个体积为150 mL的水样。前3个滤膜采用去膜法提取eDNA(a组, 具体操作参考前文), 后3个滤膜采用酚抽法提DNA。具体的改动如下: 去膜操作使Salivette唾液收集管底部含有eDNA及泥沙杂质的混合物后, 用400 μL STE裂解液润洗混合物两次并倒入2 mL离心管中(共800 μL)。之后按照标准的苯酚-氯仿-异戊醇法提取eDNA。最后一步加入600 μL酒精后用参考DNeasy Blood and Tissue Kit试剂盒提取说明书进行后续eDNA提取。使用酶标仪进行A260/A230、A260/A280测定。
1.3 数字定量PCR(digital PCR, dPCR)扩增
由于模板中的抑制剂使荧光定量PCR(qPCR)扩增效果不理想, 本实验统一使用数字定量PCR(Digital PCR, dPCR)进行eDNA定量检测。dPCR体系和步骤见表1。将反应混合液加入电子芯片后进行油封并压紧, 随后放入QuanStudio 3D Digital PCR反应箱进行PCR扩增。反应结束后读取eDNA浓度(copies/μL)。
1.4 数据分析
使用SPSS 18.0软件对不同实验组间的分子拷贝数进行单因子方差分析(One-way ANOVA)。差异显著系数为P<0.05。
2 结果
2.1 滤膜抽滤法与乙醇沉淀法比较
同体积水样使用乙醇沉淀法获得的eDNA产量高于滤膜抽滤法(表2、图1)。两种方法在15和120 mL实验组上均存在极显著差异(P<0.01)。120 mL乙醇沉淀法的eDNA产量与350 mL滤膜抽滤法的eDNA产量相当(F=0.33,P=0.60)。15和120 mL水样用乙醇沉淀法获得的eDNA产量是滤膜抽滤法的1.76—2.53倍。增大采样体积会显著提高eDNA产量。同一采样方法下15、120和350 mL任意两组间P<0.01。同时, 检测结果的变异系数(Coefficient of variation,CV)(SD/AVE×100%)随采样量的增大而减小。这说明在采样量较低时, 基于eDNA浓度对物种相对生物量的判定结果误差会较大。配套设备的限制, 严重影响乙醇沉淀法的应用。目前很少有实验室配置4×400 mL以上规格的离心机。但滤膜抽滤法在45min则可采集350 mL以上的水样。滤膜抽滤法在水样抽滤体积上的优势,消除了其自身eDNA采集效率低于乙醇沉淀法的劣势。
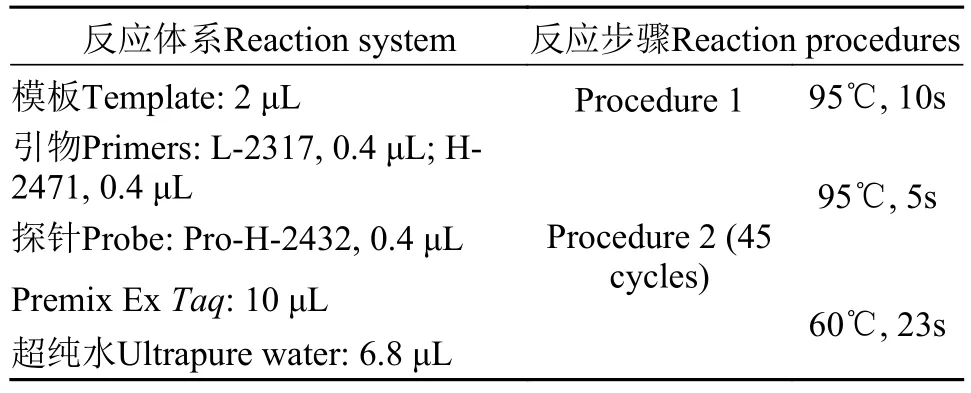
表1 数字定量PCR反应体系及反应步骤Tab. 1 System and procedure of digital PCR reaction

表2 乙醇沉淀法与滤膜抽滤法eDNA产量(均值±标准差)Tab. 2 The yield of eDNA by ethanol precipitation and filtering(AVE±SD)
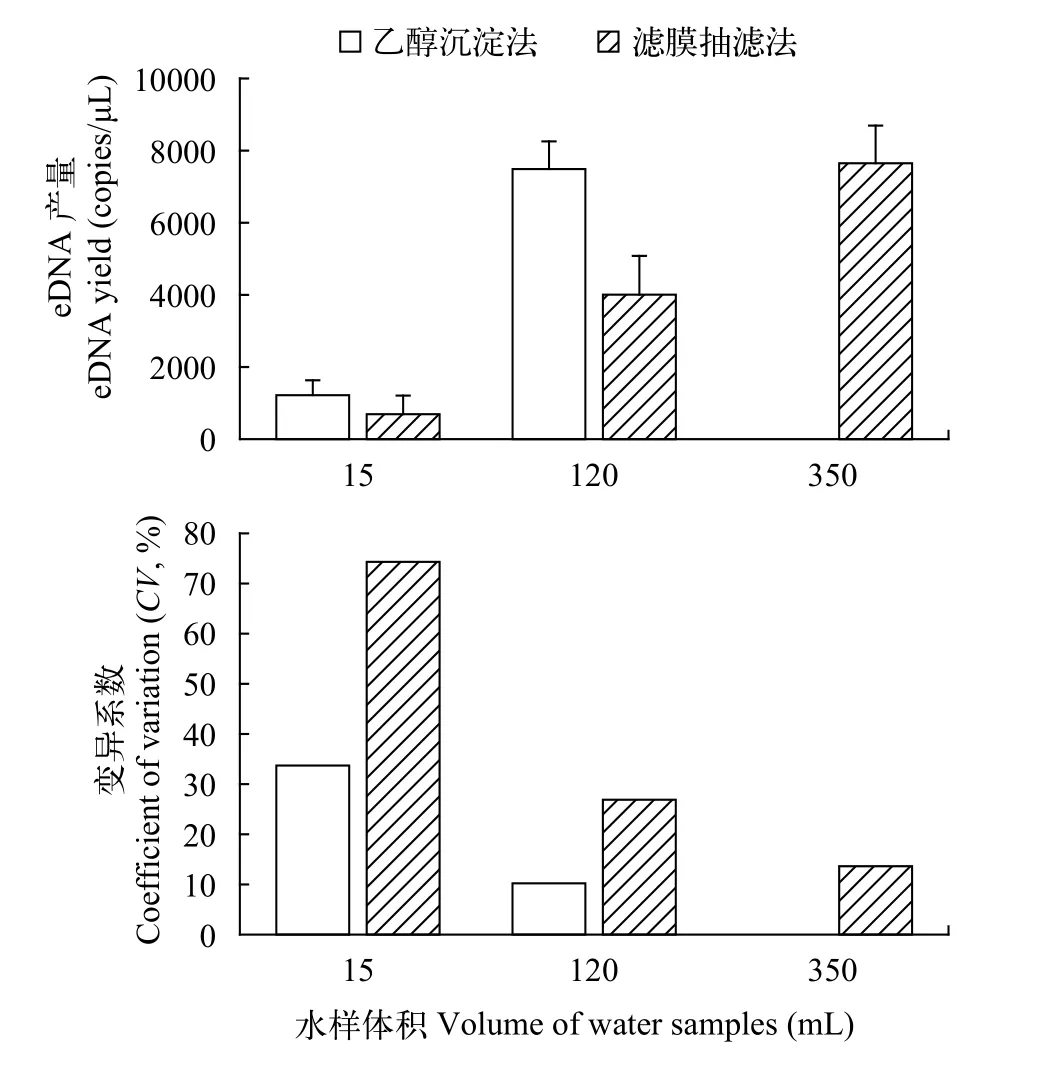
图1 乙醇沉淀法与滤膜抽滤法结果比较Fig. 1 The comparison between ethanol precipitation and filtering
2.2 滤网孔径对去除水样中大颗粒杂质的影响
200 mL水样抽滤时间在12.1—12.5min。无滤网组和有滤网组(10、20和30 μm)所需要的抽滤时间基本一致。单因子方差分析(one-way ANOVA)显示各组之间在抽滤时间上不存在显著差异(F=1.06,P=0.45)。200 mL水样曼氏无针乌贼eDNA浓度在5457—5560 copies/μL之间, 4个组间亦不存在显著差异(F=0.28,P=0.84)。10、20和30 μm滤网对泥沙等大颗粒杂质无过滤作用, 添加滤网并不能增加水样抽滤体积和提高eDNA产量(图2)。
2.3 滤膜孔径对eDNA采集的影响
三种滤膜在抽滤50 mL水样时, 在抽滤时间上存在极显著差别(F=43.35,P=0.0003); 但抽滤150及300 mL水样时, 在抽滤时间上却不存在显著差异。孔径0.22、0.45和0.70 μm的三种滤膜的eDNA产量在50及150 mL两组上分别存在极显著及显著差异(F=33.09,P=0.0006;F=5.51,P=0.044), 但在300 mL组上无差异(F=1.72,P=0.257)。小体积水样采集时, 滤膜孔径的大小对eDNA产量有很大影响, 此时应选择孔径较小的滤膜进行抽滤; 大体积水样采集时, 滤膜孔径的大小对eDNA产量无影响(表3、图3)。
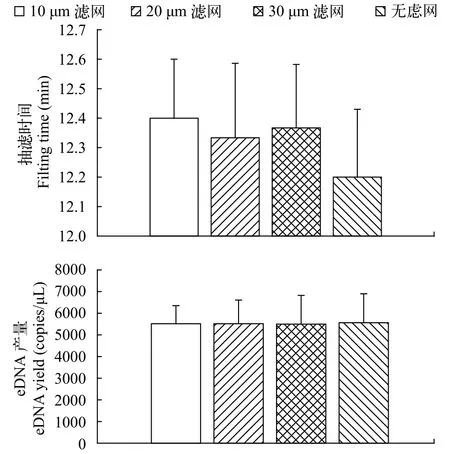
图2 不同孔径的滤网效果比较Fig. 2 The comparison of filter screens with different apertures
2.4 静置时间对eDNA产量的影响
随着静置时间的增加, 固定时间内(5min)抽滤的水样体积会逐步增加。静置60min后抽滤的体积约是初始组抽滤体积的1.7—1.8倍。单因子方差分析显示随着静置时间的增加, 抽滤体积上存在极显著差异(F=72.03,P<0.01)。ANOVA分析结果显示,不同静置时间的样品在eDNA浓度上不存在显著差异(F=3.92,P=0.0544)。静置虽然能增大单位时间内的抽滤体积, 但并不能提高eDNA产量。随着静置时间的增加, eDNA浓度的变异系数(标准差/均值×100%)有变大的趋势, 已经接近显著差异(F=3.37,P=0.052)。静置处理有可能会增大eDNA结果的波动性, 使生物量评估结果误差较大(表4、图4)。
2.5 阳离子表面活性剂对eDNA采集的影响
a、b两组300 mL水样中曼氏无针乌贼eDNA浓度(均值±标准差)分别为(213±37)和(275±48) copies/μL。b组(苯扎氯铵组)eDNA产量约是a组(无苯扎氯铵组)的1.29倍。ANOVA结果显示a、b两组间存在极显著差异(F=30.40,P=0.0052)。阳离子表面活性剂对eDNA降解有明显的抑制作用(图5)。
2.6 碎膜消化法与去膜消化法比较
去膜法效果优于碎膜法(图6)。碎膜法(a组)与去膜法(b-1组、b-2组和b-3组)的eDNA产量(均值±标准差)分别为: (1290±273)、(1258±177)、(1494±244)和(1941±241) copies/μL。One-way ANOVA结果显示: 四组间差异极显著(F=60.90,P=0.0009)。离心时间对去膜法eDNA产量有显著影响。1min的离心处理效果与碎膜法结果无区别(a组与b-1组:F=8.45,P=0.1008)。随着离心时间的增大, b-2组与b-3组的eDNA产量显著增大, 与b-1组存在显著差异(F=51.58,P=0.0048)。使用去膜法进行eDNA处理时, 应增加离心时间, 使滤膜上的eDNA充分下沉到混合物中。

表3 用三种不同孔径的滤膜抽滤不同体积的水样所需的时间及eDNA产量(均值±标准差)Tab. 3 Time and the yield of eDNA of 3 different filter membrane filting different volume waters (AVE±SD)
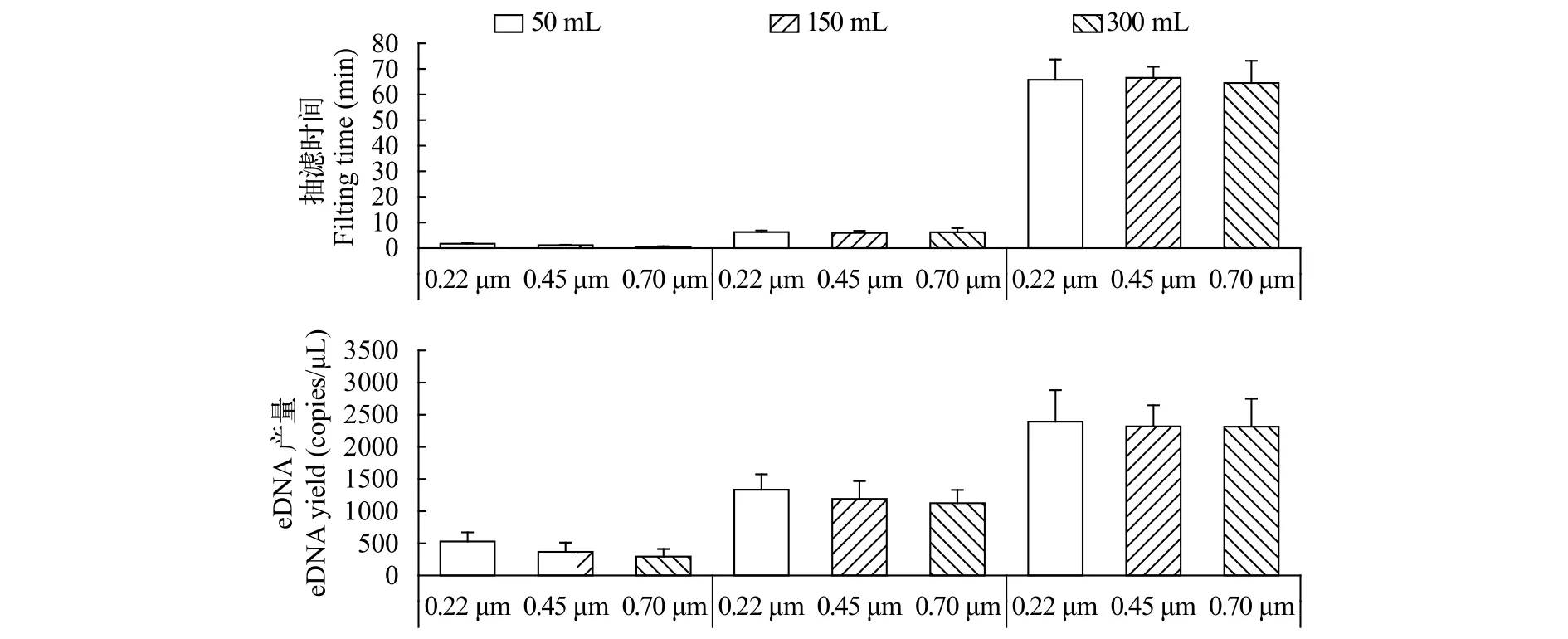
图3 不同孔径的滤膜效果比较Fig. 3 The comparison of filters with different apertures
表4 五分钟内抽滤的水样体积及eDNA浓度(均值±标准差)Tab. 4 Water volume and eDNA yield within 5 minutes (AVE±SD)

图4 静置时间对eDNA获取的影响Fig. 4 The effect of standing time on eDNA yield
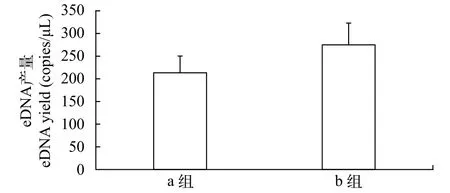
图5 阳离子表面活性剂对eDNA获取的影响(a组: 无苯扎氯铵组; b组: 有苯扎氯铵组)Fig. 5 The effect of cationic surfactanton on eDNA yield(a.without benzalkonium chloride; b. with benzalkonium chloride)
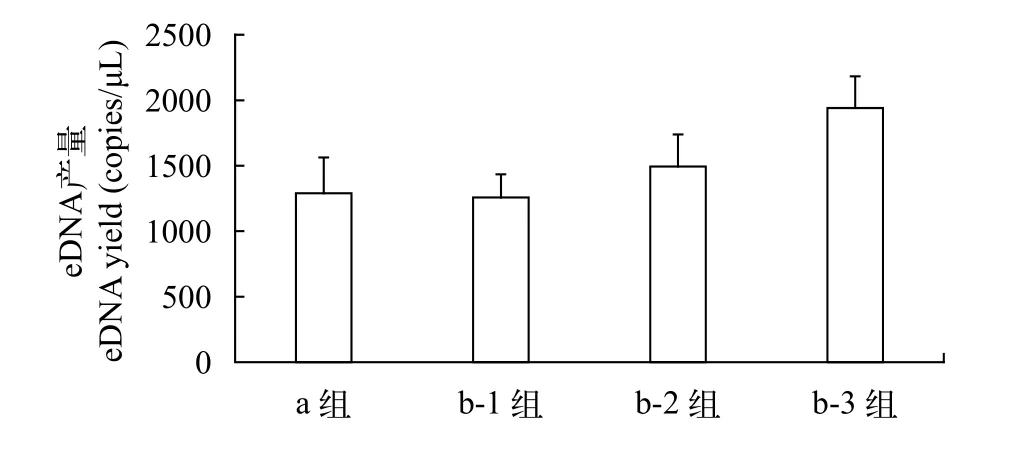
图6 碎膜消化法与去膜消化法比较Fig. 6 The comparison between membrane removal treatment and fragmentation treatment
2.7 酚抽除沙法对eDNA提取的影响
去膜法(a组)与酚抽法(b组)两种方法得到的eDNA产量分别为(2023±454)和(1991±349) copies/μL。One-way ANOVA分析显示: a、b两组在eDNA产量上不存在显著差别(F=0.07,P=0.81)。在产物纯度上, 酚抽法优于去膜法(A260/A230:F=96.98,P=0.0006;A260/A280:F=59.71,P=0.0015)。酚抽法虽然不能提高eDNA产量, 但能显著提高产物纯度。建议使用酚抽法进行eDNA提取(表5、图7)。
3 讨论
3.1 泥沙是影响舟山近海eDNA获取的关键因素
泥沙不仅直接造成抽滤体积的锐减和抽滤时间的激增, 还通过增大滤膜折叠处理后的缝隙、渗涸裂解液有效体积、阻碍消化摇匀、堵塞试剂盒离心柱等环节影响后续所有操作。本实验中, 水样的极限抽滤(滤膜彻底堵塞)体积很难超过500 mL。而常规水样, 一般能达到1—2 L[37—39]。抽滤300 mL—1 L常规水样所需时间为10min左右[2—8,40], 但本实验抽滤300 mL水样需要30min以上。泥沙对试剂盒离心柱的堵塞作用会直接导致eDNA提取中断。
水体中的泥沙等悬浮物粒径一般在10 μm以上, 而游离的eDNA分子粒径一般在10 μm以下[3,5,41];在进行水样抽滤之前通常用10—20 μm孔径的滤网对水样中的杂质进行过滤[42], 可能由于舟山近海高浊度水样泥沙含量过高同时泥沙粒径范围很大,10、20和30 μm的滤网对舟山近海水样无除杂作用。舟山近海高浊度水样经过处理后得到的eDNA模板溶液常呈淡红色; 即使模板中的eDNA浓度在102copies/μL以上, 荧光定量PCR结果也经常呈阴性或荧光曲线明显波动。eDNA模板中有大量杂质和PCR抑制剂影响模板颜色和qPCR定量检测结果。故本研究使用高灵敏度、高耐受性的数字PCR进行定量检测[41]。

表5 去膜法(a组)与酚抽法(b组)两种方法所得的产物纯度(均值±标准差)Tab. 5 Purity comparison between membrane-removed treatment and phenol-chloroform treatment (AVE±SD)

图7 去膜法(a组)与酚抽法(b组)两种方法结果比较Fig. 7 The comparison between membrane removal treatment and phenol treatment
有研究认为, 滤膜孔径越小, eDNA产量就越高[3]。本研究得出的结论与之不同[3]。在大体积水样抽滤时, 各种孔径的滤膜(0.22、0.45和0.70 μm)在抽滤时间和eDNA产出上无区别。这可能是因为本研究为高浊度水样, 水样抽滤时滤孔易被堵塞。静置可能会造成水样中的泥沙和eDNA同步下沉, 对eDNA产量的提高无作用。
总之, 在eDNA提取环节中, 除沙效果最有效的途径是采用传统的苯酚-氯仿-异戊醇法, 利用离心力的不同隔离掉泥沙。酚抽除沙增加了eDNA提取环节, 造成DNA损失。它虽然不能提高eDNA产量,却能显著提高后续eDNA提取步骤的流畅度和最终产物的纯度, 进而增加定量PCR的可靠性。
3.2 eDNA获取的重要原则
实验结果表明: 采样量增大导致eDNA浓度显著增大, 而检测结果的变异系数随之减小。采样量较低时, 基于eDNA浓度对物种相对生物量的判定结果误差会很大。在野外水体中, 某一物种的eDNA浓度往往很低[41], 为了得到相对稳定的结果及增加物种的检出率, 水样采集过程应尽可能增大采样体积——“量大从优”原则。eDNA水样采集量一般为15 mL—2 L[1—8,32,42], 综合本研究水量要求、抽滤极值、抽滤时间、eDNA降解速率等因素, 舟山近海高浊度水样采集量以300 mL为佳。eDNA获取的第二个重要原则是及早处理。随着放置时间的加长, eDNA的含量越来越少[3]。水体中的eDNA室温下6h内约降解60%[37]。本研究推荐在调查行程中(如出海作业途中)即进行现场抽滤, 抽滤后的滤膜及提取后的eDNA也应尽快处理。由于舟山近海高浊度水样抽滤困难, 抽滤体积的增大直接导致抽滤时间和eDNA降解量的增加, 因此水样采集后应先加入终止浓度为0.01%的苯扎氯铵(Benzalkonium chloride)试剂[37]。
3.3 eDNA获取方法的标准化
水环境自身的复杂性给eDNA获取方法的标准化造成了很大困难。以抽滤体积为例, 为了增大物种的检出率和结果的稳定性, 原则上要“大体积抽滤”; 为了对不同时间、不同站点、不同断面的结果进行比较, 又需要进行“等量抽滤”[20,21,36,39]。本研究发现, 同一采样点在不同采样时间内(6h—2d)很难同时满足“大体积”及“等量”两大要求。水样之间的最大抽滤值有时差异悬殊, 抽滤时间也差别明显。某一地点的水质组成(特别是泥沙含量)在短时间内的变化可能是很大的, 这给不同海区、不同调查航次之间的eDNA数据比较造成了困难。实际应用过程中, 对常规水样可通过预实验设置一个各站点都普遍能达到的、统一的大体积抽滤值。但对高浊度水样,“统一抽滤值”由于数值较低, 往往不容易得到高产量eDNA。后续应分多张滤膜抽滤,对单张滤膜设置固定抽滤值(如100 mL), 最后用去膜法对全部滤膜进行eDNA提取, 以达到增加eDNA产量和体积标准化的目的。
同时, 水样间的差异也造成了提取环节标准化的困难。DNeasy Blood 和 Tissue Kit已经广泛利用于常规水样eDNA提取[25—27]。本实验中尝试用该试剂盒对舟山近海高浊度水样进行eDNA提取。泥沙很容易吸收掉孵化所需的裂解液, 并影响下一步摇匀。研究表明蛋白酶K的量对eDNA产量也有显著影响[2]。根据样品情况增加蛋白酶K、STE或AL buffer的用量或许能进一步提高eDNA提取的效果。但增大试剂用量又会导致混合液在后续操作步骤中溢出离心管。实验中用10 μL蛋白酶K及400 μL STE裂解液或AL buffer进行消化, STE或AL buffer的量在对泥沙含量较低的样品处理时是过量的,对个别泥沙含量极高的样品又是不够的。本研究建议统一使用700—800 mL混合液对样品进行消化处理, 并将苯酚除沙操作后的上清液体积控制在500—600 mL, 之后使用2 mL离心管取代1.5 mL离心管进行eDNA提取后续操作。
