消癌解毒方黄酮类成分及其给药后在大鼠体内分布△
2020-03-04钱桂英闫秋莹蒋家璐范汇森谭佳妮程海波孙东东
钱桂英,闫秋莹,蒋家璐,范汇森,谭佳妮,程海波,孙东东*
1.南京中医药大学 常熟附属医院,江苏 苏州 215500;2.国家中医药管理局 名医验方评价与转化重点研究室/江苏省抗肿瘤验方研究与产业化工程实验室/江苏省中医药防治肿瘤协同创新中心/南京中医药大学 转化医学研究中心,江苏 南京 210023;3.南京中医药大学 药学院,江苏 南京 210023
消癌解毒方是在传承发展国医大师周仲瑛“癌毒”学术思想基础上,基于癌毒病机理论,针对癌毒病机演变规律形成的抗肿瘤临床有效系列验方。全方攻补兼施,结合不同恶性肿瘤的主要病理因素及具体癌毒的类型,其组成各有区别,临证可根据不同病位相应选择不同的方药,以取得更好的疗效[1-3]。本实验所用方剂由半枝莲、预知子、山慈菇、莪术、太子参和麦冬组成,临床上主要用于胃癌治疗。方中半枝莲为君药,具有清热解毒、消肿散结的功效,在临床治疗中与其他药联合使用,发挥增效减毒作用[4]。
据文献报道,天然黄酮类化合物具有广泛的抗肿瘤活性[5],是抗癌方剂中的重要活性成分。而本方中半枝莲、麦冬等也含有多种黄酮类成分,这些成分在消癌解毒方配伍煎煮前后是否发生变化,是否到达机体器官以及如何在体内发生吸收、分布、转移等尚不十分明确,阐释这些问题对于揭示复方的物质基础和作用机制具有重要意义。本实验建立超高效液相色谱-串联四极杆飞行时间质谱法(UPLC-Q-TOF-MS)检测消癌解毒方水提液中黄酮类成分的方法,同时研究大鼠灌胃给予消癌解毒方水提液后黄酮类成分在体内的分布情况,为进一步阐释消癌解毒方中特征化学成分及其在体内的变化分布规律提供参考。
1 材料
1.1 实验动物
SPF级雄性SD大鼠,体质量(200±20) g,购于南通大学实验动物中心,实验动物生产许可证号:SCXK(苏)2014-0001,实验动物使用许可证号:SYXK(苏)2012-0031。
1.2 试药
半枝莲(批号:170501,产地:湖北)、预知子(批号:170505,产地:河北)、山慈菇(批号:170105,产地:贵州)、莪术(批号:170310,产地:广西)、太子参(批号:170425,产地:河北)、麦冬(批号:170115,产地:四川)均购于湖北聚瑞中药饮片有限公司,经南京中医药大学陈建伟教授鉴定分别为唇形科植物半枝莲ScutellariabarbataD.Don的干燥全草、木通科植物木通Akebiaquinata(Thunb.) Decne.的干燥近成熟果实、兰科植物杜鹃兰Gremastraappendiculata(D.Don) Makino的干燥假鳞茎、姜科植物蓬莪术CurcumaphaeocaulisVal.的干燥根茎、石竹科植物孩儿参Pseudostellariaheterophylla(Miq.)Pax ex Pax et Hoffm.的干燥块根及百合科植物麦冬Ophiopogonjaponicus(L.f) Ker-Gawl.的干燥块根;甲醇、乙腈均为质谱纯,购自美国默克公司;甲酸为质谱纯,购自CNW公司。
1.3 仪器
CPA225D型电子天平(赛多利斯科学仪器北京有限公司);SPE固相萃取小柱(德国CNW公司);LC-30A型超高效液相色谱系统,配有LC-30AD型二元液相泵、SIL-30AC型自动进样装置、DGU-20A5R型在线脱气装置、CTO-30A型柱温箱(日本Shimadzu公司);Triple TOF 5600型高分辨质谱系统,包含电喷雾离子源(ESI)、Analyst TF 1.6及Peak View等质谱分析软件(美国AB Sciex公司);KH-500DV型数控超声波清洗器(昆山禾创超声仪器有限公司);CentriVap型离心浓缩仪(美国Labconc公司);超纯水系统(美国Millipore公司)。
2 方法
2.1 水煎液供试品制备
按消癌解毒方组方配比,称取半枝莲5 g、预知子2.25 g、山慈菇2.25 g、莪术2.25 g、太子参3.75 g、麦冬2.5 g,合并后依次加入10、8倍量水,煎煮2、1.5 h,合并2次滤液并浓缩至质量浓度为1 g·mL-1(以生药量计)供化学成分分析使用,浓缩至质量浓度为2.88 g·mL-1(以生药量计)供大鼠灌胃给药使用。
量取1 mL浓缩液加入SPE固相萃取小柱,分别采用体积分数为20%、40%、60%、80%、100%的乙腈水溶液作为流动相进行洗脱,完整收集不同浓度下的滤液,涡旋混匀,12 000 r·min-1离心5 min(离心半径7 cm),离心2次,取上清液即得供试品溶液。
2.2 动物分组与给药
12只雄性SD大鼠,适应性饲养1周,自由饮食,室温18~26 ℃,湿度40%~60%,正常昼夜交替。将大鼠随机分为2组,分别为对照组和给药组,每组6只,分别饲养于代谢笼中,实验前12 h禁食,自由饮水。根据临床人用剂量进行换算后,给药组大鼠灌胃给予2.1项下制备的消癌解毒方水提液15.12 g·kg-1,对照组大鼠给予等体积0.9%氯化钠溶液,每天给药1次,连续给药3 d。
2.3 样品采集与处理
2.3.1尿液、粪便、血浆样品的收集与处理 第1次和第2次给药后,分别收集给药组和对照组大鼠0~24 h尿液和粪便样本。尿液样本使用离心浓缩仪进行浓缩干燥,粪便样本使用恒温干燥箱40 ℃进行干燥。两者分别加入适量甲醇,超声提取30 min,尿液和粪便样品分别进行2次、3次离心,5000 r·min-1离心15 min(离心半径7 cm),取上清,离心浓缩干燥。末次给药后,分别于0.5、1.0、1.5 h眼眶取血,血液样本5000 r·min-1、4 ℃离心10 min(离心半径7 cm),获得血浆样本。取适量血浆样本中加入4倍量体积甲醇,超声提取30 min,提取物5000 r·min-1离心15 min(离心半径7 cm),取上清,离心,浓缩干燥。
样品均用甲醇复溶,13 000 r·min-1离心10 min(离心半径7 cm),离心2次,取上清进样。
2.3.2组织样品的收集与处理 在收集完血液样本之后,使用心脏灌注器快速清除组织中的血液,收集心、肝、脾、肺、肾、脑、胃、小肠。称取适量组织样本,加入4倍量预冷0.9%氯化钠溶液进行匀浆。每种组织样本取6 mL匀浆液,加入8倍量甲醇,超声提取30 min,5000 r·min-1、4 ℃离心10 min(离心半径7 cm),取上清,离心浓缩干燥。取干燥组织样本复溶于1 mL甲醇,13 000 r·min-1离心10 min(离心半径7 cm),离心2次,取上清进样检测。
2.4 检测条件
2.4.1水煎液检测色谱条件 Agilent C18(100 mm×2.1 mm,1.8 μm)反相色谱柱,流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱(0~0.01 min,5%B;0.01~0.5 min,5%~10%B;0.5~20 min,10%~32%B;20~25 min,32%~70%B;25~27 min,70%~100%B;27~28 min,100%B;28~30 min,100%~5%B;30~31 min,5%B)。柱温40 ℃,流速0.3 mL·min-1,进样量5 μL。
2.4.2生物样品检测色谱条件 Agilent C18(100 mm×2.1 mm,1.8 μm)反相色谱柱,流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱(0~0.01 min,5%B;0.01~2 min,5%~50%B;2~8 min,50%~54%B;8~10 min,54%~90%B;10~13 min,90%~100%B;13~14 min,100%B;14~17 min,100%~5%B;17~18 min,5%B)。柱温40 ℃,流速0.3 mL·min-1,进样量5 μL。
2.4.3质谱条件 采用ESI,正、负离子模式下采集数据;多反应监测模式(MRM);离子喷雾电压(ISVF)为4 500.00 V(正离子模式)/-4 500.00 V(负离子模式);去簇电压(DP)为60.00 V(正离子模式)/-60.00 V(负离子模式);雾化气(GS1)压力为378.95 kPa;辅助气(GS2)压力为378.95 kPa;气帘气(CUR)压力为378.95 kPa;去溶剂温度(TEM)550.00 ℃;碰撞能量扩展(CES)为10.00 eV。
2.5 数据处理
根据文献和数据库搜集半枝莲中黄酮类成分,从Chemical book寻找目标化合物结构,利用Peak view质谱分析软件寻找目标化合物,参考文献并根据二级碎片和结构的匹配度进行确证。
3 结果
3.1 化学成分分析
消癌解毒方水提液样品在正、负离子模式下的基峰总离子流图(见图1)显示,多种化合物被检测出,并且分离状况良好。综合保留时间(tR)、质谱特征碎片和裂解途径等信息,共鉴定出23个黄酮类化合物,其中正黄酮类化合物13个(峰3~5、7、8、10~12、15~19)、二氢黄酮类化合物5个(峰2、6、9、13、14)、黄酮醇类化合物1个(峰1)、高异黄酮类化合物4个(峰20~23),具体信息见表1。
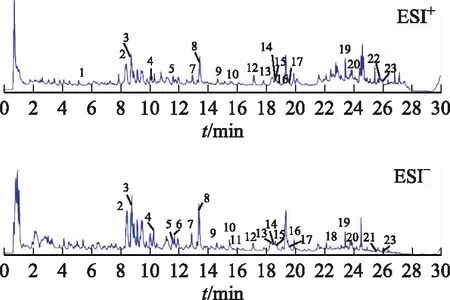
图1 消癌解毒方水提液正、负离子模式下总离子流图

表1 LC-MS/MS正、负离子模式下消癌解毒方水煎液中化学成分鉴定

续表1
黄酮类化合物主要是指由2苯环(A环与B环)通过中间三碳链连接而成的化合物,黄酮的质谱裂解特征主要是C环断裂,得到含有完整A环和B环的离子碎片,裂解方式见图2。高异黄酮与其他黄酮结构稍有不同,高异黄酮C环与B环连接处多1个亚甲基,该结构会使其在质谱条件下亚甲基处首先发生断裂,随后A环发生断裂。黄酮苷类化合物糖苷键较易先断裂,之后再发生黄酮母核的断裂。此外,黄酮类化合物的取代基多为羟基、甲基、甲氧基,其中甲氧基较易断裂,结合黄酮类化合物的断裂规律,可以推断出各环上取代基情况。选取23个黄酮成分中的部分代表性结构进行解析。
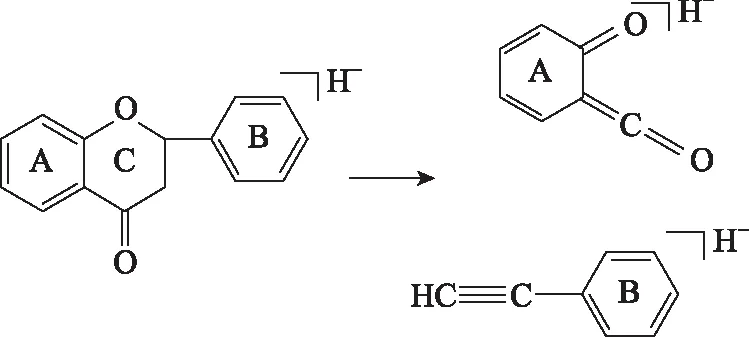
图2 黄酮裂解方式
化合物1(tR=5.56 min)在负离子模式下,根据母离子m/z609.143 6[M-H]-,得到化学式为C27H30O16。在MS2中,特征碎片离子为m/z447.091 0[M-H-C6H11O5]-、m/z285.039 5[M-H-C6H11O5-C6H10O5]-,由此推断其结构中含有1分子鼠李糖,1分子葡萄糖,结合文献推测化合物1为黄酮醇苷类成分芦丁[6]。
化合物14(tR=18.5 min)在负离子模式下,根据母离子m/z271.061 5[M-H]-,得到化合物化学式为C15H12O5。在MS2中,特征碎片离子为m/z151.003 8(1,3A-)、m/z119.051 2(1,3B-),表明A环上存在2个羟基,B环上存在1个羟基,结合文献推测化合物14为二氢黄酮成分柚皮素[9]。
化合物20(tR=24.18 min)在负离子模式下,根据母离子m/z359.113 0[M-H]-,得到化合物化学式为C19H20O7。在MS2中,特征碎片离子m/z344.088 6[M-H-CH3]-、m/z329.064 6[M-H-OCH3]-、m/z223.058 5[M-H-(B ring+CH)]-、m/z208.037 0[M-H-(B ring+CH)-CH3]-和m/z169.049 6,表明1,3A-失去1个CO,结合前面的碎片提示A环有1个甲氧基、1个甲基、2个羟基,结合文献推测化合物20为高异黄酮成分麦冬黄烷酮E[11]。
化合物22(tR=25.76 min)在正离子模式下,根据母离子m/z343.117 2[M+H]+,得到化合物化学式为C19H18O6,在MS2中,特征碎片离子为m/z207.065 9、m/z135.044 3,推断高异黄酮C3-C9键断裂,结合文献推测化合物22为高异黄酮成分甲基麦冬黄烷酮A[11]。
化合物1、14、20、22的二级质谱见图3。

图3 消癌解毒方黄酮类化合物1、14、20、22的二级质谱图
3.2 体内原形成分鉴定
结合从消癌解毒方水煎液中鉴定出的黄酮类化合物质谱信息,进而分析其给药后在大鼠体内的分布情况。结果表明,在大鼠心、肝、脾、肺、肾、肠、脑、胃、血浆、尿液和粪便中分别鉴定出5、5、3、3、5、6、6、12、3、2和10个黄酮类成分。其中化合物6-甲氧基柚皮素(13)、柚皮素(14)、4′-羟基汉黄芩素(15)、芹菜素(16)和汉黄芩素(19)在多种样品中被检出,6-甲氧基柚皮素在所有样品中被检测出,柚皮素和芹菜素在心、肝、肾、肠、脑、胃和粪便中被检出,4′-羟基汉黄芩素在除血浆和尿液外的其他样品中被检测出,汉黄芩素在除血浆样品外的各样品中均被检出。详细信息见表2,相应的质谱图见图4。

表2 消癌解毒方黄酮类成分在给药后大鼠体内的分布

注:A.心;B.肝;C.脾;D.肺;E.肾;F.肠;G.脑;H.胃;I.血浆;J.尿液;K.粪便。图4 各生物样品在负离子模式下的总离子流图
4 讨论
当前癌症发病率和病死率不断增长,其发生发展与环境、生活方式、经济水平等因素有关。目前癌症的临床治疗以化疗为主,但存在化疗药物不良反应较多、易产生耐药性等问题。相对于单独化疗,消癌解毒方联合化学治疗可以取得更好的疗效,并降低化疗药物的不良反应,提高患者免疫力,提高生活质量[12-14]。本方中半枝莲为君药,具有清热解毒、活血化瘀、消肿止痛的功效。半枝莲水煎液中主要为一些黄酮类化合物[6]。研究显示,半枝莲中的4′-羟基汉黄芩素通过破坏磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)信号通路传导来抑制结直肠癌血管生成。本实验中,在半枝莲及肠组织中均检测出4′-羟基汉黄芩素成分,说明4′-羟基汉黄芩素能够到达病灶部位[15]。半枝莲中的其他黄酮类化合物,如汉黄芩素、野黄芩苷、芹菜素、木犀草素和黄芩素等同样具有抗肿瘤活性[16-17]。因此本实验主要研究对象为半枝莲中黄酮类成分。
近年来液质联用技术被广泛应用于药物研究中,该技术灵敏度和精密度高、选择性好,能够快速发现和表征目标成分,结合数据库能够准确鉴定中药复方复杂体系中的化合物[18]。因此,本实验运用UPLC-Q-TOF-MS技术对消癌解毒方水提液及大鼠给药后体内相关部位的黄酮类成分进行分析,阐释某一类成分在进入体内前后的变化和分布规律,为下一步研究提供参考和依据。
本实验在制备供试品溶液时采用固相萃取技术,使样品得到净化和富集,以期得到药材中更为全面的黄酮类化合物信息。根据文献研究,甲醇沉淀蛋白法更快速简便,取样量较少,经济方便[19-20]。为了更快速、方便地检测样品,本研究中生物样本处理采用甲醇沉淀法。而从检测结果来看,血浆中检测到的原型成分较其他生物样品少。究其原因,一方面可能是蛋白沉淀法提取血浆样品效率不高;另一方面可能是中药成分吸收入血后在体内不仅会与血浆蛋白结合,还会与组织蛋白等高分子物质结合,某些成分与组织的亲和力更好,因此这些药物在组织中的浓度较血浆中高,而血浆中的药物浓度过低,低于仪器的检测限,因此无法检测到。
消癌解毒方中黄酮类化合物的取代基多为羟基、甲基、甲氧基等,根据黄酮类化合物的质谱裂解规律,可以推断出各环上存在何种取代基,该方法对于已知目标化合物可实现快速分析,但因取代基位置无法确定,亦存在一定的局限性,特别是对于多种同分异构体的准确分析还需要结合其他技术手段。
