基于改性铁矿石载氧体的煤化学链转化
2020-03-04王海涛魏国强赵增立房倚天李海滨
王海涛, 林 延, 魏国强, 黄 振,4,赵增立, 房倚天, 李海滨,4
(1.中国科学院 广州能源研究所,广东 广州 510640;2.中国科学院 可再生能源重点实验室,广东 广州 510640;3.中国科学院大学,北京 100049;4.中国科学院 洁净能源创新研究院,辽宁 大连 116023;5.中国科学院 山西煤炭化学研究所,山西 太原 030001)
作为中国电力生产的主要能源原料,煤是温室气体CO2排放的主要源头,因而煤的清洁高效利用对减少温室气体的排放具有重要的意义。化学链燃烧是一种新型的燃烧方式,通过载氧体在燃料反应器与空气反应器间的交替循环实现氧的转移,可以分步完成燃烧过程,实现能量的梯级利用[1]。与传统煤燃烧相比,煤化学链燃烧具有一些潜在的优点[2]:1)减少了燃烧过程中的损,具有更高的能源利用效率;2)避免了煤与空气直接接触,降低了氮氧化物的产生;3)可在近零能耗情况下实现烟气中CO2的内分离。因此,煤化学链燃烧具有良好的应用前景。
载氧体作为携带氧和热量的介质,其理化性质直接决定了化学链燃烧系统的性能。化学链燃烧中的载氧体要具有良好的氧化还原性能、较高的机械强度、较好抗烧结性和较低的价格等特点[3]。目前,人工合成载氧体,如过渡金属氧化物载氧体、硫酸盐载氧体等[4-9],已在化学链燃烧过程中受到广泛关注。然而,人工合成载氧体的制备成本高、工艺复杂。与之相比,天然矿石载氧体具有成本低廉、机械强度较高、环境友好等优点[10],但其反应活性较低。为了提高天然矿石载氧体的反应活性,可以引入碱(土)金属元素(如K、Na、Ca等[11])或过渡金属(如Ni、Cu等[12])对其改性。虽然改性矿石载氧体也属于人工制备载氧体,但相对于完全人工合成的载氧体(如钙钛矿载氧体、纯过渡金属氧化物载氧体),其成本显著降低、制备工艺大幅简化。同时,由于外源活性物质的引入,改性矿石载氧体的反应活性得到显著提高。因此,改性矿石载氧体同时具备了反应活性高和制备成本低的特点,是化学链转化过程中应用前景良好的一类载氧体。
因Fe2O3含量高、廉价易得、环境友好,天然赤铁矿成为煤化学链燃烧中一个重要的载氧体选择;但其反应活性较低,需要改性处理。目前,已有大量学者对天然铁矿石载氧体的改性进行了研究。
张思文等[13]研究了Na改性铁矿石载氧体的煤化学链燃烧性能,发现用Na改性铁矿石载氧体时,其CO2和C的捕集效率远高于未改性铁矿石载氧体的。陈定千等[14]研究发现,在铁矿石中机械混合少量NiO/Al2O3载氧体,能够有效改善其反应活性,提高系统CO2捕集率;然而采用浸渍法制备的Ni改性铁矿石载氧体,在煅烧后,系统CO2捕集率显著下降,这是因为其微观孔隙结构变差,煤气化产物与载氧体间无法充分进行反应。
天然赤铁矿载氧体的掺杂改性多采用碱(土)金属或过渡金属进行,然而目前对碱(土)金属和过渡金属掺杂改性效果的研究较少。同时,在中国的各煤种中,褐煤是一种低阶煤,其挥发分含量高,适合于化学链燃烧[15-16]。因此,笔者以褐煤为化学链燃烧原料,以天然赤铁矿为载氧体基体,考察不同金属元素(包括碱(土)金属K、Na、Ca和过渡金属Ni、Cu、Mn)掺杂对其反应性能的影响,并研究褐煤与(改性)铁矿石载氧体进行化学链燃烧反应的性能。
1 实验部分
1.1 原料与试剂
褐煤,云南某煤矿产品,其工业分析及元素分析如表1所示。天然赤铁矿,由湖南华菱涟源钢铁有限公司提供,其组成分析如表2所示。制备改性载氧体所用的试剂:硝酸钾(KNO3)、硝酸钠(NaNO3)、氧化钙(CaO)、氧化镍(NiO)、氧化铜(CuO)、二氧化锰(MnO2)等,均为分析纯,购自喀斯玛商城。

表1 云南褐煤的元素分析与工业分析Table 1 Proximate analysis and ultimate analysis of Yunnan lignite

表2 赤铁矿的组成分析Table 2 Component analysis of hematite w/%
1.2 改性载氧体的制备
采用高温煅烧法制备改性铁矿石载氧体。由于天然铁矿石的孔隙少,比表面积小(约为1 m2/g),采用高温煅烧法制备载氧体时,外来金属离子仅负载在铁矿石表面,很难进入铁矿石内部。设定金属负载的质量分数为10%,具体制备方法如下:首先按比例分别称取一定质量的铁矿石和金属盐(或金属氧化物),混合均匀,置于950 ℃马弗炉中高温煅烧3 h,然后将冷却后的样品研磨成粉末并密封保存。将经KNO3、NaNO3、CaO、NiO、MnO2、CuO改性的载氧体分别标记为K-H、Na-H、Ca-H、Ni-H、Mn-H、Cu-H;将未改性铁矿石载氧体标记为F-H。
1.3 分析表征
载氧体元素分析采用荷兰PANalytical公司的AXIOSmAX-PETRO波长色散X射线荧光光谱仪(XRF);载氧体的晶相分析采用荷兰PANalytical公司的X’ Pert PRO MPD X射线衍射仪,扫描速率为2 °/min,扫描范围为5°~80°。
采用美国康塔公司的CPB-1型全自动程序升温化学吸附分析仪进行H2-TPR实验,研究载氧体的氧化性能,还原气氛为H2/Ar(体积比为1∶9),气流流量为120 mL/min,升温速率为10 ℃/min。
采用德国耐驰公司的STA449F3同步热分析仪分析载氧体与褐煤的反应特性。吹扫气与保护气均为Ar,其流量分别为40 mL/min和20 mL/min。载氧体与褐煤混合质量约为10 mg,混合样品以 10 ℃/min 的升温速率,从50 ℃升到950 ℃,然后保温1 h。
2 结果与讨论
2.1 晶相分析
天然铁矿石与改性铁矿石载氧体的物相分析如图1所示。由图1可知:天然铁矿石的主要活性物相为Fe2O3;碱(土)金属或过渡金属的负载明显改变了铁矿石的物相。其中,K改性载氧体的活性组分除Fe2O3外,还存在新的物相K2Fe22O34,因为K在高温下与Fe2O3反应生成了活性固溶体[17];Na改性载氧体的活性组分除Fe2O3外,还存在新的物相Na0.68Fe0.68Si0.32O2,推测为NaNO3分解后生成的Na2O与铁矿石中Fe2O3和SiO2反应的产物;Ca改性载氧体和Cu改性载氧体的主要物相除Fe2O3外,还分别生成了CaFe2O4和CuFe2O4,二者为CaO、CuO在高温下与Fe2O3反应形成的活性固溶体[18-19];Mn改性的载氧体的主要物相为Fe2O3、MnFeO3与Mn2O3,Mn2O3为MnO2分解的产物,是一种活性物质,MnFeO3为Mn2O3与Fe2O3在高温下反应形成的固溶体[20]。Ni改性载氧体的主要物相为Fe2O3、NiO与NiFe2O4,NiFe2O4为NiO在高温下与Fe2O3反应形成的活性固溶体[21],同时部分活性物质NiO存在于改性载氧体中。
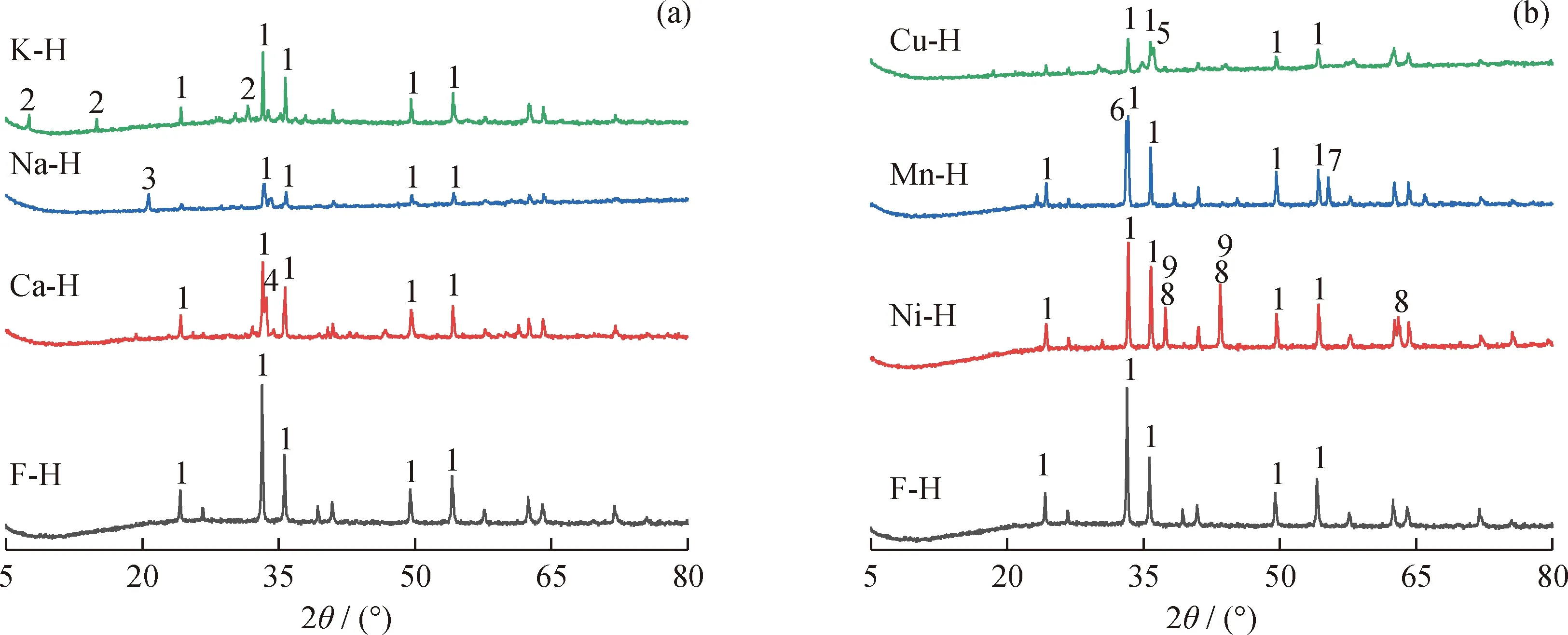
图1 载氧体的XRD图谱Fig.1 XRD patterns of oxygen carriers(a) K-H, Na-H, Ca-H, F-H; (b) Cu-H, Mn-H, Ni-H, F-H1—Fe2O3; 2—K2Fe22O34; 3—Na0.68Fe0.68Si0.32O2; 4—CaFe2O4; 5—CuFe2O4; 6—MnFeO3; 7—Mn2O3; 8—NiFe2O4; 9—NiO
在制备过程中,由于K或Na的一些化合物(如氧化钾或氧化钠)在高温下不稳定,可能会引起K或Na的损失。对K改性和Na改性载氧体进行XRF分析发现:K改性载氧体中K负载质量分数为9.15%,Na改性载氧体中Na负载质量分数为11.44%,均与设定的碱金属负载质量分数(10%)相近,从而可认为制备过程中K与Na的损失较少。Ca、Mn、Ni和Cu的化合物沸点较高,在制备过程中不会因挥发而损失,因此其负载质量分数符合负载设定值。
2.2 H2-TPR表征
H2-TPR实验中H2还原峰温度的高低可以反映载氧体中不同状态金属离子被还原的难易程度,即反映金属氧化物(M—O)断键的难易程度,从而表征金属氧化物的反应活性[22]。图2为改性载氧体的还原曲线。由图2可知,铁矿石的还原曲线(F-H)存在3个H2还原峰,出现在538 ℃、697 ℃和817 ℃附近,分别对应着Fe2O3物相逐级还原成Fe3O4、FeO和金属单质Fe[21]。
由图2(a)可以看出,K、Na、Ca的负载均使H2-TPR曲线中的主还原峰向低温区移动,说明K、Na、Ca的添加显著地提高了天然铁矿石载氧体的反应活性。这主要归因于改性载氧体中活性中间固溶体(K2Fe22O34、Na0.68Fe0.68Si0.32O2、CaFe2O4)的生成,固溶体中外源金属氧化物具有比原始载氧体(如铁矿石)更强的催化性能或氧化性能,使改性载氧体兼具外源金属氧化物的反应性能和原载氧体的载氧性能,因而固溶体的生成有利于提高铁矿石的反应活性。进一步研究发现,由于主还原峰向低温区移动,引起不同还原反应过程的重叠,致使改性载氧体的H2-TPR曲线的多重峰消失。此外,3种碱(土)金属改性铁矿石载氧体中,K改性载氧体的主还原峰温度最低,且峰值最高。这说明K改性载氧体的反应活性要高于Na改性载氧体和Ca改性载氧体,且三者活性均高于未改性载氧体。
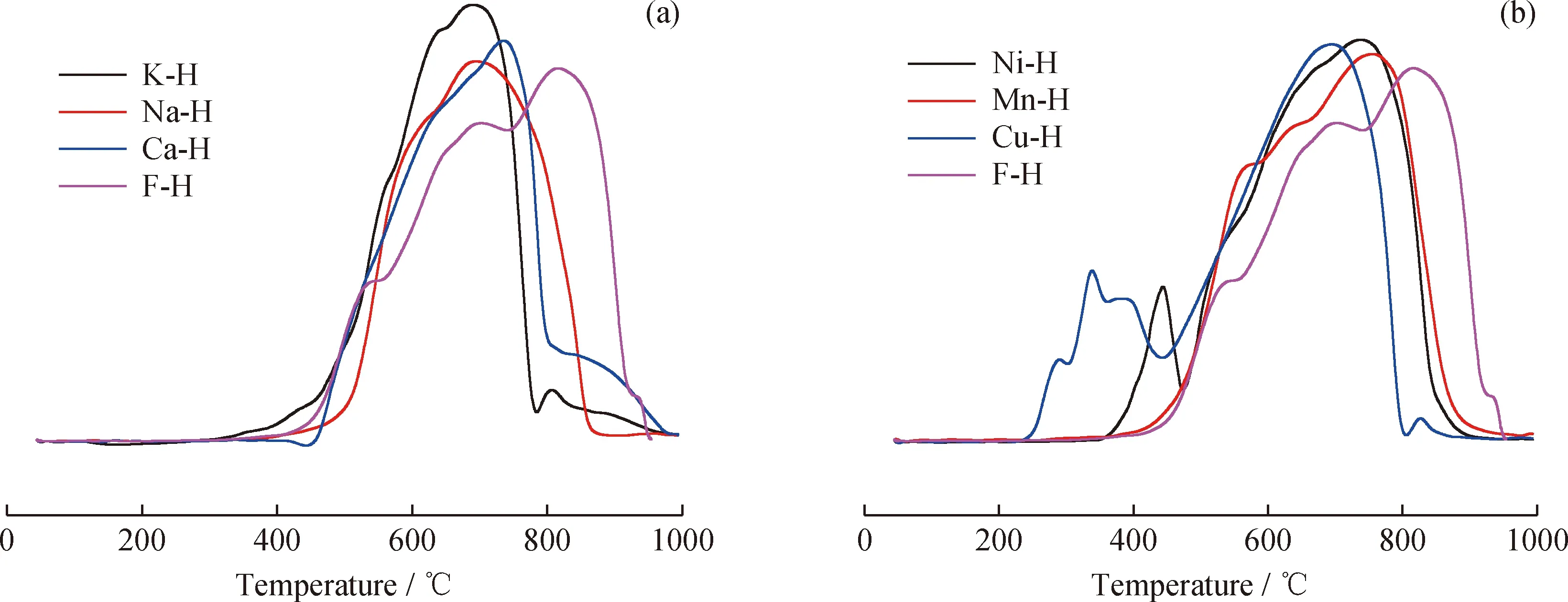
图2 载氧体的H2-TPR曲线Fig.2 H2-TPR curves of oxygen carriers(a) K-H, Na-H, Ca-H, F-H; (b) Cu-H, Mn-H, Ni-H, F-H
同样地,Cu、Mn、Ni的负载也均使H2-TPR曲线中主还原峰向低温区移动,说明Cu、Mn、Ni的负载显著地提高了天然铁矿石载氧体的反应活性。这主要归因于改性载氧体中存在活性中间固溶体(CuFe2O4、NiFe2O4)和活性成分(NiO、Mn2O3)。3种过渡金属载氧体中:1)Cu改性载氧体的还原温度最低,在250 ℃左右就开始还原,同时主还原峰温度明显降低,约为695 ℃,说明固溶体CuFe2O4具有良好的低温反应活性。2)Ni改性载氧体在 450 ℃ 左右存在1个H2还原峰,可能归于活性组分NiO向Ni的还原或NiFe2O4向Ni、Fe3O4的还原,而其主还原峰温度约为740 ℃;3)Mn改性铁矿石载氧体的H2-TPR曲线形状与天然铁矿石类似,在560 ℃附近和700 ℃附近处存在2个小的还原峰,而主还原峰在750 ℃附近。基于上述讨论可以推测出,Ni改性载氧体与Cu改性载氧体的反应活性要明显高于Mn改性载氧体和未改性铁矿石载氧体。由于Cu的熔点较低,在高温下容易烧结而导致载氧体失活[23],因此选择熔点相对较高的Ni改性载氧体进行后续研究。
2.3 铁矿石与褐煤的热重实验
基于热重实验探讨了在载氧体作用下,铁矿石与褐煤质量比(m(O)/m(L))对褐煤转化反应性能的影响,如图3和表3所示。其中,图3为不同m(O)/m(L)下的TG与DTG曲线;表3为混合物质量损失过程的具体信息。由图3和表3可以看出,当样品为纯铁矿石时,热重实验的质量损失仅为2.34%,且在其DTG曲线上没有观察到明显的质量损失峰,表明纯铁矿石在高温下不会分解。当样品为褐煤时,样品出现明显的质量损失,说明褐煤发生热解反应。褐煤DTG曲线上存在2个明显的质量损失峰:其一位于100 ℃附近,归因于褐煤中水分的释放;其二出现在415 ℃附近,归因于褐煤热解引起挥发分的释放。

表3 不同质量比下铁矿石与褐煤热重实验数据Table 3 Mass loss and mass loss peak in TG experiments of iron ore and lignite under different mass ratios
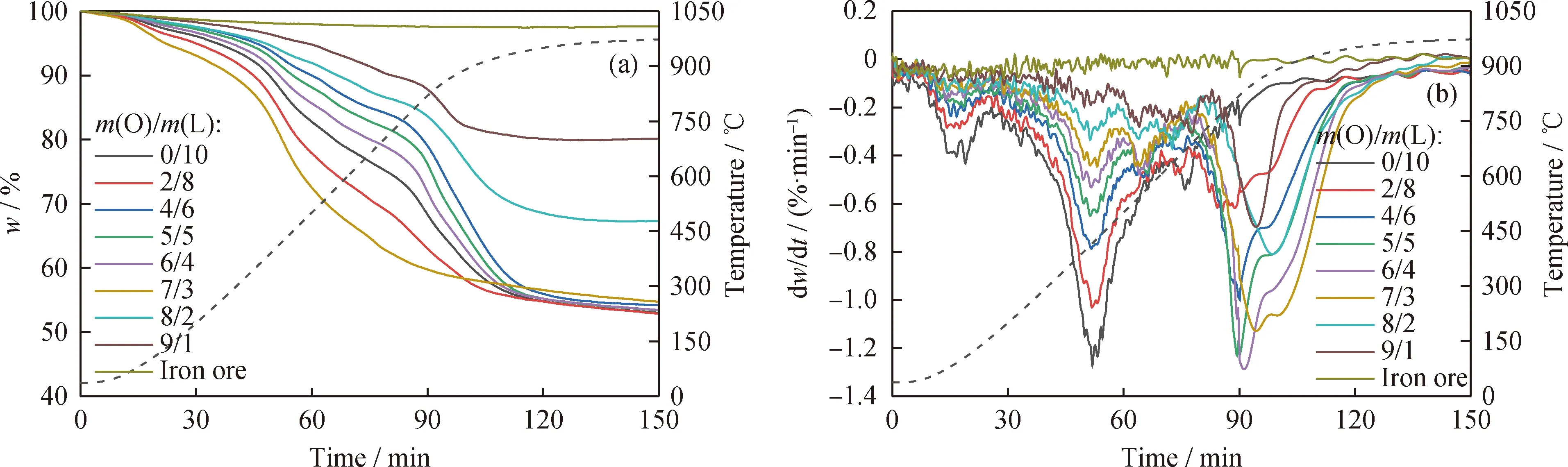
图3 不同质量比下铁矿石与褐煤的TG与DTG曲线Fig.3 TG and DTG curves of iron ore and lignite in different mass ratios(a) TG; (b) DTG
当铁矿石载氧体与褐煤混合物质量比在2/8至9/1范围,样品同样出现了明显的质量损失。同时,在其DTG曲线上观察到3个明显的质量损失峰。前2个质量损失峰分别出现在100 ℃和415 ℃附近,与煤的热解过程类似,分别归因于褐煤水分释放与褐煤快速脱挥发分。由于燃料脱挥发分并不是动力学控制步骤[24],因此,第2个质量损失峰的温度基本保持不变,而其质量损失速率随着褐煤占比的增大而逐渐提高。不同m(O)/m(L)下样品的第3个质量损失峰产生的温度较高,均超过800 ℃,主要归因于褐煤脱挥发分后生成的半焦与载氧体中的晶格氧发生了Redox反应。随着载氧体质量占比的增大,其第3次质量损失速率呈先升高后降低的趋势,并在m(O)/m(L)为5/5至6/4范围时达到最大。这是因为基于“燃料-诱导氧释放”机理,即充足的载氧体-燃料接触点有利于燃料的转化[21];当m(O)/m(L)≤5/5时,载氧体增多为褐煤半焦的转化提供了更多晶格氧,使其反应速率逐渐提高;当m(O)/m(L)≥6/4时,由于褐煤质量占比的减小,载氧体-燃料接触点量减少,进而降低了其反应速率,不利于煤焦的转化。因此,适宜的m(O)/m(L)应保持在5/5至6/4范围,此时失重峰对应的反应温度也相对较低。
2.4 K、Ni改性铁矿石载氧体与褐煤的热重实验
基于H2-TPR实验和热重实验结果,在TG反应器上对比了典型过渡金属(Ni)改性载氧体、典型碱金属(K)改性载氧体及未改性载氧体与褐煤的反应性能,以探究负载金属改性对铁矿石载氧体反应性能的影响,其中载氧体与煤质量比固定为5/5,实验结果如图4和表4所示。图4为不同改性载氧体与褐煤反应的TG与DTG曲线,表4为不同改性载氧体与褐煤热重实验的具体信息。
由图4和表4可知,3种载氧体与褐煤的DTG曲线中前2个质量损失峰分别归因于褐煤脱水分与脱挥发分。K改性载氧体的第1个质量损失峰强度明显高于其他样品,原因在于K改性载氧体在空气中易吸潮,使其水分含量相对较高。褐煤的挥发分量固定,因而3个样品的第2个质量损失峰并没有明显的区别,进一步表明在煤化学链转化过程中,脱挥发分过程不是反应速率的控制步骤,即载氧体的反应活性强弱对煤脱挥发分过程影响很小。

表4 不同载氧体与褐煤的热重实验数据Table 4 Mass loss and mass loss peak in TG experiments of different oxygen carriers and lignite
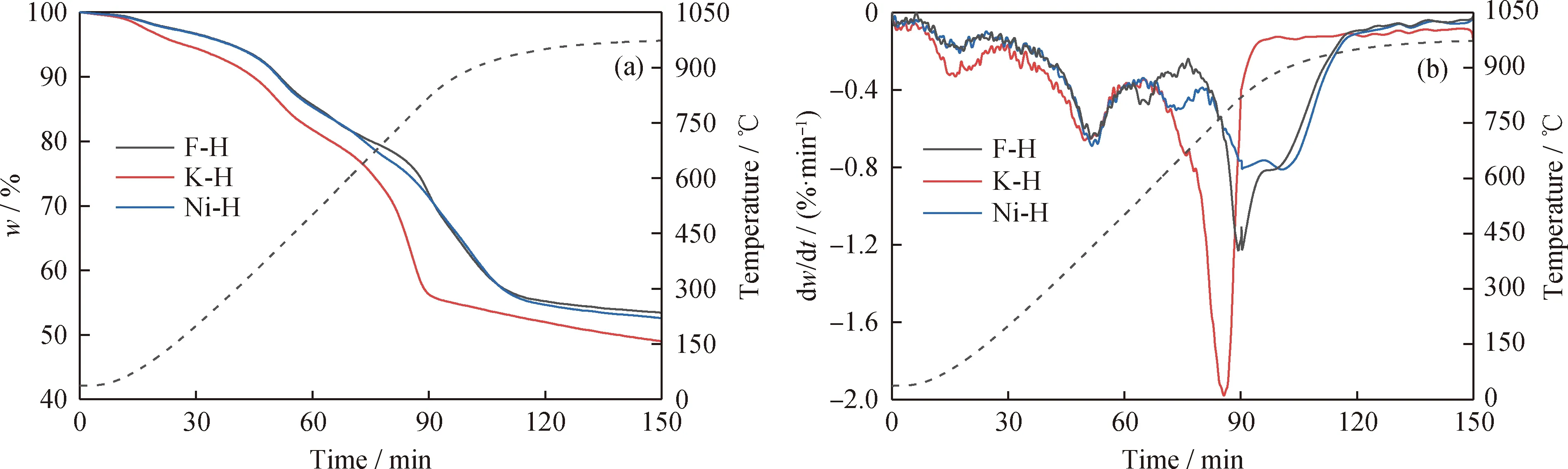
图4 K、Ni改性铁矿石载氧体与褐煤的TG曲线与DTG曲线Fig.4 TG and DTG curves of potassium and nickel modified iron ore oxygen carriers and lignite(a) TG; (b) DTG
载氧体的活性对载氧体与煤焦反应阶段影响很大。Ni改性载氧体与褐煤半焦的反应可分为2个阶段:第一阶段发生在640 ℃附近,主要为改性载氧体中NiO、NiFe2O4物种与褐煤半焦的反应,第二阶段存在2个相邻的肩峰,分别在820 ℃附近和895 ℃附近,对应着Fe2O3与Fe3O4(NiFe2O4失去部分晶格氧后的产物)物相的逐级还原。DTG曲线显示K改性载氧体与褐煤半焦的反应为一剧烈的质量损失阶段,质量损失速率在770 ℃时达到2%/min,质量损失峰温度明显低于Ni改性载氧体(>820 ℃)和未改性载氧体(>820 ℃),同时质量损失速率也明显高于Ni改性载氧体和未改性载氧体,主要归因于K元素改性铁矿石载氧体后形成的高活性固溶体K2Fe22O34具有较强的催化性能[17],能催化煤半焦气化,从而能显著提高载氧体的反应活性。因此,基于上述分析,3种载氧体中,K改性载氧体的反应活性最高,更适用于褐煤的化学链转化过程。
*—Peak value
3 结 论
(1)高温煅烧法可成功地将外来金属元素负载在铁矿石上,不同的外来金属元素与铁矿石结合后分别形成了新的物相,如K2Fe22O34、Na0.68Fe0.68Si0.32O2、CaFe2O4、NiFe2O4、CuFe2O4、MnFeO3。
(2)6种金属元素的改性均提高了铁矿石载氧体的活性,K改性铁矿石载氧体的反应性能优于Na、Ca改性载氧体;Cu、Ni改性载氧体的反应性能优于Mn改性载氧体。K改性铁矿石载氧体与褐煤的反应性能优于铁矿石载氧体和Ni改性铁矿石载氧体,因此K改性铁矿石载氧体为优选的褐煤化学链转化载氧体。
(3)褐煤化学链燃烧过程中,铁矿石载氧体与褐煤适宜的质量比范围为1~1.5。
